Сжимаемость и температурное расширение газов
В отличие от капельных жидкостей газы характеризуются значительной сжимаемостью и коэффициентом температурного расширения.
Зависимость плотности газа от давления и температуры устанавливается уравнением состояния идеального газа.
Запишем уравнение Клапейрона:
r = 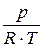 или
или  = R × T или pVуд = R × T, (1.9)
= R × T или pVуд = R × T, (1.9)
где р и Т - абсолютные давление и температура соответственно;
Vуд – удельный объём;
R - удельная газовая постоянная, различная для разных газов, но не зависящая от температуры и давления. Например, для воздуха Rвозд = 287 Дж/(кг К).
Реальные газы в условиях, далёких от сжижения, незначительно отличаются от поведения идеальных газов и для них в довольно широких пределах можно пользоваться уравнениями состояния идеальных газов.
В технических расчётах плотность газов приводят к нормальным физическим условиям (НФУ) Т0 =273 К (0 °С) и р0 =101325 Па (760 мм рт. ст.) или стандартным условиям Т =293 К (20 °С) и р =101325 Па.
Плотность газов при рабочих или рабочих условиях (или данных физических условиях ДФУ) определяется по формуле:
r = r0 × 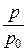 ×
× 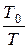 , (1.10)
, (1.10)
где r0 – плотность газа при нормальных (стандартных) условиях;
р0 и Т0 – абсолютные давление и температура при нормальных (стандартных условиях);
р и Т – абсолютные давление и температура при ДФУ .
Выводы, полученные для капельных жидкостей, могут применяться к газу в тех случаях, когда в пределах рассматриваемого явления изменения давления и температуры незначительны.
При движении газов с большими скоростями могут возникнуть изменения давления, а, следовательно, и плотности. Практически при скоростях движения газа до 70..100 м/с газ можно принимать как несжимаемую жидкость (r = const). При больших скоростях движения, а также при большой разности давлений влияние сжимаемости следует учитывать, т.е. полагать, что плотность не постоянна (r ¹ const) и газ рассматривать как сжимаемую жидкость.
Дата добавления: 2015-08-26; просмотров: 1418;
