Теоретические основы горения
По современным теоретическим представлениям горение – быстропротекающая химическая реакция окисления, сопровождающаяся интенсивным выделением тепловой энергии, резким повышением температуры и излучением. Видимое горение называют пламенем. Соответственно пламя – газообразная среда, в которой происходит горение. Обычно горение происходит в воздухе, и горючие компоненты топлива окисляются кислородом воздуха. Горение газов – гомогенный процесс, а жидкого и твердого топлива – гетерогенный. Для протекания процесса горения необходимы следующие условия:
– горючий газ и воздух должны вступить в физический контакт и смесеобразование;
– смесь воздуха и газа должна находиться в концентрационных границах (пределах) воспламенения;
– должен быть создан источник воспламенения и обеспечена стабилизация фронта горения.
Процесс горения сложный физико-химический процесс, скорость которого определяется интенсивностью физических и химических явлений и особенностями их взаимодействия. К физике горения имеет самое тесное отношение вопросы статистической физики, теплообмена, гидродинамики и газодинамики.
В процессе горения химия неразрывно соединена с аэро- и термодинамикой. Под горением в широком смысле следует понимать химические и аэротермодинамические процессы, происходящие в движущейся или неподвижной химически активной газовой смеси.
Горение – один из важнейших для природы и человеческой практики физико-химических процессов. Все явления горения тесно связаны с представлениями и законами химической кинетики. Горение – сложный многофакторный процесс, включающий химическую кинетику, термодинамику, тепломассоперенос, газо- и гидродинамику течений. Высвобождение химической энергии при горении порождает градиенты давления, температуры и плотности. Эти градиенты в свою очередь, являются источниками процессов, которые приводят к переносу массы, импульса и энергии.
Основной вклад в создании современных представлений о цепном механизме реакций горения внесли академик Н.Н. Семёнов и его школа. За разработку теории цепных реакций Н.Н. Семёнову и английскому учёному С.Н. Хиншелвуду была присуждена Нобелевская премия. Согласно теории цепных реакций горение протекает в виде разветвлённых и неразветвлённых цепей, состоящих из элементарных актов превращений. В цепной реакции участвуют радикалы, атомы и другие неустойчивые промежуточные соединения. (Радикалы частицы с неспаренными электронами на внешних атомных или молекулярных орбиталях.) В качестве активных центров цепной реакции выступают радикалы, обычно радикалы водорода. Зарождение цепи начинается с эндотермического процесса образования активных центров:
Н2 + М = Н + Н + М.
Наиболее изученным является механизм горения водорода в кислороде, который состоит из следующих элементарных стадий (актов):
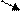
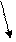 Н + О2 → ОН + Н2 → Н
Н + О2 → ОН + Н2 → Н
Н2О
 О + Н2 → Н
О + Н2 → Н
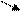 ОН + Н2 → Н
ОН + Н2 → Н
Н2О
Механизм горения метана представляет собой довольно сложную совокупность цепных реакций с образованием на отдельных стадиях стабильных и нестабильных промежуточных продуктов. Предполагаемый механизм цепного горения метана в кислороде при стехиометрическом соотношении следующий:
1. Н + О2 → ОН + О
СН4 + ОН → СН3 + Н2О
СН4 + О → СН3 + ОН→ СН2 + Н2О
2. СН3 + О2 → НСНО + ОН
СН2 + О2 → НСНО + О
3. НСНО + ОН → НСО + Н2О
НСО + О2 → СО + О + ОН
НСНО + О → СО + Н2О
4. СО + О2 → СО2
СО + ОН → СО2 + Н
Ещё более сложный механизм горения метана в воздухе, особенно при отклонении от стехиометрического соотношения.
На скорость химических реакций горения оказывают влияние температура, природа (химическое строение), соотношение воздуха и топлива, давление и катализаторы. Зависимость скорости горения от различных факторов описывается уравнением Аррениуса:
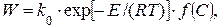 (1.1)
(1.1)
где k0– предэкспоненциальный множитель (константа);
E – энергия активации, кДж/кмоль;
R – газовая постоянная, кДж/(кмоль· К);
Т – абсолютная температура, К;
С – концентрация реагирующих веществ.
На величину скорости горения существенное влияние оказывает температура. Повышение температуры примерно на 10 градусов приводит к увеличению скорости горения W в два раза.
Численное значение энергии активации Е для большинства газовых смесей лежит в пределах от 80 до 170 кДж/моль. Через величину Е проявляется влияние на скорость горения W природы реагирующих веществ.
С повышением давления скорость горения возрастает. В большинстве случаев сжигание газового топлива производится при атмосферном давлении, поэтому влияние давления на величину W не проявляется. В случае сжигания газового топлива в двигателях влияние давления существенно.
Воспламенение и горение топливовоздушных смесей происходит в определённых концентрационных границах. Наличие пределов горения (нижнего и верхнего) объясняется тепловыми потерями или тепловым балансом в зоне горения. Пределы воспламенения топливовоздушных смесей расширяются с повышением температуры. Влияние давления на пределы воспламенения носит сложный характер.
Возникшее пламя или фронт горения самопроизвольно распространяется в объёме газовоздушной смеси. Скорость нормального распространения пламени, т.е. в направлении перпендикулярном к поверхности фронта горения в каждой его точке, зависит от физико-химических характеристик смеси и от её гидравлического режима (неподвижный, ламинарный и турбулентный). Для расчета нормальной скорости распространения пламени, которая наблюдается в неподвижной смеси и в ламинарном потоке рекомендуется следующая приближённая формула:
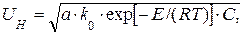 (1.2)
(1.2)
где, а – коэффициент температуропроводности, а = l / r · с,
здесь l – коэффициент теплопроводности;
r – плотность;
с – теплоёмкость смеси.
Для заданного состава смеси Uн зависит только от температуры. Максимальные значения Uн наблюдается для составов смесей близких к стехиометрии (коэффициент избытка воздуха a = 0,95 ¸ 1,0). С уменьшением и с увеличением коэффициента a величина Uн снижается. На пределах горения наблюдаются минимальные значения Uн.
Распространение пламени в турбулентном потоке имеет очень сложный механизм. До сих пор нет единого мнения о процессах, протекающих в зоне турбулентного горения. Крайними точками зрения являются «поверхностная» и «объёмная» модели горения. Величина турбулентной скорости распространения пламени для мелкомасштабной и крупномасштабной турбулентности определяется соответственно по формулам:
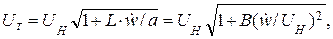 (1.3)
(1.3)
где L – масштаб турбулентности;
ẃ – пульсационная скорость;
В – константа, зависящая от физико-химических свойств топлива.
Различают два предельных метода (принципа) сжигания: кинетический и диффузионный. При кинетическом методе однородная смесь с некоторым избытком воздуха (a > 1) приготавливается заранее. Скорость процесса кинетического горения определяется физическими и кинетическими свойствами топливовоздушной смеси. При диффузионном методе процесс смесеобразования совмещается с процессом горения, поэтому скорость диффузионного горения определяется аэродинамическими, диффузионными факторами.
В теплотехнической практике широко используется промежуточный или смешанный метод сжигания газа. В этом случае газ предварительно смешивается с частью воздуха, необходимого для горения (a = 0,4 ÷ 0,8), а остальное количество воздуха (a > 1) поступает непосредственно в зону горения. Таким образом, процесс горения происходит в две стадии. На первой стадии по кинетическому принципу за счёт первичного воздуха и на второй стадии по диффузионному принципу за счёт вторичного воздуха.
Все стадии процесса горения (смесеобразование, подогрев и горение) осуществляются в горелке и камере горения (топочной камере). Основные функции горелки:
▪ подача газа и воздуха в топку;
▪ смесеобразование:
▪ стабилизация фронта воспламенения:
▪ обеспечение минимальной эмиссии токсичных веществ.
В горелках, реализующих кинетический и промежуточный метод сжигания газа, смесеобразование происходит обычно в эжекторе (инжекторе). Стабилизация фронта горения необходима для предотвращения проскока и отрыва пламени.
Для снижения эмиссии токсичных веществ используются различные способы и устройства организации горения, разработанные на основе теоретических и экспериментальных исследований. Некоторые из них рассмотрены ниже.
Дата добавления: 2015-06-22; просмотров: 2823;
