Германий Ge
Широко распространённый, но сильно рассеянный элемент.
В настоящее время получают при побочной переработке материалов других производств: при выплавке медно-свинцово-цинковых руд, из отходов коксования углей. Из исходного сырья получают тетрахлорид германия GeCl4, который подвергают гидролизу по схеме:
GeCl4+2H2O → GeO2+4HCl;
GeO2+2H2 → Ge+2H2O.
Процесс восстановления производится в электрических печах при температуре около 700˚С с использованием графитовых тиглей. Получают порошок германия, плавят его и подвергают кристаллизации. Чистый германий характеризуется металлическим блеском, высокой твёрдостью и хрупкостью.
При комнатной температуре германий химически устойчив. При 650˚С образуется оксид GeO2, который хорошо растворим в воде.
Tпл = 936˚С;
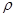 = 0,47Ом·м;
= 0,47Ом·м;
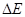 = 0,665 эВ;
= 0,665 эВ;
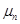 = 0,39 м2/В·с;
= 0,39 м2/В·с;
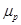 = 0,19 м2/В·с
= 0,19 м2/В·с
(все характеристики кроме температуры плавления даны для Т = 300К)
Легирование германия производится элементами III и V групп.
Собственные полупроводниковые свойства при комнатной температуре германий проявляет при содержании примеси в количестве ~ 10-19 на 1 м3, что при современном уровне технологии невозможно. Таким образом, при комнатной температуре германий всегда примесный.
Германий применяется относительно редко, на смотры на то, что приборы, изготовленные из него, обладают рядом очевидных преимуществ. Германиевые транзисторы, диоды (в том числе и выпрямительные), лавинопролётные, туннельные, варикапы, датчики высокочастотны (это связано с малой шириной запрещённой зоны).
Не применяется в основном по 2 причинам:
1. Узкий рабочий диапазон температур: -60…+70˚С;
2. Технологическая причина: маскирующий материал для кремния – его оксид SiO2, а для германия GeO2 не может служить маской.
Помимо этого, германий дороже кремния.
Дата добавления: 2015-06-17; просмотров: 850;
