Катализ
Катализом называется изменение скорости химических реакций в результате воздействия веществ-катализаторов, которые, участвуя в процессе, остаются по окончании его химически неизменными.
Катализаторы не связаны стехиометрическими соотношениями с реагирующими веществами. Катализатор – наиболее эффективное и рациональное средство ускорения химических реакций. Катализаторами могут быть различные вещества: газы, жидкости и твёрдые тела. По фазовому состоянию катализаторов и реагентов процессы разделяют на две основные группы: гомогенные и гетерогенные. В особую группу выделяют микрогетерогенный и ферментативный катализ (катализаторы – коллоидные частицы неорганической и органической природы).
Если в присутствии катализаторов реакции ускоряются, то это положительный катализ, и это понятие часто отождествляется с общим понятием – «катализ». Однако, существуют и применяются вещества, замедляющие химические реакции. Это явление называют отрицательным катализом, а вещества – ингибиторами.
В общем случае ускоряющее действие катализатора принципиально отличается от действия других факторов, интенсифицирующих химические реакции: температура, давление, радиация и т.п. При внесении катализаторов энергетический уровень реагирующих молекул не изменяется, как происходит, например, при воздействии температуры. Роль катализа состоит в понижении энергии активации химической реакции в результате изменения реакционного пути. В этом случае реакция протекает через ряд элементарных стадий, которые требуют в совокупности меньшей энергии активации, чем прямая реакции без катализатора:
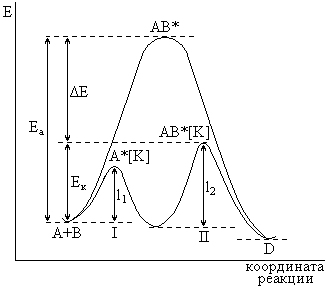
Поскольку константа скорости реакции напрямую связана с энергией активации
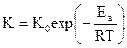 ,
,
даже незначительное снижение Eа приводит к резкому ускорению скорости процесса.
Ускоряющее действие катализатора измеряется его активностью А, которая определяется соотношением констант скорости реакций с катализатором и без него:
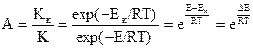 .
.
Так, например, если ΔE = 50 кДж/моль, то при 600 К
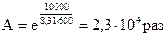
Снижение энергии активации не является единственной причиной резкого повышения скорости процесса, катализатор может влиять и на K0.
Таким образом, при открывании нового реакционного пути катализатор является активным участником процесса, что выражается в образовании с реагирующими веществами неустойчивых промежуточных соединений – активированных комплексов, после распада которых катализатор регенерируется.
От активности катализаторов зависит их температура зажигания, то есть та минимальная температура реагирующих веществ, при которой катализатор работает.
Каталитические процессы делят на основных класса:
I – окислительно-восстановительного взаимодействия
II – кислотно-основного взаимодействия
Каждый класс делится на группы по типу реакции. Типичные катализаторы для I класса – металлы (проводники) или оксиды и сульфиды металлов (полупроводники). Для II класса типичные катализаторы – растворённые кислоты и основания, ионные кристаллы, ионные аморфные гели и т.д. (все они – изоляторы) Такая классификация катализаторов связана с различными механизмами окислительно-восстановительного и кислотно-основного катализа. Общий механизм окислительно-восстановительного катализа заключается в обмене электронами между катализатором и реагентами, который облегчает электронные переходы в реагирующих молекулах. Механизм обычного ионного, кислотно-основного катализа заключается в обмене ионами или протонами между катализатором и реагирующими молекулами.
Катализатор может ускорять только одну реакцию или группу реакции различных групп, то есть катализатор обладает различной специфичностью.
| Пример реакции | Продукты | Катализаторы |
| I. Ox-Red | ||
| 1. Окисление | ||
| Полное CO → CO2 Неполное NH3 → NO Окисление CH4 воздухом Окисление C2H4 воздухом | обезвр. CO HNO3 CH2O CH3–CHO | оксиды Mn, Cu, Co, Hg (гопкалит) Pt оксиды азота (NO2) Cu, Ag |
| 2. Гидрирование, дегидрирование | ||
| Синтез NH3 Гидрирование этилена (ненасыщенных органических соединений) Деструкция гидрированного октана | NH3 этан бутан | Fe Ni, Pt MoO3, MoS2 |
| II. H+, OH- | ||
| 1. Гидратация, дегидратация, поликонденсация | ||
| Гидратация этилена Гидролиз хлорбензола Поликонденсация фенола и формальдегида | C2H5OH C6H5OH фенолформальдегидная смола (ФФС) | H2SO4 MgCl2, H3PO4 H2SO4 |
| 2. Крекинг и изомеризация | ||
| Крекинг нефти Алкилирование изобутана Полимеризация C2H4 Дегидрохлорирование C2H5Cl | Бензин Изооктан Полиэтилен (ПЭ) C2H4 | алюмосиликаты H2SO4 Al(C2H5)3 + TiCl4 BaF2 |
Для реакций I класса универсальным катализатором являются Pt и Ni, для II – H+.
Избирательный (селективный) катализ – это катализ, при котором ускоряется только одна целевая реакция из нескольких возможных. Особенно он важен в органическом синтезе. Из одних и тех же веществ с использованием селективных катализаторов можно получить различные продукты:
C3H7OH 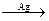 CH3COCH3 + H2
CH3COCH3 + H2
C3H7OH 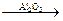 C3H6 + H2O
C3H6 + H2O
Автокатализ – химические процесс, в которых катализаторами служат промежуточные или полученные продукты. К ним относятся некоторые реакции разложения, горения, полимеризации, восстановления Ni и Cr из оксидов водородом, взаимодействие перманганата калия с щавелевой кислотой (kat – образующийся Mn2+). Для этих процессов характерен индукционный период.
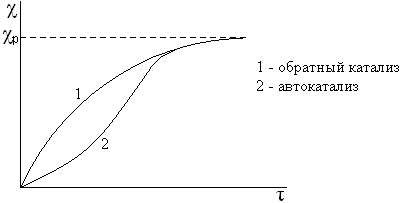
Каталитические свойства катализатора зависят не только от химической природы, но и от способа их приготовления. Большое влияние на активность катализатора оказывает характер поверхности катализатора. Особо важную роль играют активные центры, то есть участки поверхности, имеющие повышенную активность. Это, как правило, геометрические неоднородности поверхности: пики, углы, рёбра кристаллов или микроструктурные дефекты поверхности.
Промышленные катализаторы (их иногда называют контактами) – это, обычно, смеси нескольких веществ (контактная масса), из которых выделяют собственно катализатор, а также активаторы и носители.
Активаторы, или промоторы – вещества, повышающие активность основного катализатора. Обычно это оксиды щелочных и щелочноземельных металлов. Механизм действия активаторов сложен и до конца ещё не выяснен.
Носители, или трегеры – термостойкие инертные пористые вещества, на которые осаждением или другим способом наносят катализатор. Этот приём увеличивает поверхность катализатора, её прочность, предохраняет от спекания. В качестве носителей обычно используют пемзу, асбест, силикагель, алюмогель, керамику и т.д.
Основные методы изготовления катализаторов:
1. Осаждение гидроксидов или карбонатов из растительных солей на носитель, либо совместно с носителем с последующим формованием и прокаливанием.
2. Совместное прессование порошков катализатора, активатора, носителя с вяжущим веществом и отжиг.
3. Сплавление нескольких веществ с последующим выщелачивание одного из них (Ni Ренея) или восстановлением оксидов водородом.
4. Пропитка пористого носителя катализатором и активатором с последующей сушкой и прокалкой.
Дата добавления: 2015-06-17; просмотров: 1156;
