Фазы сплавов
В сплавах компоненты могут вступать во взаимодействие с образованием следующих фаз: жидкие и твердые растворы, химические соединения.
Жидкий раствор – однородная смесь двух и более компонентов, которые равномерно распределены в виде отдельных атомов, ионов или молекул.
Твердым раствором называют фазу, состоящую из двух и более компонентов, один из которых, сохраняя кристаллическую решетку, является растворителем, а другие равномерно распределяются в решетке растворителя не меняя ее типа. В зависимости от характера распределения компонентов различают твердые растворы внедрения (атомы растворимого вещества располагаются в междоузлиях с максимальными размерами решетки растворителя), а при замещении части атомов растворителя на атомы растворимого вещества образуются твердые растворы замещения. В обоих случаях происходит искажение кристаллической решетки (при замещении как рост, так и уменьшение а, при внедрении – только рост а) и изменение свойств сплавов по сравнению с исходными материалами (рост 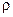 и твердости, уменьшение пластичности, ТКЛР и вязкости).
и твердости, уменьшение пластичности, ТКЛР и вязкости).
Твердые растворы внедрения образуют переходные металлы с неметаллическими элементами, имеющими атомы малого R (главное условие образования - соответствие 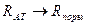 ), например, углерод в
), например, углерод в 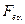 и
и 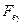 .
.
Твердые растворы замещения могут быть с ограниченной и неограниченной (любое соотношение масс компонентов) растворимостью. Для неограниченной растворимости необходимы:
· изоморфность решеток компонентов;
· различие в параметрах решетки 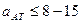 %;
%;
· одинаковое строение внешних электронных оболочек.
Пример: Сu-Au; Cu-Ni; Ge-Si и другие. Твердые растворы с упорядоченным расположением атомов компонентов (соотношение АВ, АВ2, АВ3) называют упорядоченными или сверхструктурами. Они занимают промежуточное положение между твердыми растворами и химическими соединениями.
В сплавах возможно образование фаз постоянного состава, соотношение компонентов в котором подчиняются правилу валентности, т.е. химических соединений. Их характерными особенностями являются:
· отличие кристаллических решеток новой фазы и исходных компонентов;
· соотношение компонентов кратно целым числам;
· свойства отличаются от свойств исходных компонентов;
· тепловой эффект их образования положителен.
Существуют также химические соединения переменного состава (не соответствуют правилу валентности) или промежуточные фазы. Наиболее распространенные химические соединения: с ионным типом связи (оксиды); с ионным типом связи (карбиды, нитриды, сульфиды, нитриды); элементарные соединения или фазы Юм-Розери; фазы Лавеса и другие. Для определения количества фаз в сплаве и их состава строят диаграммы фазового равновесия (диаграммы состояния), т.е. графическое изображение фазового состава сплава в состоянии равновесия (или близком к нему) в зависимости от содержания компонентов и температуры. Реальные сплавы находятся обычно в неравновесном (метастабильном) состоянии. Их исследование также является задачей материаловедения, т.к. они часто обладают ценными свойствами.
Диаграммы состояния строят, используя правило фаз Гиббса. Он выполняется при следующих допущениях: фазы имеют большие размеры, т.е. можно пренебречь поверхностными явлениями; каждый компонент системы может переходить через поверхность раздела фаз. Вводятся следующие параметры: С - число степеней свободы (вариантность) системы (определяет количество параметров (р, Т, концентрация)которые можно изменять без изменения числа равновесных фаз). При С = 0 безвариантная система (р, Т и концентрация определение); С = 1 – одно(моно) вариантная система. При кристаллизации элемента из расплава в системе 2 фазы (жидкая и твердая), что возможно только при Т = const, процесс поэтому изотермический (С = 0). После кристаллизации (или плавления) - одна фаза в системе С = 1.
Параметр n характеризует внешние факторы (р, Т) и n = 2. При атмосферном давлении р = const и n = 1. Таким образом правило фаз: при постоянном давлении = атмосферному числу фаз Ф, находящиеся в равновесии, не может превышать число компонентов К больше, чем на 1: 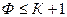 (точно: С = К + 2 - Ф)
(точно: С = К + 2 - Ф)
Для построения диаграмм состояния используют экспериментальные данные, полученные методами дифференциально-термического и рентгеноструктурного анализа, дилатометрии, калориметрии и др.
Дата добавления: 2015-06-17; просмотров: 1541;
