Рекуперативные абсорбционные методы очистки от диоксида серы
Рекуперационные методы очистки с регенерацией хемосорбентов. В этих процессах поглотитель регенерируют и повторно используют для очистки, а извлекаемый компонент перерабатывают в товарные серосодержащие продукты: серную кислоту, элементную серу, сжиженный диоксид серы и сульфаты. Методы классифицируют по типу хемосорбентов. Рассмотрим некоторые из них.
Магнезитовый метод. Диоксид серы в этом случае поглощают оксид-гидрооксидом магния. В процессе хемосорбции образуются кристаллогидраты сульфита магния, которые сушат, а затем термически разлагают на SO2 -содержащий газ и оксид магния. Газ перерабатывают в серную кислоту, а оксид магния возвращают на абсорбцию.
В абсорбере протекают следующие реакции:
MgSO3- + H2O + SO2 = Mg(HSO3)2
Mg(HSO3)2 + Mg(ОН)2 = 2 МgSO3+2Н2O. (I. 1 07)
Растворимость сульфита магния в воде ограничена, избыток его в виде МgSO3∙6Н2O и МgSO3∙3Н2O выпадает в осадок. Технологическая схема процесса представлена на рис. I-26, б.
Дымовые газы поступают в абсорбер Вентури, орошаемый циркулирующей суспензией. Отношение Т:Ж в суспензии 1 : 10, рН суспензии на входе 6,8-7,5, а на выходе из абсорбера 5,5-6. Состав циркулирующей суспензии (в %): МgO — 1,4; МgSO3 — 6,7; МgSO4 — 12,4; вода и примеси — 79,65.
В абсорбере кроме сульфита образуется некоторое количество сульфата:
2 MgSO3 + O2 → 2MgSO4 (I.108)
Образование сульфата нежелательно, так как для его разложения необходима более высокая температура (1200-1300 °С). При таких условиях поддается переобожженный МgO, который имеет малую активность по отношению к SO2. Для устранения образования сульфата необходимо использовать ингибиторы окисления или проводить процесс в абсорберах при малом времени контакта газ — жидкость. Другой путь — производить обжиг сульфата в присутствии восстановителей (кокса, метана, оксида углерода и др.). В этом случае сульфат восстанавливается в сульфид.
Из нейтрализатора часть суспензии выводят на центрифугу для отделения кристаллогидратов солей магния. Обезвоживание солей производят в сушилках барабанного типа с мазутной топкой. Продукт после сушки содержит (в%):МgО-— 2,6; МgSO3 — 65,0; МgSО4— 11,8; Н2O — 20,6, Безводные кристаллы обжигают во вращающихся печах или печах кипящего слоя при 900°С, в печь добавляют кокс. При этом идет реакция:
MgSO3 → MgO + SO2 (I.109)
Концентрация SO2 в газе, выходящем из печи, 7-15%. Газ охлаждают, очищают от пыли и сернокислотного тумана и направляют на переработку в
Выгружаемый из печи продукт содержит 86,1% МgO и 3,4% МgSO4. Его охлаждают до 120°С воздухом, идущим на сгорание мазута в топках, после чего отправляют на абсорбцию.
Достоинства магнезитового метода: 1) возможность очищать горячие газы без предварительного охлаждения; 2) получение в качестве продукта рекуперации серной кислоты; 3) доступность и дешевизна хемосорбента; высокая эффективность очистки.
Недостатки: 1) сложность технологической схемы; 2) неполное разложение сульфата магния при обжиге; 3) значительные потери оксида магния при регенерации.
Цинковый метод. Абсорбентом служит суспензия оксида цинка, при этом идет реакция:
SO2 + ZnО+2,5Н2О = ZnSO3 ∙ 2,5 H2O (1.110)
При большой концентрации O2 в газе может протекать реакция:
2SO2 + ZnO + Н2О = Zn(НSO3)2. (1.111)
Образующийся сульфит цинка нерастворим в воде, его отделяют в гидроциклонах, а затем сушат и обжигают при 350°С. Сульфит цинка разлагается по реакции:
ZnSO3 ∙2,5Н2О → ZnО + SO2 +2,5Н2O (1.112)
Образующийся диоксид серы перерабатывают, а оксид цинка возвращают на абсорбцию.
Достоинством метода является возможность проводить процесс очистки при высокой температуре (200-250 °С). Недостаток — образование сульфата цинка, который экономически не целесообразно подвергать регенерации, а необходимо непрерывно выводить из системы и добавлять в нее эквивалентное количество диоксида цинка.
Абсорбция хемосорбентами на основе натрия. Достоинством этого метода является использование нелетучих хемосорбентов, обладающих большой поглотительной способностью. Метод может применяться для улавливания SO2 из газов любой концентрации.
Возможны различные варианты процесса. При абсорбции раствором соды получается сульфит и бисульфит натрия:
Nа2СО.3 + SO2 = Na2SO3 + CO2 (1.113)
Na2SO3 + SO2 + Н2O = 2NаНSO3. (1.114)
При абсорбции гидроксидом натрия также образуются сульфит-бисульфитные растворы. Газы вступают в реакцию с сульфитом и бисульфитом, что ведет к увеличению содержания бисульфита:
SO2 + NaHSO3 + Na2SO3 + H2O → 3 NaHSO3.
Образующийся раствор взаимодействует с оксидом цинка:
NaHSO3 + ZnO → ZnSO3 + NaOH (1.116)
Сульфит цинка обжигают: ZnSO3 = ZnО + SO2.
Диоксид серы перерабатывают в серную кислоту или серу: а оксид цинка возвращают в процесс.
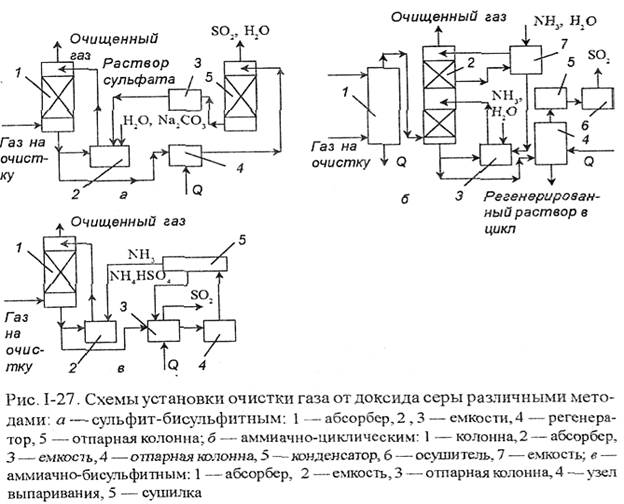
Предложены также содово-кислотный и содово-окислительный процессы. В обоих этих процессах в качестве конечного продукта получают сульфат натрия. Однако основным методом является сульфит-бисульфитный. или метод "Wollman-Lord”, включающий абсорбционное и регенерационное отделение, удаление сульфата и переработку конечных продуктов. Выход серы в процессе переработки превышает 90%. Технологическая схема процесса показана на рис. 1-27,a.
Топочный газ предварительно очищают и охлаждают циркулирующей водой в оросительной башне. При этом из газа удаляется зола, хлориды, частично диоксид серы и др. Абсорбцию проводят в колонне, орошаемой циркулирующим раствором сульфита натрия, который при поглощении SO2 переходит в бисульфит. Одновременно протекает реакция образования сульфата натрия. Ввиду того, что растворимость бисульфита выше, чем сульфита натрия, образования осадка и забивки абсорбера не происходит. Раствор, поступающий из абсорбера, регенерируют в регенераторе-кристаллизаторе с выделением газообразного SO2 и кристаллов сульфита натрия. Пары воды и SO2 через конденсатор направляют на химическую переработку; а суспензию сульфита смешивают с водой, выделенной в конденсаторе, и через напорную емкость подают на орошение абсорбера. Часть раствора после абсорбции направляют на выделение сульфата натрия. Осаждение сульфата натрия проводят при охлаждении раствора, затем его отделяют в центрифугах и сушат. Жидкость возвращают в цикл. Потери иона Na+, связанные с выводом сульфата, компенсируют добавлением каустической соды. Выделившийся при регенерации диоксид серы сжигают или перерабатывают в серную кислоту или серу.
Для получения серы в камерах сжигания проводят процесс взаимодействия SO2 со стехиометрическим количеством газа-восстановителя (Н2, СО, СН4 и т.п.). В ходе реакции образуется смесь, содержащая пары серы, Н2S, SO2. Эта смесь поступает в котел-утилизатор, где тепло реакции используют для выработки пара; далее проводят процесс Клауса — двухступенчатое каталитическое конвертирование при 300°С с промежуточным охлаждением и конденсацией паров серы. Остаточное количество Н2S — каталитически сжигают в печи с образованием SO2. Эти газы смешивают с газами, поступающими на очистку.
Двойной щелочной метод. Сущность его заключается в использовании при абсорбции SO2 растворов солей натрия, калия или аммония с последующей регенерацией отработанных абсорбентов оксидом или карбонатом кальция. В качестве продуктов рекуперации получают гипс, сульфит кальция или их смесь. Регенерированный абсорбент возвращают в цикл абсорбции, а соли кальция удаляют из системы.
Регенерация абсорбента происходит по следующим реакциям:
CaO + H2O ↔ Ca(OH)2
Na2SO3 + Ca(OH)2 ↔ 2NaOH + CaSO3
Na2SO3 + Ca(OH)2 ↔ 2NaOH + CaSO4 (I.118)
Последняя реакция протекает медленно. При увеличении концентрации SO2 и СО2 в газе процесс сдвигается в сторону образования СаSO4. Использование карбоновых кислот увеличивает растворимость солей кальция. Достоинством метода является высокая эффективность процесса и отсутствие твердой фазы компонентов в абсорбере, что облегчает непрерывное функционирование установки. Еще более важно отсутствие солей кальция на стадии поглощения диоксида серы, что полностью исключает забивку аппаратуры. Если регенерацию адсорбента вести оксидом кальция при рН=8, забивки аппаратуры не происходит. Кроме того, капитальные и эксплуатационные затраты на очистку двойным щелочным методом на 15-55% меньше, чем известковым или известняковым методами.
Аммиачные методы. В этих методах поглощение диоксида серы производится аммиачной водой или водными растворами сульфит-бисульфита аммония с последующим его выделением. Достоинством метода является высокая эффективность процесса, доступность сорбента и получение необходимых продуктов (сульфит и бисульфит аммония). Химические реакции процесса:
Имеются циклические и нециклические методы. В аммиачно-нециклическом методе бисульфит аммония выпускают в качестве товарного продукта. В циклическом методе получают концентрированный диоксид серы. Схема аммиачно-циклического метода показана на рис. 1-27,6.
Предварительно очищенный газ охлаждают водой в колонне, а затем подают на двухступенчатую абсорбцию. Вторая ступень необходима для более тонкой очистки. На 1 ступени циркулирующий раствор имеет концентрацию NH3 8-10 моль на 100 моль воды, а на 2 ступени— 1-2 моль/100 моль. При абсорбции получается раствор, в котором отношение концентрации SO2 в сульфите и бисульфите к концентрации аммиака 0,78-0,82.
Абсорбент регенерируют в отпарной колонне паром при 90°, остаточное давление составляет 665-735 кПа.
|
В результате разложения бисульфата аммония и (частично) других солей выделяющийся из раствора диоксид серы осушается и его используют как товарный продукт (после конденсации паров воды и абсорбции аммиака) либо перерабатывают в серу или серную кислоту. Регенерированный в отгонной колонне раствор охлаждают и возвращают в цикл орошения.
Для выделения из раствора сульфата аммония часть регенерированного раствора выпаривают, а затем кристаллизуют и обезвоживают на центрифуге (эта стадия на рисунке не показана). Готовый продукт имеет состав (в %): (NH4)2SO4 — 90-93, (NH4)2SO3 — 2-3: NH4HSO3 — 0.5-1 и Н2O — 4-5. При повышенных температурах идет реакция:
NH4HSO3 + (NH4)2SO3 ↔ (NH4)2SO4 + S + Н2O (1.119)
При этом образуется коллоидная сера, которую трудно удалить из раствора. Недостатки метода: большие затраты на отгонку SO2, большие капитальные и эксплуатационные затраты, возможность очистки газов, содержащих более 0,3-0,35% (об.) 50,.
Есть схемы без предварительного охлаждения газа, по которым для превращения сульфита аммония в сульфат в реактор добавляют серную кислоту:
(NH4)2SO3 + H2SO4 → (NH4)2SO4 + H2SO3 (1.120)
Во Франции разработан аммиачно-бисульфитный процесс (рис. 1-27,в), который позволяет очищать газы любого состава. В данном процессе сульфат аммония разлагают при 300°С, выделяющиеся NH3 и бисульфат аммония возвращаются в процесс:
(NH4)2SO4 → NH3 + NH4HSO4 (1.121)
Недостаток метода — большая энергоемкость. Предложен процесс, по которому в отходящий газ, содержащий SO2, добавляют газообразный аммиак. Непосредственно в трубе образуется аэрозоль сульфита и сульфата, который улавливают в электрофильтрах,
Разработан аммиачно-азотнокислотный метод очистки отходящих газов от диоксида серы сулъфит-бисульфитным раствором с дальнейшим разложением полученных растворов азотной кислотой:
(NH4)2SO3 + 2 HNO3 = 2NH4NO3 +SO2 + H2O (1.122)
NH4HSO3 + HNO3 = NH4NO3 +SO2 + H2O (1.123)
В результате получается газ, содержащий 15-30% SO2, который перерабатывают в серную кислоту, и нитрат аммония, используемый как удобрение. На 1 т утилизируемого диоксида серы можно получить 1 ,3 т серной кислоты, 3 т жидких азотных удобрений и около 0,2 т сульфата аммония с примесью нитрата аммония.
Возможен аммиачно-фосфорнокислотный способ очистки, при котором образуются фосфорные удобрения и диоксид серы:
3(NH4)2SO3 + 2 H3PO4 → 2(NH4)3PO4 + 3SO2 + H2O (I.124)
3 NH4HSO3 + H3PO4 → (NH4)3PO4 + 3SO2 + 3H2O (I.125)
Абсорбция расплавленными солями. Доя очистки газов при высокой температуре используется эвтектическая смесь карбонатов щелочных металлов состава (в %): Li2CO3 – 32; Na2CO3 – 33; K2CO3 – 35. Точка плавления смеси 397°С. При 425°С смесь имеет вязкость 0,012 Па-с и плотность 2000 кг/м3. При содержании SO2 в газе от 0,3 до 3% смесь абсорбирует 99% SO2.
Процесс состоит из стадий абсорбции, восстановления и регенерации абсорбента. Абсорбция SO2 производится карбонатами с образованием сульфитов и сульфатов металлов. Скорости реакций очень велики, поэтшгу процесс лимитируется скоростью переноса диоксида серы. Абсорбцию проводят в оросительном скруббере при скорости газа 7,5 м/с. Реакции, проходящие в скруббере, экзотермичны, что позволяет частично компенсировать потерю тепла,
На стадии восстановления используют генераторный газ. Процесс проводят при 600°С. Происходит восстановление сульфатов до сульфидов металлов:
4Ме2SO3 → 3Ме2SO4 + Ме2S (1.126)
Ме2SO4 + 4Н2 → Ме2S + 4H2О, (1.126 a)
Ме2SО4 + 4СО → Ме2S + 4СО2 (1.127)
Реакции восстановления протекают медленно. На стадии регенерации сульфиды реагируют со смесью СO2 и воды при 425°С:
Ме2S +СО2 + Н2О → Ме2CO3 + H2S (1.128)
Реакция протекает быстро. Полученный расплав солей вновь возвращают в процесс. Газ, выходящий из реактора регенерации, содержит 30% Н2S, оксид углерода и воду. Его направляют на установку, работающую по методу Клауса, для получения серы.
Формиат калия можно применять как абсорбент в виде расплава при 177°С или в виде водного раствора при 93°С.
Последовательность реакций, протекающих в процессе очистки:
абсорбция (в водном растворе)
2HCOOK + 2SO2 → K2S2O3 + 2CO2 + H2O, (1-129)
регенерация
4НСООК+К2S2O3 → 2К2СO3 +2КНS +2СO2+Н2O,
2КНS + СО2 → К2СO3 + 2 H2S
К2СO3 + 2СО + Н2O → 2КСООН + СO2. (1.130)
Сероводород рекуперируется в виде серы.
Абсорбция ароматическими аминами. Для абсорбции SO2 из отходящих газов цветной металлургии [концентрация SO2 в газе 1-2% (об.)] применяют растворы ксилидина или диметиланилина. В одном из разработанных процессов абсорбентом является смесь (1:1) ксилидина и воды. Ксилидин и вода обычно не смешиваются, но при взаимодействии SO2 с ксилидином образуется некоторое количество ксилидинсульфита, растворимого в воде:
2С6Н3(СН3)2 NН2+SO2 ↔ С6Н3(СН3)2 NН2∙SO2 (1.131)
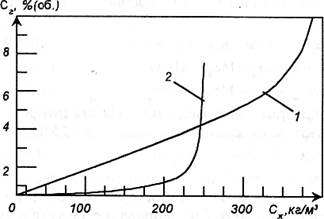
При концентрации SO2 100 кг/м3 смесь становится гомогенной. Кривые равновесия систем диоксид серы — диметиланилин и диоксид серы — ксилидин — вода показаны на рис. 1-28. Схема очистки газа от SO2 смесью ксилидин — вода приведена на рис. 1-29.
После удаления пыли газ с содержанием 0,5-8% SO2 абсорбируется в двух абсорберах. Концентрация SO2 после абсорбции снижается до 0,05-0,1%. Уносимые из абсорберов пары ксилидина рекуперируют разбавленной серной кислотой (5-1 0%) в промывной колонне. После этого газ удаляют в атмосферу. Насыщенный абсорбент с содержанием 130-180 г/л SО2 и добавленным раствором соды насосами подают
|
| Рис.1-28. Кривые равновесия системы SО2 - диметиланилин (1) и НО2- ксилидин — вода (2) при температуре 20-23 ºС |
в отпарную колонну, б которой он нагревается до 100°С глухим паром. Десорбированный диоксид серы с небольшим содержанием ксилидина промывают водой в колонне и направляют на дальнейшею переработку. При низкой концентрации SО2 в газе процесс становится неэкономичным вследствие потерь ксилидина.
Для концентрации SО2 в отходящих газах выше 3,5% (об.) диметиланилин является более эффективным абсорбентом, чем смесь ксилидин — вода (рис. 1-28). Технологическая схема процесса аналогична описанной (рис. 1-29).
Сначала газ очищают от твердых примесей в электрофильтрах. Затем после абсорбции промывают раствором карбоната натрия для удаления следов SО2, а потом разбавленной серной кислотой, которая абсорбирует следы диметиланилина. Удаление SО2 проводят в отпарной колонне. После осушки SО2 перерабатывают в серную кислоту. Абсорберы и отпарная колонна в качестве контактных элементов снабжены колпачковыми тарелками.
На 1 кг выделенного в этом процессе диоксида серы расходуется 0,5 кг диметиланилина, 16 г соды. 18 г серной кислоты, а также 1,1 кг пара, 0,52 МДж: энергии и 8,2 кг/ч охлаждающей воды.
Рис. 1-29. Схема установки очистки газа от диоксцда серы смесью ксилидин — вода: 1,2 — абсорберы,3,4 — емкости. 5 — холодильник,б — промывная колонна отходящих газов, 7 — отпарная колонна, 8 —сепаратор, 9 — колонна для промыв-
ки диоксида серы
|
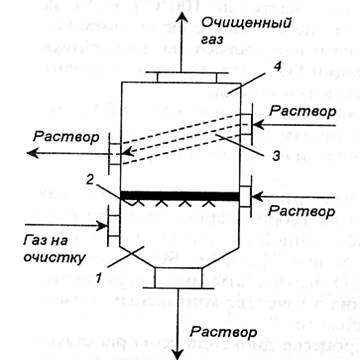
Рис. 1-30. Абсорбер типа СМ: 1 —секция очистки газа; 2 — форсунка; 3 — контактные контактные тарелки; 4 — секция брызгоудаления.
Аппаратура. Для проведения процессов абсорбции диоксида серы используют различные по конструкции абсорберы. Они должны удовлетворять следующим требованиям: иметь высокие эффективность и пропускную способность по газу, низкое гидравлическое сопротивления (до 3 кПа) быть простыми по конструкции и удобными и эксплуатации, отличаться низкой металлоемкостью, не забиваться осадками, образующимися в процессе абсорбции.
На практике больше всего используются пустотелые абсорберы с форсунками и скрубберы Вентури, одноступенчатые и двухступенчатые. Совершенствование их конструкций идет по пути создания аппаратов с минимальной внутренней поверхностью. Высокой эффективностью и простотой в эксплуатации обладает абсорбер типа СМ (рис. 1-30), сочетающий полую секцию с форсунками и секцию с барботажными тарелками.
Исследуются также абсорберы с подвижной шаровой насадкой из полиэтилена или резины. Перспективными являются и абсорберы с крупнодырчатыми тарелками.
Дата добавления: 2015-06-10; просмотров: 4100;
