Аэробная фаза дыхания
Вторая фаза дыхания — аэробная—локализована в митохондриях и требует присутствия кислорода. В аэробную фазу дыхания вступает пировиноградная кислота. Общее уравнение этого процесса следующее:
2ПВК + 5О2 + 6Н2О → 6СО2 + 5Н2О.
Процесс можно разделить на три основные стадии: 1) окислительное декарбоксилирование пировиноградной кислоты; 2) цикл трикарбоновых кислот (цикл Кребса); 3) заключительная стадия окисления — электронтранспортная цепь (ЭТЦ) требует обязательного присутствия О2. Первые две стадии происходят в матриксе митохондрий, электронтранспортная цепь локализована на внутренней мембране митохондрий.
Первая стадия — окислительное декарбоксилирование пировиноградной кислоты.Общая формула данного процесса следующая:
CH3COCOOH + НАД + КоА - SH → CH3CO-S- КоА + НАДН + Н+ + СО2.
Процесс этот состоит из ряда реакций и катализируется сложной мультифер-ментной системой пируватдекарбоксилазой. Пируватдекарбоксилаза включает в себя три фермента и пять коферментов (тиаминпирофосфат, липоевая кислота, коэнзим А — KoA-SH, ФАД и НАД). Вся эта система имеет молекулярную массу 4,0-106. В результате этого процесса образуется активный ацетат — ацетилкоэнзим А (ацетил-КоА), восстановленный НАД (НАДН + Н+), и выделяется углекислый газ (первая молекула). Восстановленный НАД поступает в цепь переноса электронов, а ацетил-КоА вступает в цикл трикарбоновых кислот. Важно отметить, что пируватдегидрогеназная система ингибируется АТФ. При накоплении АТФ выше определенного уровня превращение пировиноградной кислоты подавляется. Это один из способов регуляции интенсивности протекания аэробной фазы.
Вторая стадия — цикл трикарбоновых кислот(цикл Кребса). В 1935 г. венгерский ученый А. Сент-Дьердьи установил, что добавление небольших количеств органических кислот (фумаровой, яблочной или янтарной) усиливает поглощение кислорода измельченными тканями. Продолжая эти исследования, Г. Кребс пришел к выводу, что главным путем окисления углеводов являются циклические реакции, в которых происходит постепенное преобразование ряда органических кислот. Эти преобразования и были названы циклом трикарбоновых кислот или циклом Кребса. Сам исследователь за эти работы в 1953 г. был удостоен Нобелевской премии.
В цикл вступает активный ацетат, или ацетил-КоА. Сущность реакций, входящих в цикл, состоит в том, что ацетил-КоА конденсируется с щавелевоуксусной кислотой (ЩУК). Далее превращение идет через ряд ди- и трикарбоновых органических кислот. В результате ЩУК регенерирует в прежнем виде. В процессе цикла присоединяются три молекулы Н2О, выделяются две молекулы СО2 и четыре пары водорода, которые восстанавливают соответствующие коферменты (ФАД и НАД). Суммарная реакция цикла выражена уравнением:
CH3CO-S-KoA + 3Н2О + 3НАД + ФАД + АДФ + Фн →
2СО2 + SH-KoA + 3НАДН + 3Н+ + ФАДН2 + АТФ
Отдельные реакции протекают следующим образом. Ацетил-КоА, конденсируясь с ЩУК, дает лимонную кислоту, при этом КоА выделяется в прежнем виде. Этот процесс катализируется ферментом цитратсинтазой. Лимонная кислота превращается в изолимонную. На следующем этапе происходит окисление изолимонной кислоты, реакция катализируется ферментом изоцитратде-гидрогеназой. При этом протоны и электроны переносятся на НАД (образуется НАДН + Н+). Для протекания этой реакции требуются ионы магния или марганца. Одновременно происходит процесс декарбоксилирования. За счет одного из атомов углерода, вступившего в цикл Кребса, первая молекула СО2 выделяется. Образовавшаяся сс-кетоглутаровая кислота подвергается окислительному декарбоксилированию подобно тому, которое разбиралось по отношению к пи-ровиноградной кислоте. Этот процесс также катализируется мультиферментным комплексом кетоглутаратдегидрогеназой, содержащим тиаминпирофосфат, липоевую кислоту, коэнзим А, ФАД и НАД. В результате за счет второго атома углерода, вступившего в цикл, выделяется вторая молекула СО2. Одновременно происходит восстановление еще одной молекулы НАД до НАДН и образуется сукцинил-КоА. На следующем этапе сукцинил-КоА расщепляется на янтарную кислоту (сукцинат) и HS—КоА. Выделяющаяся при этом энергия накапливается в макроэргической фосфатной связи АТФ. Такой этап важен, так как выделяющаяся энергия непосредственно накапливается в АТФ. Этот тип образования АТФ, подобно ее образованию в процессе гликолиза, относится к субстратному фосфорилированию. Образовавшаяся янтарная кислота окисляется до фумаро-вой кислоты. Реакция катализируется ферментом сукцинатдегидрогеназой, про-стетической группой которого является ФАД. Одновременно выделяется третья пара водородов, образуя ФАД-Н2.
На следующем этапе фумаровая кислота, присоединяя молекулу воды, превращается в яблочную кислоту с помощью фермента фумаратдегидрогеназы. На последнем этапе цикла яблочная кислота окисляется до ЩУК. Эту реакцию катализирует фермстмалатдегидрогенеза, активной группой которого является НАД, и происходит выделение четвертой пары протонов — образуется НАДН + Н+. Таким образом, ЩУК регенерирует в прежнем виде и может реагировать со следующей молекулой активного ацетата, поэтому практически ЩУК в процессе цикла не расходуется. Одновременно в ходе каждого цикла выделяются две молекулы СО2 и образуются три молекулы НАДН + Н+ и молекула ФАДН2.
Многие реакции цикла Кребса обратимы. Важно также отметить, что образовавшиеся в рассмотренных реакциях органические кислоты могут служить материалом для построения аминокислот, жиров и углеводов. В этом случае они выводятся из цикла. Вместе с тем соединения, входящие в цикл, могут образовываться в ряде других реакций (например, при декарбоксилировании аминокислот) и вступать в цикл. Таким образом, рассмотренные превращения не отделены от других реакций метаболизма, а тесно с ними взаимосвязаны.
Для реакций цикла Кребса кислород не требуется. Кислород необходим для регенерации или окисления восстановленных коферментов (НАДН + Н+ и ФАД-Н2). Количество окисленных форм этих коферментов ограничено. В анаэробных условиях, когда регенерация коферментов невозможна, они быстро оказываются исчерпанными и весь процесс прекращается. Окисление коферментов осуществляется в дыхательной цепи, или цепи переноса водорода и электронов. Конечным акцептором в этой цепи является кислород воздуха. Энергия, высвобождаемая при окислении коферментов, накапливается в макроэргиче-ских фосфатных связях АТФ.
Подводя итог, можно отметить, что в результате распада 1 молекулы ПВК в аэробной фазе (декарбоксилирование ПВК + цикл Кребса) выделяется 3СО2, 4 молекулы НАДН + Н+ и 1 молекула ФАДН2. Таким образом, 5 пар Н2, образующихся из ПВК и воды, поступают в дыхательную цепь.
Третья стадия — электронтранспортная цепь (ЭТЦ). Впроцессе окисления пировиноградной кислоты в цикле Кребса образовались пары водорода 2Н, которые мы можем рассматривать как 2Н+ + 2е. Именно в таком виде они, акцептированные НАД и ФАД, передаются по цепи переносчиков. В процессе переноса протонов и электронов важную роль играют ферменты, относящиеся к классу оксидоредуктаз. Оксидоредуктазы, участвующие в дыхательной цепи, делятся на следующие основные группы.
Пиридиновые дегидрогеназы, у которых коферментом служит НАД или НАДФ, отнимают два протона и два электрона от субстрата. При этом к коферментам присоединяются один протон и два электрона. Протон и один электрон связываются с атомом углерода в молекуле НАД, а второй электрон нейтрализует положительный заряд атома азота. Один протон выделяется в среду.
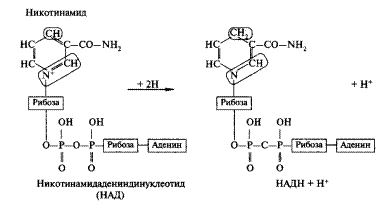
НАД+ и НАДН хорошо растворимы в воде и присутствуют в цитоплазме и митохондриях. Коферменты НАД и НАДФ связаны с ферментом с помощью ионов металла и сульфгидрильных группировок. В зависимости от белкового носителя, к которому присоединен кофермент (НАД или НАДФ), различают более 150 пиридиновых дегидрогеназ. Каждая из них специфична по отношению к определенному субстрату. Необходимо учитывать, что НАД и НАДФ могут воспринимать протоны и электроны лишь в том случае, если субстрат имеет более отрицательное значение потенциала по сравнению с ними.
Флавиновые дегидрогеназы. Это также большая группа ферментов, катализирующая отнятие двух протонов и двух электронов от различных субстратов. Простетической группой этих ферментов служат производные витамина В2 (рибофлавин) — флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). Активной частью флавиновых дегидрогеназ служит изоаллоксазиновое кольцо. В процессе восстановления именно к этой группировке присоединяется 2Н (2Н+ + 2ё). Простетическая группа у флавиновых дегидрогеназ прочно прикреплена к белковому носителю. Специфичность и в этом случае определяется белковой частью фермента.
Цитохромы.Простетическая группа цитохромов представлена железопорфи-ринами. Железопорфириновая группа (гем) в цитохромах прочно связана с белком через атомы серы аминокислоты цистеина. Известно около 20 цитохромов, которые делят на четыре главных класса: а, b, с, d, отличающихся между собой природой простетической группы: цитохромы а содержат железоформилпорфи-рины, цитохромы b — железопротопорфирины, цитохромы d — железогидропорфирины. В каждую группу цитохромов входит по нескольку различающихся между собой ферментов. Роль цитохромов заключается в переносе электронов. Содержащееся в цитохромах железо способно к обратимым окислительно-восстановительным реакциям. Воспринимая электрон, железо восстанавливается, теряя его, окисляется: Fe3+ ± е ↔ Fe2+. В ЭТЦ митохондрий направление транспорта электронов определяется величиной окислительно-восстановительного потенциала цитохромов: цит.b→цит.с1→цит.с→ цит.aa3→О2. Непосредственно с кислородом воздуха может реагировать только цитохромоксидаза (цитохром аa3), которая кроме железа содержит атомы меди.
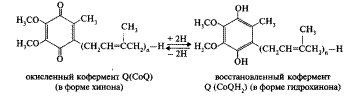
Помимо перечисленных ферментов в переносе электронов по дыхательной цепи принимают участие кофермент Q и железосерные белки. Кофермент Q — это производное бензохинона, получившее название убихинон. Убихинон представляет собой кольцевую молекулу с двумя присоединенными к ней атомами кислорода, для которой возможны три состояния. В полностью окисленном состоянии или хиноновой форме оба атома кислорода связаны с кольцом двойными связями. Присоединение одного атома водорода к одному из атомов кислорода дает полухиноновую форму QH. В полностью восстановленной форме атомы водорода присоединяются к обоим атомам кислорода. Эта форма носит название гидрохиноновой — QH2. Таким образом, кофермент Q может присоединять 2 протона и 2 электрона. Убихинон растворим в жирах и в связи с этим подвижен в липидной фазе мембран. Железосерные белки содержат FeS — это переносчики электронов подобно цитохромам. Содержащееся в них железо обратимо восстанавливается и окисляется.
Путь переноса протонов и электронов от одной молекулы переносчика к другой представляет собой окислительно-восстановительный процесс. При этом молекула, отдающая электрон или (и) протон, окисляется, а молекула, воспринимающая электрон или (и) протон, восстанавливается. Движущей силой транспорта электронов в дыхательной цепи является разность потенциалов. В связи с этим расположение отдельных переносчиков вдыхательной цепи, так же как и в цепи фотосинтетической, определяется величиной их окислительно-восстановительного потенциала (О/В). В начале цепи расположен НАД, обладающий наибольшей отрицательной величиной О/В потенциала (—0,32 В), а в конце—кислород с наиболее положительной величиной (+0,82 В). Остальные переносчики ФАД, КоQ цитохромы расположены между ними в порядке последовательного повышения потенциала. Это и позволяет электронам передвигаться по направлению к кислороду (наивысший положительный потенциал). Таким образом, роль ферментов дыхательной цепи состоит не только в выполнении каталитической функции, но, что особенно важно, в обеспечении упорядоченного транспорта электронов от одного компонента к другому на кислород, что сопровождается запасанием энергии.
В 1939—1940 гг. биохимик В А Белицер указал, что выделяющаяся в процессе передачи по дыхательной цепи электронов энергия частично накапливается в АТФ. При переносе электронов свободная энергия системы постепенно уменьшается. Общее изменение энергии при переносе пары водородов и пары электронов от НАД на кислород можно рассчитывать по формуле: ΔG0 =nFΔE0, где n — число электронов, равное 2; F — фарада=96633,97Дж; ΔE0 — разность потенциалов между участком цепи от -0,32 до +0,82=1,14; ΔG0 —стандартное изменение свободной энергии, 2*96633,97 Дж 1,14 = 220,8 кДж. Таким образом, изменение свободной энергии системы составляет около 220,8 кДж. Свободная энергия гидролиза АТФ равна 30,6 кДж. Исходя из того, что уменьшение свободной энергии системы при переносе пары электронов с НАД на кислород составляет 220,8 кДж, можно было предположить возможность образования из АДФ + Фн семи молекул АТФ. Однако было показано, что при прохождении пары электронов от НАДН до '/2 О2 образуется всего 3 молекулы АТФ. Из этого был сделан вывод, что в цепи переноса электронов имеется три пункта фосфорилирования.
Окислительное фосфорилирование. Накопление энергии окисления в АТФ при продвижении электрона по цепи переносчиков называют окислительным фос-форилированием. Механизм образования АТФ в процессе окислительного фосфорилирования, так же как и фотофосфорилирования, объяснен благодаря работам английского биохимика П. Митчелла. Его теория получила название хемиосмотической. Для понимания этой теории существенным является представление о том, что мембраны являются непроницаемыми для протонов. В то же время мембраны хорошо проницаемы для воды и поэтому благодаря диссоциации в водных растворах нет дефицита протонов.
Согласно хемиосмотической теории свободная энергия, образованная при окислительно-восстановительных реакциях в дыхательной цепи, преобразуется в электрохимический градиент ионов водорода (ΔµН+). При этом мембрана переходит в высокоэнергетическое состояние. Ионы Н+ (протоны) переносятся с внутренней стороны внутренней мембраны на ее внешнюю сторону (из мат-рикса митохондрии в межмембранное пространство) с помощью переносчиков. ΔµН+, в свою очередь, является источником энергии для образования АТФ из АДФ и имеет две составляющие: градиент значения рН и градиент электрического потенциала. Переносчики дыхательной цепи сосредоточены на внутренней мембране митохондрии. При этом они как бы вплетены в митохондриальную мембрану и составляют дыхательные ансамбли. Так же как в мембранах хлоропластов, переносчики, расположенные в митохондриях, неоднородны. Одни из них переносят протоны и электроны, а другие — только электроны. Использование переносчиков второго типа (переносящих электрон) возможно потому, что протоны могут находиться в водной среде клетки в свободном состоянии. В мембране митохондрии, также как и в мембране хлоропластов, переносчики протонов и электронов чередуются с переносчиками электронов, что имеет принципиальное значение для хемиосмотической теории. Молекула переносчика, несущая протоны и электроны, взаимодействует с переносчиком, воспринимающим только электроны, и протоны освобождаются в межмембранное пространство. Именно это, согласно хемиосмотической теории, лежит в основе преобразования энергии, выделяющейся в процессе окисления, в энергию электрохимического мембранного потенциала и далее в энергию АТФ. Согласно теории П. Митчелла, при переносе пары электронов от НАД на кислород они пересекают мембрану 3 раза, и этот перенос сопровождается выделением на внешнюю сторону мембраны 6 (3 пар) протонов.
При рассмотрении рисунков надо учитывать, что это лишь предположительная схема расположения переносчиков. Многое в ней нуждается в уточнении. Как видно из приведенной схемы, восстановленный кофермент НАДН+Н+, образующийся в реакциях цикла Кребса, располагается на внутренней стороне мембраны митохондрий. На первом этапе ФАД воспринимает протоны и электроны от НАД и восстанавливается, образуя ФАД*Н2.
С помощью этого фермента 2Н+ переносятся на другую (внешнюю) сторону мембраны, и здесь происходит первое разделение зарядов. Два протона выделяются на внешнюю сторону внутренней мембраны, а электроны присоединяются к переносчику (железосерный белок), с помощью которого переносятся на внутреннюю сторону мембраны. При этом происходит восстановление железа Fе3+ + e → Fe2+. Этот переносчик переправляет электроны снова на внутреннюю сторону мембраны. Здесь электроны акцептируются KoQ (убихинон — переносчик Н), который, заряжаясь отрицательно, захватывает двумя электронами два протона из внутренней среды. Поскольку KoQ растворим в липи-дах, он диффундирует к внешней стороне мембраны и выделяеттам еще 2Н+ (второе разделение зарядов), а электроны передаются на цитохром b.
Рассматривая схему, мы указали на два места выделения (всего четырех) протонов. Между тем, согласно хемиосмотической теории, локализация пунктов фосфорилирования в дыхательной цепи определяется пунктами выделения ионов Н+. Поскольку, как указывалось выше, показано наличие трех мест фосфорилирования, то необходима транслокация через внутреннюю мембрану трех пар протонов. Однако точно место выделения третьей пары протонов не установлено. Предполагается, что третья пара Н+ выделяется также при переносе электронов от KoQ (убихинона) к цитохрому b. При этом участвуют 2 молекулы убихинона, которые сначала переходят в полухинон, а затем в гидрохинон (выделяется третья пара Н+). Далее электроны передвигаются по цепи цитохро-мов b → с1 →с → aa3, содержащих железо. В каждом из них происходят обратимые окислительно-восстановительные превращения железа. На заключительном этапе электроны переносятся ферментом цитохромоксидазой (содержащей наряду с железом медь) на внутреннюю сторону мембраны на кислород. Кислород, заряжаясь, воспринимает протоны из внутренней среды с образованием Н20: 4Н+ + 4е + О2 → 2Н2О. В результате выброса ионов Н+ на внешнюю сторону мембраны митохондрий и создается электрохимический градиент протонов.
Таким образом, сам механизм процессов, происходящих на мембранах хло-ропластов и митохондрий, сходен. Однако имеются два основных отличия: 1) в случае хлоропластов источником энергии потока электронов служит энергия света, а у митохондрий—энергия окислительных процессов; 2) распределение протонов на мембране противоположно: у митохондрий протоны накапливаются на наружной стороне, а у хлоропластов — на внутренней.
Протонный градиент представляет собой как бы резервуар свободной энергии. Эту энергию можно использовать при обратном потоке протонов через мембрану. При этом происходит разрядка мембраны. В частности, энергия может быть затрачена на синтез АТФ. Процесс синтеза АТФ идет с помощью специального мак-ромолекулярного комплекса, катализирующего синтез и гидролиз молекул АТФ в хлоропластах и митохондриях—АТФ-синтазы. Этот фермент локализован на мембранах в виде грибовидных частиц. Мембранная часть АТФ-синтазы («ножка») — фактор сопряжения F0 — представляет собой гидрофобный белковый комплекс. Фактор сопряжения F1 —выступает из мембраны в виде «шляпки». За расшифровку структуры комплекса F1 и установление механизма образования АТФ исследователи Дж. Уокер и П. Бойер в 1997 г. были удостоены Нобелевской премии по химии.
В хлоропластах фактор сопряжения F1 ориентирован во внешнюю сторону мембран тилакоидов. В митохондриях комплекс Fl обращен в сторону матрикса, т. е. внутренней части митохондрии. Образование АТФ из АДФ и неорганического фосфата Фн происходит в каталитических центрах АТФ-синтазы, расположенных в комплексе F1. В последние годы появились данные о том, что каталитическая активность фермента связана с вращением отдельных субъединиц фактора F1 АТФ-синтаза — это фермент обратимого действия и в зависимости от условий может осуществлять не только синтез АТФ с поглощением, но и ее гидролиз с выделением энергии. Синтез АТФ обеспечивается потоком ионов водорода через АТФ-синтазу, который возникает за счет разности протонных потенциалов (протонный градиент) по обе стороны мембраны.
Существуют две гипотезы, объясняющие механизм синтеза АТФ— прямой и косвенный. Согласно прямому механизму, АДФ и Фн связываются с активным центром фермента, куда по каналу поступают протоны. Протоны взаимодействуют с кислородом Фн с образованием Н2О. Это делает Фн активным, и он присоединяется к АДФ. После этого молекула АТФ отделяется от фермента.. Согласно второй гипотезе, синтез АТФ из АДФ и Фн происходит в активном центре фермента самопроизвольно. Однако образующаяся при этом молекула АТФ прочно связывается с ферментом, поэтому для ее освобождения затрачивается энергия протонного градиента. Предполагают, что структурные перестройки фермента, приводящие к высвобождению АТФ, связаны с циклическими процессами протонирования и депротонирования функционально важных групп фермента. Как уже обсуждалось, этот механизм в последние годы получил экспериментальные подтверждения.
Доказательством того, что именно градиент протона обеспечивает фосфори-лирование, являются опыты с разобщителями окисления и фосфорилирования. Как уже упоминалось, к таким разобщителям относится динитрофенол. Оказалось, что действие динитрофенола связано с тем, что он делает мембрану проницаемой для протонов и тем самым ликвидирует протонный градиент. При этом скорость окисления даже усиливается, однако образование АТФ не происходит. Таким образом, процесс окисления сопряжен с процессом фосфорилирования. Степень сопряженности окисления и фосфорилирования может быть разной в зависимости от условий и от состояния клеток. Показателем сопряженности окисления и фосфорилирования служит коэффициент фосфорилирования Р/О, который соответствует отношению количества связанного неорганического фосфора (АДФ + Фн → АТФ) к поглощенному в процессе дыхания кислороду. Как уже рассматривалось выше, перенос двух электронов к кислороду по дыхательной цепи сопровождается не более чем тремя фосфорилированиями. Следовательно, коэффициент Р/О может быть не более 3. На величину Р/О оказывают влияние внешние условия. При засухе окисление усиливается, а накопление энергии в виде АТФ не происходит, коэффициент Р/О резко падает. Коэффициент фосфорилирования резко падает и при заболевании организмов. В ряде случаев может наблюдаться непосредственное использование энергии протонного градиента (ΔµH+). Действительно, поскольку внутренняя сторона мембраны оказывается заряженной отрицательно, возникает трансмембранный потенциал. Катионы в силу электрического притяжения могут поступать и накапливаться во внутреннем пространстве митохондрий. Имеются данные, что протонный градиент может обеспечить также приток углеводов, в частности поступление сахарозы в ситовидные трубки. Таким образом, ΔµН+ обеспечивает осмотическую работу и транспорт веществ против градиента их концентрации. Наконец, показана возможность использования ΔµН+ на механическую работу (движение бактерий). Вместе с тем важно отметить, что ΔµН+ может играть роль как транспортная форма энергии, передаваясь вдоль мембран (В.П. Скулачев).
Таким образом, клетка обладает двумя формами используемой энергии, двумя энергетическими «валютами» — АТФ и ΔµН+:
1) АТФ — химическая «валюта», растворимая в воде и легко используемая в водной фазе; 2) ΔµН+ — электрохимическая, неразрывно связанная с мембранами. Важно заметить, что эти две формы используемой клеткой энергии могут переходить друг в друга. При образовании АТФ используется энергия ΔµН+, при распаде АТФ энергия может аккумулироваться в ΔµН+.
Дата добавления: 2015-06-05; просмотров: 3257;
