Лекция 1
Рассмотрим изолированную термодинамическую систему, состоящую из двух подсистем, в которых вещество находится в двух фазах, причем количество вещества в подсистемах меняется, а общее количество вещества в системе m остается постоянным
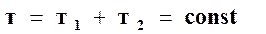 . (16.66)
. (16.66)
Предположим, что давления и температуры системы постоянны, так что температуры и давления фаз одинаковы
 ;
; 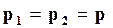 . (16.67)
. (16.67)
При постоянных р и Т изобарно–изотермический потенциал системы в условиях равновесия должен иметь минимум, т. е.
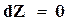 , (16.68)
, (16.68)
а так как потенциал – величина аддитивная 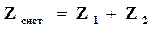 ,
,
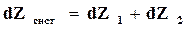 . (16.69)
. (16.69)
На основании формулы (16.53) при постоянном давлении и температуре для 1-й подсистемы
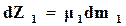 , (16.70)
, (16.70)
а для 2-й
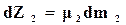 . (16.71)
. (16.71)
Подставив выражение (16.70) и (16.71) в формулу (16.69) и учитывая, что в состоянии равновесия 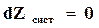 , получим
, получим
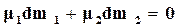 , (16.72)
, (16.72)
Следовательно, в условиях равновесия фаз нужно иметь равные температуры, давления и химические потенциалы фаз. Равенство химических потенциалов фаз означает, что в условиях равновесия удельные энергии в фазах равны.
Для фаз, количество которых больше двух, результаты будут аналогичными, и в условиях равновесия
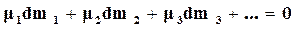 . (16.73)
. (16.73)
Таким образом, в условиях равновесия гетерогенных систем при 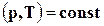
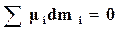 . (16.74)
. (16.74)
При равновесии в химических реакциях, рассматривая, например, изобарно-изотермический потенциал, необходимо учитывать, что введение некоторого количества 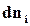 молей компонента iпри сохранении постоянного количества всех других компонентови при постоянных Т и р будет изменять значение изобарного потенциала на величину
молей компонента iпри сохранении постоянного количества всех других компонентови при постоянных Т и р будет изменять значение изобарного потенциала на величину  . Соответственно изменения изобарного потенциала вызваны и изменением содержания других компонентов реагирующей смеси газов. Тогда уравнение (16.53) можно записать в следующем виде:
. Соответственно изменения изобарного потенциала вызваны и изменением содержания других компонентов реагирующей смеси газов. Тогда уравнение (16.53) можно записать в следующем виде:
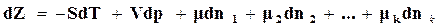 (16.75)
(16.75)
или
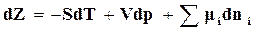 . (16.76)
. (16.76)
Так как в условиях равновесия 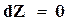 , то для химически реагирующих газов при
, то для химически реагирующих газов при 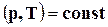
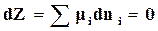 . (16.77)
. (16.77)
Значение химического потенциала компонента, пологая, что он является идеальным газом, можно представить по аналогии с выражением (16.38)
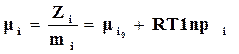 , (16.78)
, (16.78)
где  – парциальное значение изобарно-изотермического потенциала для компонента в смеси;
– парциальное значение изобарно-изотермического потенциала для компонента в смеси; 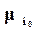 – значение химического потенциала компонента, не меняющегося при постоянной температуре.
– значение химического потенциала компонента, не меняющегося при постоянной температуре.
Лекция 1
Тема: Организация линейной программы.
Цель: Ознакомиться с алфавитом языка Паскаль, операторами присваивания и ввода-вывода.
Дата добавления: 2015-04-05; просмотров: 821;
