Патология клеточного ядра
Морфологически она проявляется в изменении структуры, размеров, формы и количества ядер и ядрышек, в появлении разнообразных ядерных включений и изменений ядерной оболочки. Особую форму ядерной патологии представляет патология митоза; с патологией хромосом ядра связано развитие хромосомных синдромов и хромосомных болезней.
Структура и размеры ядер
Структура и размеры ядра (речь идет об интерфазном, интермитозном, ядре) зависят в первую очередь от плоидности, в частности от содержания в ядре ДНК, и от функционального состояния ядра. Тетраплоидные ядра имеют диаметр больше, чем диплоидные, октоплоидные - больше, чем тетраплоидные.
Большая часть клеток содержит диплоидные ядра. В пролиферирующих клетках в период синтеза ДНК (S-фаза) содержание ДНК в ядре удваивается, в постмитотический период, напротив, снижается. Если после синтеза ДНК в диплоидной клетке не происходит нормального митоза, то появляются тетраплоидные ядра. Возникаетполиплоидия - кратное увеличение числа наборов хромосом в ядрах клеток, или состояние плоидности от тетраплоидии и выше.
Полиплоидные клетки выявляют различными способами: по размеру ядра, по увеличенному количеству ДНК в интерфазном ядре или по увеличению числа хромосом в митотической клетке. Они встречаются в нормально функционирующих тканях человека. Увеличение числа полиплоидных ядер во многих органах отмечается в старости. Особенно ярко полиплоидия представлена при репаративной регенерации (печень), компенсаторной (регенерационной) гипертрофии (миокард), при опухолевом росте.
Другой вид изменений структуры и размеров ядра клетки встречается при анеуплоидии, под которой понимают изменения в виде неполного набора хромосом. Анеуплоидия связана с хромосомными мутациями. Ее проявления (гипертетраплоидные, псевдоплоидные,
«приблизительно» диплоидные или триплоидные ядра) часто обнаруживаются в злокачественных опухолях.
Размеры ядер и ядерных структур независимо от плоидии определяются в значительной мерефункциональным состоянием клетки. В связи с этим следует помнить, что процессы, постоянно совершающиеся в интерфазном ядре, разнонаправленны: во-первых,
это репликация генетического материала в S-периоде («полуконсервативный» синтез ДНК); во-вторых, образование РНК в процессе транскрипции,транспортировка РНК из ядра в цитоплазму через ядерные поры для осуществления специфической функции клетки и для репликации ДНК.
Функциональное состояние ядра находит отражение в характере и распределении его хроматина. В наружных отделах диплоидных ядер нормальных тканей находят конденсированный (компактный) хроматин -гетерохроматин, в остальных ее отделах - неконденсированный (рыхлый) хроматин - эухроматин. Гетеро- и эухроматин отражают различные состояния активности ядра; первый из них считается «малоактивным» или
«неактивным», второй - «достаточно активным». Поскольку ядро может переходить из состояния относительно функционального покоя в состояние высокой функциональной активности и обратно, морфологическая картина распределения хроматина, представленная гетеро- и эухроматином, не может считаться статичной. Возможна «гетерохроматинизация» или «эухроматинизация» ядер (рис. 2), механизмы которой изучены недостаточно.
Неоднозначна и трактовка характера и распределения хроматина в ядре.
Например, маргинация хроматина, т.е. расположение его под ядерной оболочкой, трактуется и как признак активности ядра, и как проявление его повреждения. Однако конденсация эухроматиновых структур(гиперхроматоз стенки ядра), отражающая инактивацию активных участков транскрипции, рассматривается как патологическое явление, как предвестник гибели клетки. К патологическим изменениям ядра относят также егодисфункциональное (токсическое) набухание, встречающееся при различных повреждениях клетки. При этом происходит изменение коллоидно-осмотического состояния ядра и цитоплазмы вследствие торможения транспорта веществ через оболочку клетки.
2. 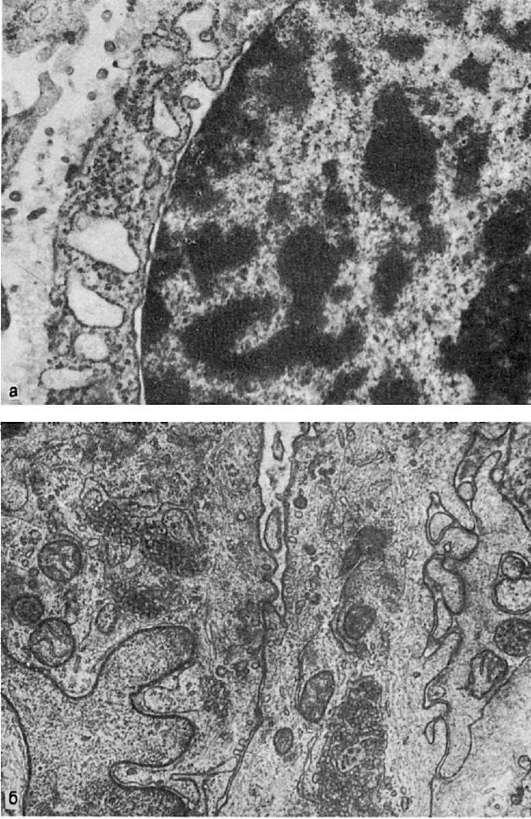 Гетеро- и эухроматизация ядер:
Гетеро- и эухроматизация ядер:
Рис.
а - гетерохроматин ядра опухолей клетки. х25 000; б - эухроматизация хроматина ядра эндотелиоцита. Многочисленные инвагинаты ядерной оболочки; в цитоплазме - тубулярные включения и скопления промежуточных филаментов. х30 000
Форма ядер и их количество
Изменения формы ядра- существенный диагностический признак: деформация ядер цитоплазматическими включениями при дистрофических процессах, полиморфизм ядер при воспалении (гранулематоз) и опухолевом росте (клеточный атипизм).
Форма ядра может меняться также в связи с образованием множественных выпячиваний ядра в цитоплазму (рис. 3), которое обусловлено увеличением ядерной поверхности и свидетельствует о синтетической активности ядра в отношении нуклеиновых кислот и белка.
Изменения количества ядерв клетке могут быть представлены многоядерностью, появлением «спутника ядра» и безъядерностью. Многоядерность возможна при слияний клеток. Таковы, например, гигантские многоядерные клетки инородных тел и Пирогова- Лангханса, образующиеся при слиянии эпителиоидных клеток (см. рис. 72). Но возможно образование многоядерных клеток и при нарушениях митоза - деление ядра без последующего деления цитоплазмы, что наблюдается после облучения или введения цитостатиков, а также при злокачественном росте.
«Спутниками ядра», кариомерами (маленькими ядрами) называют мелкие подобные ядру образования с соответствующей структурой и собственной оболочкой, которые расположены в цитоплазме около неизмененного ядра. Причиной их образования считают хромосомные мутации. Таковы кариомеры в клетках злокачественной опухоли при наличии большого числа фигур патологических митозов.
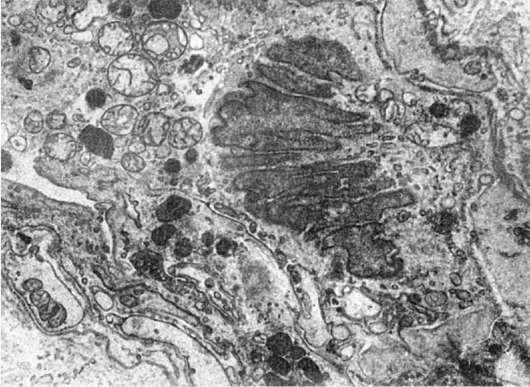
Рис.
3.Атипизм ядер клетки опухоли. Множественные выпячивания ядерной оболочки. х15 500
Безъядерность в отношении функциональной оценки клетки неоднозначна. Известны безъядерные клеточные структуры, которые являются вполне жизнеспособными (эритроциты, тромбоциты). При патологических состояниях можно наблюдать жизнеспособность частей цитоплазмы, отделенных от клетки. Но безъядерность может свидетельствовать и о гибели ядра, которая проявляется кариопикнозом, кариорексисом (рис. 4)
икариолизисом (см. Некроз).
4.  Распад пикнотического ядра (кариорексис)
Распад пикнотического ядра (кариорексис)
Структура и размеры ядрышек
Рис.
Изменения ядрышек имеют существенное значение в морфофункциональной оценке состояния клетки, так как с ядрышками связаны процессы транскрипции и трансформации рибосомальной РНК (р-РНК). Размеры и структура ядрышек в большинстве случаев коррелируют с объемом клеточного белкового синтеза, выявляемого биохимическими методами. Размеры ядрышек зависят также от функции и типа клеток.
Увеличение размеров и количества ядрышек (рис. 5) свидетельствует о повышении их функциональной активности. Вновь образованная в ядрышке рибосомальная РНК транспортируется в цитоплазму и, вероятно, через поры внутренней ядерной мембраны. Интенсивный синтез белка в таких случаях подтверждается увеличением количества рибосом эндоплазматической сети.
Гипергранулированные ядрышки с преобладанием гранул над фибриллярной субстанцией могут отражать различное функциональное состояние как ядрышек, так и клетки. Наличие таких ядрышек с хорошо выраженной лакунарной системой и резкой базофилией цитоплазмы
5.Увеличение количества и размеров ядрышек. х12 500
 Рис.
Рис.
свидетельствует как о повышенном синтезе р-РНК, так и о трансмиссии. Такие
«гиперфункциональные ядрышки» встречаются в молодых плазматических клетках, активных фибробластах, гепатоцитах, во многих опухолевых клетках. Те же гипергранулированные ядрышки со слабовыраженной базофилией цитоплазмы могут отражать нарушение трансмиссии (транспортировки гранул) при продолжающемся синтезе р-РНК. Они обнаруживаются в опухолевых клетках, отличающихся большим ядром и незначительной цитоплазматической базофилией.
Разрыхление (диссоциация) ядрышек, отражающее их гипогрануляцию, может быть следствием «извержения» р-РНК в цитоплазму или торможения ядрышковои транскрипции. Дезорганизация (сегрегация) ядрышекотражает, как правило, полное и быстрое прекращение ядрышковой транскрипции: ядро уменьшается в размерах, наблюдается выраженная конденсация ядрышкового хроматина, происходит разделение гранул и протеиновых нитей. Эти изменения встречаются при энергетическом дефиците клетки.
Ядерные включения
Ядерные включения делят на три группы: ядерные цитоплазматические, истинные ядерные и ядерные вирусобусловленные.
Ядерными цитоплазматическими включениями называют отграниченные оболочкой части цитоплазмы в ядре. Они могут содержать все составные части клетки (органеллы, пигмент, гликоген, капли жира и т.д.). Их появление в большинстве случаев связано с нарушением митотического деления.
Истинными ядерными включениями считают те, которые расположены внутри ядра (кариоплазмы) и соответствуют веществам, встречающимся
в цитоплазме - белок, гликоген (рис. 6, а), липиды и т.д. В большинстве случаев эти вещества проникают из цитоплазмы в ядро через неповрежденные или поврежденные поры ядерной оболочки или через разрушенную ядерную оболочку. Возможно также проникновение этих веществ в ядро при митозе. Таковы, например, включения гликогена в ядрах печени при сахарном диабете («ядерный гликоген», «дырчатые, пустые, ядра»).
6.Ядерные включения:
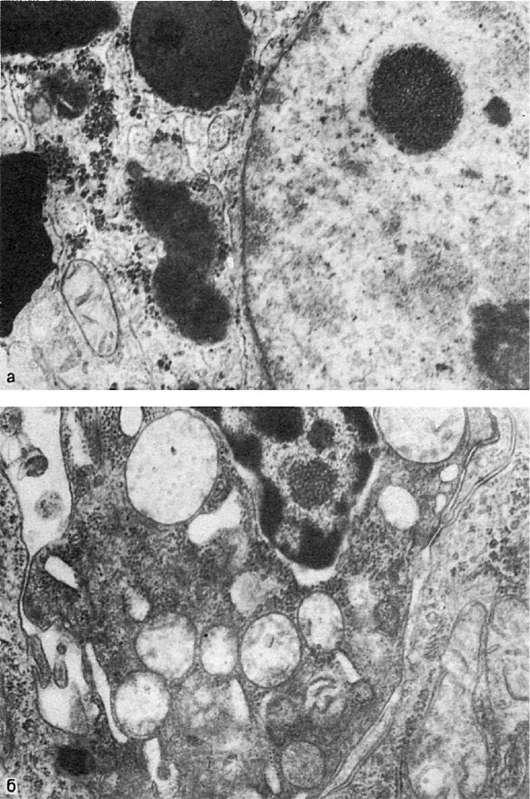 Рис.
Рис.
а - включения гликогена в ядре гепатоцита. х22 500; б - включения вируса в ядре опухолевой клетки
Вирусобусловленные ядерные включения (так называемые тельца ядерных включений) неоднозначны. Во-первых, это ядерные включения в кариоплазме кристаллической решетки
вируса (рис. 6, б), во-вторых, включения белковых частиц, возникающих при внутриядерном размножении вируса; в-третьих, ядерные включения как проявление реакции на поражение вирусом цитоплазмы («реактивные включения»).
Ядерная оболочка
Ядерная оболочка выполняет ряд функций, нарушения которых могут служить основой для развития патологии клетки.
О роли ядерной оболочки в поддержании формы и размера ядра свидетельствует образование внутриядерных трубчатых систем, отходящих от внутренней ядерной мембраны, включений в перинуклеарной зоне - гипертрофия миокарда, легочный фиброз, системный васкулит, саркоидоз, опухоли печени, дерматомиозит (рис. 7).
О ядерной оболочке как месте прикрепления ДНК для облегчения репликации и транскрипциисвидетельствует тот факт, что в ядерной оболочке имеются структуры, модулированные хроматином и в свою очередь ответственные за ориентацию и структуру хроматина. Показано, что функциональная активность ДНК связана с ее распределением при делении клетки и со степенью конденсации в интерфазе, причем повреждение оболочки может вызывать изменения таких участков распределения и быть причиной патологических изменений клетки.
Рис.
7.Микротубулярные включения в перинуклеарной зоне эндотелиоцита при дерматомиозите. х15 500
В пользу функции ядерной оболочки как физического барьера и модулятора нуклеоцитоплазматического обмена говорит установленная корреляция между
изменениями структуры ядерной оболочки, модулем ее пор и выходом РНК в цитоплазму. Контроль ядерной оболочкой транспорта РНК в цитоплазму может оказывать существенное влияние на гомеостаз клетки при патологических состояниях. Участие ядерной оболочки всинтезе мембран не имеет достоверных доказательств, хотя и считают, что эта роль возможна, так как мембраны ядерной оболочки непосредственно переходят в эндоплазматическую сеть цитоплазмы. О возможном влиянии ферментов ядерной оболочки на функцию ядра свидетельствует наличие в ядерной оболочке различных ферментов детоксикации, а также веществ, обеспечивающих «гормональное управление» (аденилатциклаза, рецепторы инсулина и др.).
Патология митоза
В жизненном цикле клетки митоз занимает особое место. С его помощью осуществляется репродукция клеток, а значит, и передача их наследственных свойств. Подготовка клеток к митозу складывается из ряда последовательных процессов: репродукции ДНК, удвоения массы клетки, синтеза белковых компонентов хромосом и митотического аппарата, удвоения клеточного центра, накопления энергии для цитотомии. В процессе митотического деления, как известно, различают 4 основные фазы: профазу, метафазу, анафазу и телофазу.
При патологии митоза может страдать любая из этих фаз. Руководствуясь этим, создана классификация патологии митоза (Алов И.А., 1972), согласно которой выделяются следующие типы патологии митоза.
I. Повреждение хромосом: 1) задержка клеток в профазе; 2) нарушение спирализации и деспирализации хромосом; 3) фрагментация хромосом; 4) образование мостов между хромосомами в анафазе; 5) раннее разъединение сестринских хроматид; 6) повреждение кинетохора.
II. Повреждение митотического аппарата: 1) задержка развития митоза в метафазе; 2) рассредоточение хромосом в метафазе; 3) трехгрупповая метафаза; 4) полая метафаза; 5) многополюсные митозы; 6) асимметричные митозы; 7) моноцентрические митозы; 8) К- митозы.
III. Нарушение цитотомии: 1) преждевременная цитотомия; 2) задержка цитотомии; 3) отсутствие цитотомии.
Патологию митоза могут вызвать различные воздействия на клетку: ультрафиолетовое и ионизирующее излучение, высокая температура, химические вещества, в том числе канцерогены и митотические яды и др. Велико количество патологических митозов при малигнизации тканей (рис. 8).
8. 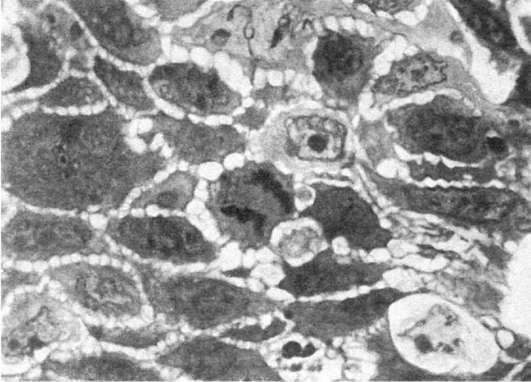 Патология митоза. Полутонкий срез ткани опухоли. х1000
Патология митоза. Полутонкий срез ткани опухоли. х1000
Хромосомные аберрации и хромосомные болезни
Рис.
Хромосомные аберрации.Под хромосомными аберрациями понимают изменения структуры хромосом, вызванные их разрывами, с последующим перераспределением, утратой или удвоением генетического материала. Они отражают различные виды аномалий хромосом. У человека среди наиболее часто встречающихся хромосомных аберраций, проявляющихся развитием глубокой патологии, выделяют аномалии, касающиеся числа и структуры хромосом. Нарушения числа хромосом могут быть выражены отсутствием одной из пары гомологичных хромосом (моносомия) или появлением добавочной, третьей,
хромосомы (трисомия).Общее количество хромосом в кариотипе в этих случаях отличается от модального числа и равняется 45 или 47. Полиплоидия и анеуплоидия имеют меньшее значение для развития хромосомных синдромов. К нарушениям структуры хромосом при общем нормальном их числе в кариотипе относят различные типы их «поломки»: транслокацию (обмен сегментами между двумя негомологичными хромосомами), делецию (выпадение части хромосомы), фрагментацию, кольцевые хромосомы и т.д.
Хромосомные аберрации, нарушая баланс наследственных факторов, являются причиной многообразных отклонений в строении и жизнедеятельности организма, проявляющихся в так называемых хромосомных болезнях.
Хромосомные болезни.Их делят на связанные с аномалиями соматических хромосом (аутосом) и с аномалиями половых хромосом (телец Барра). При этом учитывают характер хромосомной аномалии - нарушение числа отдельных хромосом, числа хромосомного набора или структуры
хромосом. Эти критерии позволяют выделять полные или мозаичные клинические формы хромосомных болезней.
Хромосомные болезни, обусловленные нарушениями числа отдельных
хромосом (трисомиями и моносомиями), могут касаться как аутосом, так и половых хромосом.
Моносомии аутосом (любые хромосомы, кроме Х- и Y-хромосом) несовместимы с жизнью. Трисомии аутосом достаточно распространены в патологии человека. Наиболее часто они представлены синдромами Патау (13-я пара хромосом) и Эдвардса (18-я пара), а также болезнью Дауна (21-я пара). Хромосомные синдромы при трисомиях других пар аутосом встречаются значительно реже. Моносомия половой Х-хромосомы (генотип ХО) лежит в основе синдрома Шерешевского-Тернера, трисомия половых хромосом (генотип XXY) - в основе синдрома Клейнфелтера. Нарушения числа хромосом в виде тетраили триплоидии могут быть представлены как полными, так и мозаичными формами хромосомных болезней.
Нарушения структуры хромосом дают самую большую группу хромосомных синдромов (более 700 типов), которые, однако, могут быть связаны не только с хромосомными аномалиями, но и с другими этиологическими факторами.
Для всех форм хромосомных болезней характерна множественность проявлений в виде врожденных пороков развития, причем их формирование начинается на стадии гистогенеза и продолжается в органогенезе, что объясняет сходство клинических проявлений при различных формах хромосомных болезней.
Дата добавления: 2015-05-16; просмотров: 4858;
