БИОФИЗИКА КЛЕТОЧНОГО ДЫХАНИЯ
Клеточное дыхание происходит в митохондриях. Во внутренней мембране этого органоида сосредоточены электронтранспортная (дыхательная) цепь, обеспечивающая межмолекулярный перенос электронов с субстратов клеточного дыхания на молекулярный кислород (процесс биологического окисления), и система сопряжения окисления с фосфорилированием (синтез АТФ из АДФ).
Молекула АТФ впервые была выделена Фиске и Субарроу из экстрактов скелетных мышц в 1929 г. Через 2 года отечественный биохимик В.А. Энгельгардт обнаружил связь между синтезом АТФ и клеточным дыханием. Еще через 10 лет Липман сформулировал положение о том, что АТФ является универсальной «энергетической валютой» в организме человека и животных, поскольку выполняет миссию посредника между внешним источником энергии (Солнцем) и полезной работой биологических систем.
Биологическое окисление.Все субстраты клеточного дыхания, являющиеся продуктами расщепления углеводов, белков и жиров, поставляют в митохондрии протоны (Н+) и π-электроны, которые на пути к кислороду должны передаваться по эстафете от одного вещества другому в митохондриальной дыхательной цепи. В таком путешествии электроны отдают свою энергию на синтез АТФ не одномоментно и не в одном пункте, а порциями на ступенях каскада молекул, стоящих в мембране в строгом порядке, предопределенном их восстановительными потенциалами, т. е. сродством к электронам (чем больше величина положительного восстановительного потенциала, тем выше степень сродства к электронам).
Каскад переноса π-электронов по дыхательной цепи митохондрий иллюстрирует схема (рис. 32). Каждый ее компонент (кофермент или кофактор макромолекулы), а их более 15 (на схеме показаны не все), обладает свойствами окислительно-восстановительной пары. В окисленном состоянии такая молекула является акцептором электронов, причем они поступают на нее не в одиночку, а попарно. Приняв пару электронов, молекула восстанавливается и приобретает свойства электронного донора. Так, окисленный никотинамидадениндинуклеотид (НАД+), приняв пару электронов, восстанавливается до НАДН и теперь служит основным донором электронов для дыхательной цепи. В реакциях, в которых образуется НАДН, от молекулы субстрата одновременно отнимаются 2 атома Н, которые дают 1 гидрид-ион (атом водорода с добавочным электроном − Н:-) и 1 протон. Кроме НАДН, поставщиками электронов в дыхательную цепь могут быть сукцинат, глицерофосфат и другие вещества, но тогда синтезируется меньше молекул АТФ.
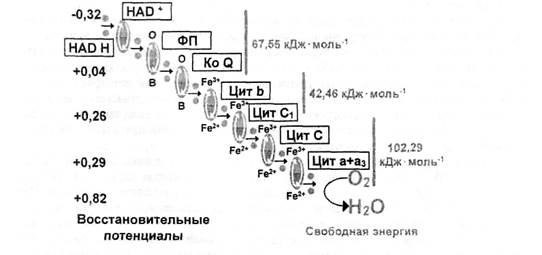
Рис. 32. Схема межмолекулярного переноса π-электронов по дыхательной цепи митохондрий: слева − восстановительные потенциалы редокс-пар компонентов дыхательной цепи, справа − перепады свободной энергии на каждом из трех этапов выброса протонов в цитозоль.
При переносе одной пары электронов с НАДН на кислород образуются 3 молекулы АТФ, причем электронный транспорт по дыхательной цепи начинается с того, что у НАДН отбирается гидрид-ион (Н:-). При этом регенерируется НАД+, а гидрид-ион превращается в Н+ и 2е-.
НАДН − довольно устойчивое соединение. Для отрыва от него электронов необходима большая сила. Такой силой служит разность восстановительных потенциалов между редокс-парами: никотинамидадениндинуклеотида (НАД+/НАДН) и первого компонента дыхательной цепи − флавопротеида (его коферментом служит флавинмононуклеотид − ФМН). У этого вещества стандартный восстановительный потенциал редокс-пары составляет 0,30 В, тогда как у НАД+/НАДН он равен − 0,32 В. Разница составляет всего 0,02 В, но расстояние между соседними молекулами, образующими дыхательную цепь во внутренней мембране митохондрии, − не более 2,5 нм. Поэтому напряженность электрического поля между НАДН и окисленным ФМН очень большая (порядка 107 В·м-1), причем ФМН имеет более положительный потенциал, чем предыдущая редокс-пара, и «стягивает» на себя π-электроны с НАДН.
Отдав электроны, НАДН окисляется до НАД+, и теперь эта редокс-пара готова принять новую пару электронов, а окисленный ФМН, отобравший электроны от НАДН, восстанавливается. Следующий компонент электрон-транспортной цепи (см. рис. 33) − коэнзим Q, молекула которого имеет «хвост» из 10 изопреновых единиц, который удерживает ее во внутренней мембране митохондрий. Эта молекула обладает свойствами редокс-пары, стандартный восстановительный потенциал которой составляет +0,07 В. Он отбирает пару электронов от ФМН и восстанавливается, а его предшественник при этом окисляется и становится акцептором π-электронов.
За коэнзимом Q в митохондриальной мембране стоят несколько цитохромов (в, с1, с, а + а3). Цитохромы в, с1, с содержат в качестве кофактора ион железа, способный совершать превращения из окисленной (Fe3+) в восстановленную (Fe2+) форму и обратно. Комплекс цитохромов (а + а3) называется цитохромоксидазой и содержит не только железо, но и медь. Чем дальше стоит цитохром от коэнзима Q, тем все более положителен восстановительный потенциал его редокс-пары: от цитохрома в (+0,12 В) до цитохромоксидазы (+0,55 В). С цитохромоксидазы пара π-электронов поступает на кислород и восстанавливает его до воды. Стандартный восстановительный потенциал редокс-пары: О2/Н2О равен +0,82 В, т. е. О2 обладает наибольшим сродством к электронам.
Таким образом, при переносе пары π-электронов с НАД на О2 разность восстановительных потенциалов составляет 1,14 В (от -0,32 В до + 0,82 В). Между перепадами стандартного восстановительного потенциала ( 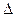 U) и изменениями свободной энергии системы (
U) и изменениями свободной энергии системы ( 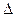 G) существует прямо пропорциональная зависимость:
G) существует прямо пропорциональная зависимость:
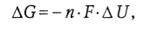 (33)
(33)
где п − количество переносимых электронов (n= 2), F − число Фарадея (F = 96484 Кл·моль -1).
Согласно расчету, изменение свободной энергии π-электронов при их межмолекулярном переносе от НАД до О2 составляет − 220 кДж · моль-1. Знак минус означает, что переносимые π-электроны теряют в дыхательной цепи свою энергию. Но она тратится не понапрасну. «Львиная доля» (от 43 до 60%) идет на синтез АТФ, в тепло преобразуется сравнительно небольшая ее часть (около 15%), а за счет остальной энергии работают системы активного транспорта в митохондриальной мембране.
Сопоставляя шкалы восстановительных потенциалов компонентов систем фотосинтеза и дыхательной цепи, нетрудно убедиться в том, что солнечная энергия, конвертированная π-электронами при фотосинтезе, затрачивается преимущественно на клеточное дыхание (на синтез АТФ). За счет поглощения двух фотонов обеими фотосистемами (ФС II и ФС I) π-электроны переносятся от Р680 до ферредоксина, увеличивая свою свободную энергию примерно на 241 кДж · моль-1. Ее небольшая часть расходуется при переносе π-электронов в зеленых растениях с ферредоксина на НАДФ+. В результате синтезируются вещества, которые затем становятся пищей для гетеротрофов и превращаются в субстраты клеточного дыхания. В начале дыхательной цепи запас свободной энергии π-электронов составляет 220 кДж · моль-1. Значит, до этого энергия π-электронов, аккумулировавших солнечную энергию, понизилась всего на 21 кДж · моль-1. Следовательно, более 90% солнечной энергии, запасенной в зеленых растениях, доносится возбужденными π-электронами до дыхательной цепи митохондрий животных и человека.
Конечным продуктом окислительно-восстановительных реакций в дыхательной цепи митохондрий является вода. В ходе биологического окисления у человека в покое за сутки образуется около 300 мл так называемой эндогенной воды окисления. При усилении метаболизма образование эндогенной воды окисления усиливается. Ее объем определяется массой окисленных субстратов клеточного дыхания: при окислении 100 г жира образуется примерно 100 мл воды, тогда как окисление 100 г белка и 100 г углеводов дает соответственно 40 и 50 мл воды.
Благодаря поглощению фотонов электроны достигают наивысшего биопотенциала в фотосистемах растений. С этого высокого энергетического уровня они дискретно (по ступенькам) спускаются на самый низкий в биосфере энергетический уровень − уровень воды. Энергия, отдаваемая электронами на каждой ступеньке этой лестницы, превращается в энергию химических связей и таким образом движет жизнью животных и растений.
Электроны воды «оживляются» в процессе фотосинтеза, пополняя электронный фонд хлорофилла Р680 по мере потери им своих π-электронов под действием Солнца, а клеточное дыхание снова порождает воду, электроны которой не способны придать ей химическую активность в организме животных и человека.
Для окислительного фосфорилирования важна мембранная организация системы клеточного дыхания, обеспечивающая строгую упорядоченность взаимного расположения молекул, образующих каскад электрон-транспортной цепи и весь молекулярный ансамбль сопряжения процессов окисления и фосфорилирования. Реконструкция дыхательной цепи была безуспешной до тех пор, пока Э. Рэкер не догадался расположить ее компоненты (переносчики π-электронов) в митохондриальной мембране асимметрично. Одни переносчики сосредоточены на наружной стороне внутренней митохондриальной мембраны, другие − на внутренней, третьи (цитохромоксидаза) − пронизывают ее насквозь, а протонная помпа (F) не только «прошивает» всю мембрану, но и выступает в матрикс. Векторные структурно-топографические особенности молекулярной организации внутренней мембраны митохондрий являются необходимым условием для превращения энергии возбужденных π-электронов в свободную энергию концевой фосфатной связи АТФ.
Сопряжение окисления и фосфорилирования. Кроме π-электронов, транспортируемых от молекулы к молекуле по дыхательной цепи вдоль внутренней мембраны митохондрий, через нее (поперек) переносятся некоторые частицы: элементарные (протоны) и гораздо более крупные (например, молекулы АТФ). Транспорт протонов обеспечивает сопряжение окисления и фосфорилирования. Важнейшая роль в этом процессе принадлежит Н-АТФазе (протонной помпе), встроенной во внутреннюю митохондриальную мембрану.
За счет свободной энергии, выделяемой при транспорте по дыхательной цепи (ДЦ) пары электронов, образуются 3 молекулы АТФ. В так называемых стандартных условиях, когда концентрации АТФ, АДФ и ортофосфорной кислоты равны 1 моль · л-1, величину изменения свободной энергии ( 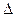 G) при гидролизе АТФ называют изменением стандартной свободной энергии для данной реакции (
G) при гидролизе АТФ называют изменением стандартной свободной энергии для данной реакции ( 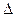 G0) − оно равно 31,4 кДж·моль-1. В других условиях
G0) − оно равно 31,4 кДж·моль-1. В других условиях 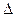 G отличается от
G отличается от 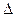 G0. Так, при концентрациях АТФ, АДФ и Н3РО4, свойственных клеткам в физиологических условиях, энергия гидролиза АТФ (равно как и энергия синтеза АТФ из АДФ и Н3РО4) может достигать 45 кДж·моль-1.
G0. Так, при концентрациях АТФ, АДФ и Н3РО4, свойственных клеткам в физиологических условиях, энергия гидролиза АТФ (равно как и энергия синтеза АТФ из АДФ и Н3РО4) может достигать 45 кДж·моль-1.
Число молекул АТФ, синтезированных при окислении того или иного вещества, определяется количеством пар электронов, поставляемых им в дыхательную цепь. В целом восстановление О2 до Н2О может быть представлено в виде реакций:
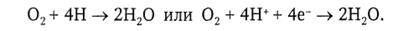
Значит, в дыхательной цепи с предшествующих этапов расщепления органических веществ в клетке должны поступать атомы водорода, являющиеся непосредственными источниками электронов, переносимых по ней. По утверждению А. Сент-Дьердьи, «водород − это топливо жизни, и ни один электрон в живых системах не способен двигаться, если его не сопровождает водород». В конечном счете все субстраты клеточного дыхания поставляют в дыхательную цепь протоны и электроны. Они образуются главным образом при расщеплении воды, катализируемом специальными ферментными системами. Среди них важнейшая роль в качестве предварительной стадии окислительного фосфорилирования принадлежит так называемому циклу Кребса. От него начинаются пути многих биосинтетических процессов (синтез углеводов, липидов, белков и других сложных органических соединений).
Вместе с тем он служит основным поставщиком электронов и протонов на НАД+. В реакциях цикла Кребса образуются СО2, Н+ и электроны, восстанавливающие НАД+ до НАДН. Основное назначение цикла Кребса в клеточном дыхании состоит в повышении выхода свободной энергии из органических соединений путем катализа расщепления воды для образования большего количества протонов и электронов, поставляемых далее в дыхательную цепь.
Для получения общего представления о значимости окислительного фосфорилирования в энергетическом обеспечении организма полезно количественно оценить синтез АТФ при расщеплении глюкозы. В ней заключена свободная энергия в 2879 кДж·моль-1 (примерно 685 ккал·моль-1). Первой стадией расщепления глюкозы служит гликолиз, в ходе которого каждая молекула распадается на 2 молекулы пировиноградной кислоты. При этом потребляются 2 и синтезируются 4 молекулы АТФ. Суммарно в результате превращения 1 моля глюкозы в пируват организм получает 2 моля АТФ. Процесс идет в анаэробных условиях. В отсутствие кислорода пировиноградная кислота затем восстанавливается до молочной, которая выводится из организма. Огромная энергия, заключенная в этом веществе, не используется организмом. Эффективность использования энергии при анаэробном гликолизе ничтожна − около 2%.
В аэробных условиях 2 молекулы пировиноградной кислоты, образовавшиеся при распаде молекулы глюкозы, не восстанавливаются, а окисляются далее до СО2 с участием цикла Кребса и дыхательной цепи. В цикле Кребса синтезируются еще 2 молекулы АТФ. Далее в дыхательную цепь поставляются 12 пар электронов, но две из них поступают не на НАД+, а через флавопротеиды на кофермент Q, обеспечивая синтез двух, а не трех молекул АТФ в расчете на пару электронов (см. рис. 32). Следовательно, за счет транспорта по дыхательной цепи этих двух пар электронов, миновавших НАД+, синтезируются 4 молекулы АТФ. Остальные 10 пар электронов переносятся по дыхательной цепи от НАДН до О2, и за счет них синтезируются 30 молекул АТФ.
В целом при окислении 1 моля глюкозы происходит образование 38 молей АТФ. Эффективность использования свободной энергии при аэробном окислении глюкозы составляет при таком расчете около 42%:
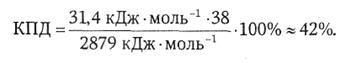 (34)
(34)
Это нижняя граница возможных значений. Если же принять во внимание физиологические концентрации различных ингредиентов окисления и фосфорилирования, то энергия гидролиза АТФ в клетке, как уже говорилось, достигает от 31,4, до 45 кДж·моль-1, и эффективность использования свободной энергии при синтезе АТФ в ходе аэробного окисления глюкозы оценивается в 60%. Вместе с тем не вся остальная энергия (40%) рассеивается в виде тепла. Много энергии затрачивает митохондрия на активный транспорт веществ через ее мембраны, т. е. преобразуется также в один из видов полезной работы организма. В сумме синтез АТФ и трансмембранный перенос веществ используют более 75% свободной энергии, освобождающийся при биологическом окислении глюкозы.
При окислении жиров образуется больше АТФ, чем при окислении углеводов. Например, окисление 1 моля пальмитиновой кислоты дает 129 молей АТФ, но на это уходит гораздо больше кислорода, чем на окисление глюкозы. Чтобы синтезировать 1 моль АТФ в миокарде посредством окисления жирной кислоты, нужно затратить на 17% кислорода больше, чем в аналогичном процессе с участием глюкозы. Поэтому КПД окислительного фосфорилирования при метаболизме жиров значительно ниже, чем при метаболизме углеводов. Ключевой проблемой окислительного фосфорилирования остается механизм сопряжения транспорта электронов по дыхательной цепи и фосфорилирования, т. е. синтеза АТФ, в митохондриях.
Существуют 3 основные гипотезы сопряжения окисления и фосфорилирования: химическая, механохимическая, химиоосмотическая.
Согласно химической гипотезе, посредниками между переносом электронов по дыхательной цепи и синтезом АТФ служат неизвестные пока химические вещества, которые принимают на себя возбужденные электроны и затем переносят их на АДФ или ортофосфат для синтеза АТФ при их взаимодействии. Предпосылкой химической гипотезы явилось обнаружение таких «первичных макроэргов» в процессе синтеза АТФ при анаэробном гликолизе.
В соответствии с механохимической гипотезой, перенос электронов дыхательными ферментами создает их напряженную конформацию, т. е. сжимает молекулу фермента наподобие пружины. Далее энергия, накопленная такой макромолекулой, предается в форме механической деформации компонентам протонной помпы, образующим с дыхательными ферментами прочные комплексы. При последующем расслаблении напряженных молекул накопленная ими энергия идет на синтез АТФ. Авторы механохимической гипотезы видят подтверждение ее основных положений в том, что перенос электронов по дыхательной цепи сопровождается деформациями митохондриальных крист. Однако эти изменения происходят довольно медленно. Большинство исследователей считают их не причиной, а следствием окислительного фосфорилирования.
Основной постулат химиоосмотической гипотезы состоит в том, что энергия, освобождающаяся при окислении, вначале накапливается в форме электрического и концентрационного градиентов на внутренней мембране митохондрии, а уже они непосредственно обеспечивают преодоление энергетического барьера в реакции фосфорилирования АДФ: АДФ + Н3РО4 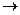 АТФ + Н2О. Химиоосмотическая гипотеза со времени создания ее П. Митчеллом в 1961 г. не опровергнута ни одним экспериментом, но и не приобрела всех необходимых прямых доказательств.
АТФ + Н2О. Химиоосмотическая гипотеза со времени создания ее П. Митчеллом в 1961 г. не опровергнута ни одним экспериментом, но и не приобрела всех необходимых прямых доказательств.
Основную идею гипотезы Митчелла подтверждает факт нарушения окислительного фосфорилирования при снижении разности потенциалов на митохондриальной мембране и падении разности рН между цитозолем и матриксом. Именно так действуют агенты, разобщающие окисление и фосфорилирование. Будучи слабыми липофильными кислотами, они способны переносить протоны (Н+) через липидный каркас внутренней митохондриальной мембраны, минуя канал в Н-АТФазе. Важным аргументом в пользу химиоосмотической гипотезы служат также экспериментальные данные о быстром защелачивании матрикса митохондрии и закислении окружающей их среды при резком усилении клеточного дыхания. Следовательно, перенос электронов подыхательной цепи сопровождается выходом из внутренней митохондриальной мембраны ионов Н+ в цитозоль, а ОН- − в матрикс митохондрии. Транспорт обоих ионов происходит вопреки действию физико-химических градиентов, на что и затрачивается свободная энергия, выделяющаяся при окислении субстратов клеточного дыхания. Поддержание определенного концентрационного градиента Н+ на митохондриальной мембране − необходимое условие сопряжения окисления и фосфорилирования, которое нарушается не только при его падении, но и при избыточном повышении. Во втором случае транспорт электронов по дыхательной цепи тормозится, вплоть до полной остановки, а на некоторых участках они идут вспять, создавая обратный электронный поток.
По-видимому, в результате переноса электронов по дыхательной цепи во внутренней мембране митохондрии образуется не вода, а Н+ и ОН-, которые благодаря векторным свойствам этой мембраны выделяются из нее по разные стороны − в разные компартменты (матрикс и межмембранное пространство) митохондрии (рис. 33).
Вследствие высокой проницаемости наружной митохондриальной мембраны Н+-ионы легко выходят в цитозоль, создавая там более низкий рН, чем в матриксе, куда протоны не могут проникнуть из-за крайне слабой проницаемости внутренней митохондриальной мембраны для них. Окисление концентрирует Н+ в одном из компартментов, разделенных митохондриальными мембранами, и, стало быть, совершает осмотическую работу.
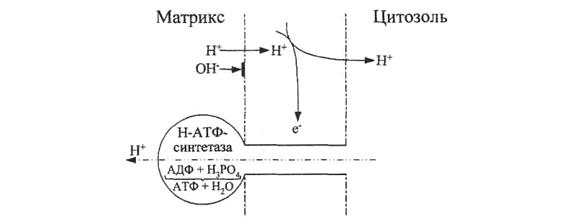
Рис. 33. Модель механизма транспорта протонов через внутреннюю митохондриальную мембрану.
Осмотическая энергия накапливается в виде градиента Н+-ионов (протонного градиента) на этой мембране. Один акт восстановления молекулы О2 до Н2О приводит к выделению 4 Н+ в цитозоль и 4 ОН- в матрикс. Избытки ионов противоположного знака по обе стороны мембраны создают на ней разность потенциалов порядка 200−250 мВ, причем митохондриальный матрикс приобретает отрицательный потенциал относительно цитозоля. Так митохондрия накапливает электрическую энергию. Митохондрии, на мембране которых поддерживается протонный градиент, называются энергизованными.
Таким образом, энергия возбужденных электронов преобразуется на внутренней мембране митохондрии в осмотическую и электрическую, вследствие чего создается протондвижущая сила, которая стремится обеспечить трансмембранный перенос Н+-ионов для выравнивая их концентрации внутри и вне митохондрии, но этому препятствует внутренняя митохондриальная мембрана.
Транспорт протонов, создающий протондвижущую силу, реализующуюся затем при синтезе АТФ, происходит в два такта:
1) Н+, покинувший какую-либо молекулу во внутренней мембране митохондрии под действием энергии переносимых электронов, выходит из нее в межмембранное пространство и далее в цитозоль;
2) на его место приходит Н+ из матрикса.
Следовательно, протоны проходят мембраны не насквозь, а передаются по эстафете − по аналогии с процессом в плазмолемме галобактерии, но с той разницей, что свободную энергию на выброс Н+ галобактерии получают при непосредственном поглощении фотонов, а митохондрии − от π-электронов, возбужденных Солнцем в молекуле хлорофилла и сохранивших возбужденное состояние в биомолекулах (субстратах клеточного дыхания), катаболизирующих в организме до атомарного водорода (протона и электрона).
За счет энергии, выделяющейся в ходе биологического окисления, протоны выходят из компонентов внутренней митохондриальной мембраны в межмембранное пространство и далее в цитозоль, преодолевая электрохимический потенциал. Вакансии, образовавшиеся в химических веществах мембраны при отдаче Н+, заполняются протонами из матрикса. При таком транспорте от Н+ отстают анионы гидроксила, в результате чего на митохондриальной мембране разобщаются разноименные заряды (катионы и анионы), и между матриксом и цитозолем формируется разность потенциалов.
Предполагают, что выход протонов из внутренней митохондриальной мембраны в цитозоль происходит в трех участках дыхательной цепи:
1) между НАДН и коэнзимом Q;
2) между цитохромами b и c1;
3) между цитохромом с и цитохромоксидазой. Раньше эти участки считались пунктами синтеза АТФ, что и обозначалось на схемах клеточного дыхания.
Современная схема окислительного фосфорилирования,происходящего в митохондриях, изображена на рис. 34. Ее важнейшим элементом, наряду с дыхательной цепью, является сложный молекулярный комплекс Н-АТФазы, которая здесь выполняет функцию синтеза АТФ и поэтому называется Н-АТФсинтетазой (или Н-АТФсинтазой).
Состав, структурные и топографические свойства этого фермента хорошо изучены (с разрешением в 0,28 нм). В нем выделили две части: 1) мембранную − гидрофобный белковый комплекс, образующий канал для Н+ во внутренней митохондриальной мембране (F0) и 2) матричную − гидрофильный фактор сопряжения, выступающий из мембраны в матрикс (F1).
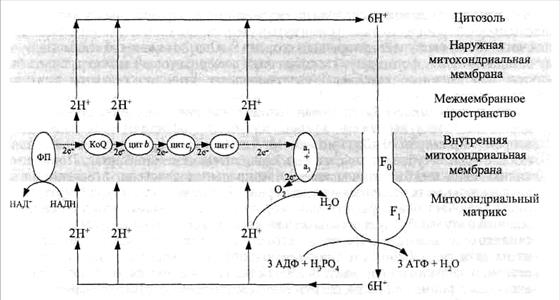
Рис. 34. Общая схема окислительного фосфорилирования.
Весь фермент по своему строению похож на гриб, ножку которого образует F0, а сферическую головку − F1 (35).
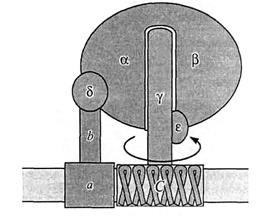
Рис. 35. Упрощенная схема Н-АТФсинтетазы.
Комплексы F0 и F1 связаны между собой неподвижным «кронштейном», образованным а- и b-субъединицами первого из них и 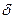 -субъединицей второго, и подвижной
-субъединицей второго, и подвижной 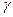 -субъединицей.
-субъединицей.
Как уже говорилось, Н-АТФсинтетаза представляется электромотором. Его статор включает части обоих комплексов: F1 (гексамер из 3 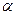 - и 3
- и 3 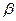 -субъединиц, а также
-субъединиц, а также 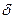 -субъединицу) и F0 (а- и b-субъединицы). В состав ротора, диаметр которого составляет 1 нм, входят
-субъединицу) и F0 (а- и b-субъединицы). В состав ротора, диаметр которого составляет 1 нм, входят 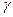 - и
- и 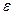 -субъединицы комплекса F1 и цилиндр из с-субъединиц комплекса F0.
-субъединицы комплекса F1 и цилиндр из с-субъединиц комплекса F0.
Можно считать доказанным, что ферментативная активность Н-АТФсинтетазы непосредственно связана с вращением ее 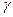 -субъединицы в полости гексамера. При таком повороте изменяется конформация всех трех каталитических (т. е. катализирующих реакцию АДФ + Н3РО4 -> АТФ + Н2О)
-субъединицы в полости гексамера. При таком повороте изменяется конформация всех трех каталитических (т. е. катализирующих реакцию АДФ + Н3РО4 -> АТФ + Н2О) 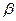 -субъединиц комплекса F1 что и обеспечивает активирование фермента. Он работает как электромотор, подвижная часть которого вращается при пропускании электрического тока через обмотку.
-субъединиц комплекса F1 что и обеспечивает активирование фермента. Он работает как электромотор, подвижная часть которого вращается при пропускании электрического тока через обмотку.
В отличие от технических электромоторов, в Н-АТФсинтетазе ток через обмотку статора обусловлен потоком не электронов, а протонов. Движущей силой протонного электротока через канал в F0 служит разность электрохимических потенциалов Н+-ионов на внутренней митохондриальной мембране. Поэтому ее и называют протондвижущей силой. Она образуется за счет активного транспорта протонов из мембраны в цитозоль − в сторону более высокого электрохимического потенциала, т. е. вопреки сопряженному действию концентрационного и электрического градиентов. Такой источник энергии для систем активного транспорта называют редокс-помпой.
В результате активного транспорта ионов водорода в межмембранное пространство и далее − в цитозоль рН цитозоля ниже, чем рН митохондриального матрикса. Разность концентраций Н+-ионов между цитозолем и матриксом может достигать трех порядков. Чем она больше, тем выше степень энергизованности митохондрий. В обычных условиях на мембранах дышащей митохондрии гепатоцита протондвижущая сила ( 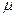 H+) находится в линейной зависимости от изменения свободной энергии при активном транспорте протонов (
H+) находится в линейной зависимости от изменения свободной энергии при активном транспорте протонов ( 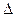 GH+). Если выразить протондвижущую силу в мВ, a
GH+). Если выразить протондвижущую силу в мВ, a 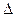 GH+ − в ккал·моль-1, то
GH+ − в ккал·моль-1, то 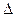 GH+ = - 0,023 · (
GH+ = - 0,023 · ( 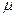 H+). При (
H+). При ( 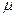 H+) = 220 мВ изменение свободной энергии при активном транспорте 3 протонов составляет 5,06 ккал · моль-1. Однако даже очень большая протондвижущая сила не обеспечивает синтез АТФ, если ее потенциальные возможности не будут реализованы, т. е. если под действием протондвижущей силы Н+-ионы не станут перемещаться из цитозоля в митохондриальный матрикс через протонный канал в F0. Пока он закрыт, протондвижущая сила не реализуется.
H+) = 220 мВ изменение свободной энергии при активном транспорте 3 протонов составляет 5,06 ккал · моль-1. Однако даже очень большая протондвижущая сила не обеспечивает синтез АТФ, если ее потенциальные возможности не будут реализованы, т. е. если под действием протондвижущей силы Н+-ионы не станут перемещаться из цитозоля в митохондриальный матрикс через протонный канал в F0. Пока он закрыт, протондвижущая сила не реализуется.
Если Н+-ионы пойдут из цитозоля в матрикс не по каналу в F0, а иначе, то АТФ не синтезируется даже при весьма интенсивном транспорте электронов по дыхательной цепи и обусловленным им выбросе Н+-ионов в цитозоль (с закислением его). Такое состояние возникает не только под действием искусственных протонофоров (например, динитрофенол, аспирин и другие слабые липофильные кислоты). Оно имеет место в естественных условиях в так называемом буром жире. Эта ткань присутствует у эмбрионов и новорожденных детей, а также у животных, впадающих в зимнюю спячку. Во внутренних мембранах митохондрий клеток бурого жира содержится особый транспортный белок (естественный протонофор), который позволяет Н+-ионам свободно переходить в сторону более низкого электрохимического потенциала из цитозоля в митохондриальный матрикс, минуя канал F0. В результате клетки бурого жира весьма интенсивно окисляют жир, но энергия возбужденных π-электронов преобразуется преимущественно в тепло, а не в химическую энергию синтеза АТФ. Это важный механизм защиты организма от переохлаждения.
Протонный канал в F0 состоит из 2 частей (полуканалов), одна из которых находится около межмембранного пространства, где концентрация Н+-ионов высока, а другая примыкает к матриксу. Между полуканалами нет соосности. Главная роль в работе канала принадлежит аминокислотным остаткам a- и с-субъединиц F0, содержащим протонируемые карбоксильные группы, поскольку они способны взаимодействовать с протонами и передавать их друг другу. В F0 такой способностью обладают аспарагил, аргинил, гистидил и глютамил.
Предполагают, что сигналом к переходу протонного канала из закрытого в открытое состояние служит уменьшение в клетке величины соотношения концентраций АТФ и АДФ, т. е. повышение содержания АДФ и ортофосфорной кислоты. Это происходит при усиленном гидролизе АТФ, в результате чего возрастает потребность в активизации его синтеза.
Как только протонный канал в F0 открывается, в него устремляются ионы водорода из цитозоля − возникает протонный электрический ток в «обмотках» молекулярного электромотора (Н-АТФсинтетазы). Поток заряженных частиц (Н+) приводит в движение его ротор (  -субъединицу комплекса F1). Блокада движения Н+-ионов через канал дициклокарбодиимидом, специфическим ингибитором аспарагила в с-субъединице комплекса F0, останавливает вращение ротора, а вместе с ним и синтез АТФ, поскольку фосфорилирование АДФ с образованием АТФ активизируется посредством так называемого вращательного катализа (rotary catalysis). Вращение
-субъединицу комплекса F1). Блокада движения Н+-ионов через канал дициклокарбодиимидом, специфическим ингибитором аспарагила в с-субъединице комплекса F0, останавливает вращение ротора, а вместе с ним и синтез АТФ, поскольку фосфорилирование АДФ с образованием АТФ активизируется посредством так называемого вращательного катализа (rotary catalysis). Вращение  -субъединицы в статоре Н-АТФсинтетазы происходит скачками (дискретно) с шагом в 120°. Для совершения ротором такого шага через канал должны пройти 2−3 иона водорода. При каждом скачке развивается усилие в 40 пиконьютонов и синтезируется 1 молекула АТФ. Полный оборот ротора происходит за 3 скачка − при этом образуются 3 молекулы АТФ. Если сравнить силы, возникающие при работе Н-АТФсинтетазы и актомиозинового комплекса, то первая из них на порядок больше.
-субъединицы в статоре Н-АТФсинтетазы происходит скачками (дискретно) с шагом в 120°. Для совершения ротором такого шага через канал должны пройти 2−3 иона водорода. При каждом скачке развивается усилие в 40 пиконьютонов и синтезируется 1 молекула АТФ. Полный оборот ротора происходит за 3 скачка − при этом образуются 3 молекулы АТФ. Если сравнить силы, возникающие при работе Н-АТФсинтетазы и актомиозинового комплекса, то первая из них на порядок больше.
Таким образом, синтез АТФ связан не только с теми преобразованиями энергии, которые постулировал П. Митчелл в своей химиоосмотической гипотезе. Цепь энергетических превращений включает: солнечную энергию, заключенную в π-электронах, участвующих в химических связях многих органических веществ; осмотическую энергию переносимых Н+-ионов; электрическую энергию мембранного потенциала в митохондриях; механическую энергию ротора, вращающегося в статоре Н-АТФсинтетазы, и накопление химической энергии в концевой фосфатной связи АТФ.
Скорость работы Н-АТФсинтетазы зависит не только от величины протондвижущей силы, но и от концентрации субстратов синтеза АТФ, т. е. от концентрации АДФ и Н3РО4. По мере усиления наработки АТФ фермент снижает свою активность, тем более что при его активной работе падает градиент Н+-ионов на митохондриальных мембранах. Такая ситуация служит сигналом к повышению скорости переноса электронов по электрон-транспортной цепи митохондрий. Следовательно, между биологическим окислением и фосфорилированием при их сопряжении в митохондриях существует сложная система обратных связей.
Протондвижущая сила на митохондриальных мембранах обеспечивает не только фосфорилирование АДФ как таковое, но также трансмембранный перенос ортофосфата из цитозоля в матрикс. Транспорт фосфата, а также пирувата через внутреннюю митохондриальную мембрану осуществляется посредством симпорта с Н+. Для Са2+ в мембране есть специальный транспортный белок, но он не работает, если падает трансмембранный электрический градиент, обычно поддерживаемый выбросом Н+ в цитозоль. Только тогда в матриксе создается отрицательный потенциал относительно цитозоля. Он-то и притягивает к себе катионы кальция, а переносчик обеспечивает их пассивный транспорт.
Антипорт АТФ и АДФ через митохондриалъные мембраны.АТФ после синтеза в митохондрии покидает ее, выходя через мембраны в цитозоль. В обратном направлении транспортируется АДФ, из которого синтезируются новые порции АТФ. Их антипорт обеспечивается переносчиком. АТФ − четырех-, а АДФ − трехвалентные анионы. Их сопряженный транспорт экономит энергию, поскольку перенос заряженных частиц − весьма энергоемкий процесс, а встречное движение четырех- и трехзарядных частиц одного знака равнозначно преодолению мембраны однозарядной частицей. У человека оборачиваемость молекулы АТФ на митохондриальной мембране составляет 103−104 раз в сутки. В результате концентрация АТФ в 5−10 раз превосходит содержание АДФ в клетке.
Выйдя в цитозоль, АТФ взаимодействует с креатином (Кр), в результате чего образуется креатшфосфат (КрФ) и АДФ (рис. 36). АДФ транспортируется в митохондриальный матрикс в обмен на АТФ, а КрФ мигрирует по цитозолю к тем частям клетки, где нужна свободная энергия в данный момент. Там КрФ вступает в реакцию с АДФ, продуктами которой служат АТФ и Кр. По мере надобности АТФ гидролизуется и дает возбужденный ортофосфат для фосфорилирования и, благодаря этому, энергизации функциональных биомолекул, что позволяет им преодолеть потенциальный барьер реакций, в которые они вступают. Креатин же мигрирует к митохондрии, где вступает в реакцию с АТФ для повторения цикла. Как синтез, так и распад креатинфосфата катализируется креатинфосфокиназой (КФК).
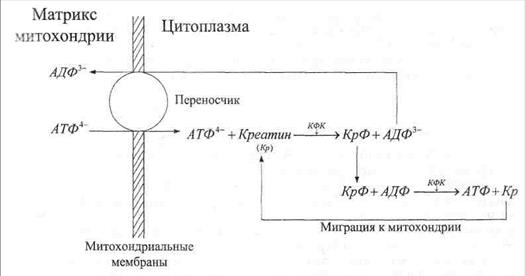
Рис. 36. Схема транспорта АТФ через митохондриальные мембраны и по цитоплазме: Кр − креатинин; КФК − креатинфосфокиназа; КрФ − креатинфосфат.
Дата добавления: 2015-06-22; просмотров: 4897;
