Океанические воды
Мировой океан вместе с морями занимает 71% поверхности Земли и содержат до 1338 млн км3 (1370 млн км3) воды, т.е. 96,5% ее мировых запасов. Мировой океан включает Тихий, Атлантический, Индийский и Северный Ледовитый. Его части, вдающиеся в сушу называют морями.
В рельефе дна океана выделяются два этажа. Верхний располагается на глубинах менее 200 м, называется шельфом и занимает 7,5% дна океана. Нижний этаж приурочен к глубинам от 4,0 до 5,5 км. Это абиссальные равнины, которые занимают 77,5% всей площади океана. Эти этажи разделяет континентальный склон с глубинами от 200 до 4000 м. Глубже 4,5 км находятся глубоководные впадины.
В геологическом отношении океан занимает всю площадь океанической коры и окраины континентальной. Континентальный склон с шельфом относятся к континентальной коре, а абиссальные равнины и глубоководные впадины принадлежат океанической. Согласно теории тектоники плит и та и другая кора представляют собой лишь внешнюю часть 20 больших и маленьких литосферных плит мощностью от 75 до 150 км, которые включают в себя и значительную часть верхней мантии. Эти плиты, как гигантские айсберги, плавают на частично расплавленной астеносфере. Место, где океаническая кора растет, а две соседние плиты расходятся, называется спредингом. Спрединг проявляется в формировании срединно-океанических хребтов, образующих самую протяженную горную цепь (около 75 тысяч километров). При раздвижении плит в зоне спрединга к поверхности поднимается материал мантии, который остывая увеличивает площадь плит. На Восточно-Тихоокеанском поднятии скорость удаления плит друг от друга составляет 60-170 мм/год, скорость сопоставимая со скоростью роста ногтей. На Срединно-Атлантическом хребте плиты расходятся со скоростью около 30 мм/год. В местах, где плиты надвигаются друг на друга, называются зонами субдукции. В этих зонах океаническая кора погружается под континентальную, образуя глубоководные желоба и островные дуги с активным вулканизмом. Как зоны спрединга, так и зоны субдукции являются районами наиболее активного массообмена между океаном и корой. Другими местами аналогичного интенсивного массообмена являются так называемые горячие точки. Согласно гипотезе У.Дж. Моргана, мантийное вещество в этих точках проникает к поверхности по локальным узким каналам. Положение таких вертикальных каналов жестко зафиксировано в мантии и не зависит от движения литосферных плит. Последние, движутся над этими каналами и как бы прожигаются ими. Так образуются локальные очаги вулканизма, которые смещаются в направлении обратном движению плит. На океанической плите в результате этого образуются цепочки вулканических островов и подводных гор. Наиболее наглядным примером горячих точек могут служить Гавайские острова.
Океан можно представить как гигантское бессточное озеро. В его питании участвует большая часть континентального стока, который имеет очень низкую минерализацию. Несомненно в балансе вод океана активно участвует подземный сток, но его роль пока не определена. Как и бессточные озера океан теряет преимущественно влагу за счет ее испарения. Таким образом океан аккумулирует почти весь твердый и ионный сток континентов. Средний период полного возобновления вод океана оценивается равным 2,5 тыс. лет. Радиоуглеродные методы позволяют оценивать возраст океанических вод. Согласно его показателям воды Атлантического океана имеют возраст около 600-800 лет в центральной части и до 900 лет в восточной. Возраст вод Тихого океана достигает 1500 лет. Однако, необходимо учитывать, что эти оценки возраста несколько занижены из-за недоучета 14C в осаждающемся детрите. Средняя продолжительность водообмена глубоких вод оценивается равной 700 годам в Атлантическом и 2500 годам в Тихом океане.
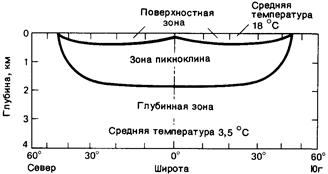
|
| Рисунок 0‑10. Схематическая диаграмма слоистой структуры океана и относительного объема каждой зоны. Заметьте, что "глубинная" зона вблизи полюсов подходит к поверхности (по Гроссу [140]). |
Воды в толще океана, как и в озерах стратифицированы. Так как состав и минерализация его вод меняется мало, эта стратификация обусловлена преимущественно температурным фактором. На холодных плотных водах плавают слой разуплотненных теплых вод. Границей между этими толщами служит термоклин. Он присутствует везде, кроме самых высоких широт, и отделяет теплый верхний слой с переменной температурой от холодного нижнего с практически постоянной температурой. Температура поверхностных вод изменяется от -2 до +220 С. Температура придонных вод для всех океанов находится в достаточно узком интервале, от -2 до +1 0С. Глубина залегания термоклина в тропических и экваториальных зонах достигает 300-500 м и уменьшается к высоким широтам. Толща вод ниже термоклина питается в приполярных областях и разгружается в локальных ограниченных по площади районах. Большое значение в формировании соства вод океана имеет процесс, назваемый апвеллингом, вследствие которого холодные воды нижнего слоя выходят на поверхность. Это явление происходит там, где постоянные сгоняют поверхностную воду от крутого берегового склона. Расположены апвеллинги преимущественно вдоль западных берегов континентов.
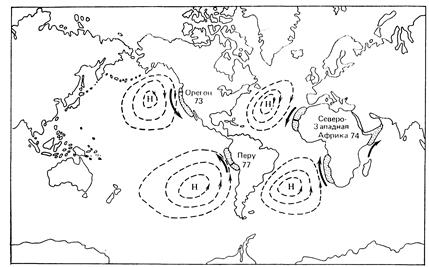 Рис.. Пять наиболее продуктивных зон прибрежных апвеллингов (области, покрытые точками) и системы атмосферного давления на уровне моря (антициклоны), влияющие на апвеллинги. Стрелками показано примерное положение основных течений. (Ю. Одум, 1986, стр.292)
Рис.. Пять наиболее продуктивных зон прибрежных апвеллингов (области, покрытые точками) и системы атмосферного давления на уровне моря (антициклоны), влияющие на апвеллинги. Стрелками показано примерное положение основных течений. (Ю. Одум, 1986, стр.292)
|
Изотопный состав±
Океанические воды, особенно на глубинах более 500 м, изотопно очень однородны. Это обстоятельство позволило Крейгу предложить их в качестве стандарта изотопного состава водорода и кислорода. По условиям распределения изотопов в океанической воде можно выделить три слоя: приповерхностный, глубиной до 500 м, переходный и глубокий, ниже 1000 м. Средний изотопный состав океанического пара имеет dD около - 2,2%и d18O около -0,4%. В приповерхностном слое вариации изотопного состава воды составляют для дейтерия около 3,5% и для кислорода-18 около 0,3%. Таянье полярных льдов и айсбергов способствует снижению концентраций тяжелых изотопов в океанической воде. Антарктида и Гренландия главные постоянные поставщики изотопно легкой влаги. Вследствие этого океаническая влага поверхности океана (выше термоклина) закономерно изотопно утяжеляется от полярных областей к экватору. В.М. Мухачев полагает, что именно дефицит дейтерия привлекает к полярным морям планктон и китов. Вариации относительного содержания дейтерия в глубоких слоях океана составляют всего около 0,4%, а изотопов кислорода-18 - 0,03%.
Минеральный состав
Благодаря огромной массе и продолжительной истории формирования состав океанических вод характеризуется исключительной стабильностью, которая отражает постоянство его современного водного и солевого баланса. Есть основания полагать, что объем и состав океана существенно не менялись, по крайней мере, с палеозоя.
Таблица 80. Главные ионы океанической воды по С.В.Бруевичу(1966) (на 1 кг при S=35,00‰ и Cl=19,375‰)
| Катионы | Анионы | ||||
| Компоненты | Количество, г | Эквивалент | Компоненты | Количество, г | Эквивалент |
| Na+ | 10,7638 | 0,46806 | Cl- | 19,3534 | 0,54582 |
| Mg2+ | 1,2970 | 0,10666 | SO42- | 2,7007 | 0,05623 |
| Ca2+ | 0,4080 | 0,02035 | HCO3- | 0,1427 | 0,00234 |
| K+ | 0,3875 | 0,00991 | CO32- | (0,0702) | (0,00234) |
| Sr2+ | 0,0136 | 0,00031 | Br- | 0,0659 | 0,00083 |
| F- | 0,0013 | 0,00007 | |||
| H3BO3 | 0,0265 | - |
Средняя минерализация вод океана равна 35 г/л. На постоянство минерализации морских вод обратили внимание еще Р. Бойль в XVII в. В океанической воде присутствуют все известные в природе элементы. Преобладающим анионом в океанической воде является хлор, на втором месте находятся сульфаты. Впервые состава морской воды был определен 1859-1865 г. Форхгаммером. Диттмар в 1872-1884 г. исследовал состав вод в разных частях океана. Среди катионов преобладает Na+, а на втором месте Mg2+. Океаническая вода достаточно жесткая и по классификации В.А. Сулина относится к хлоридно-магниевому типу. Кровь животных и человека по своему солевому составу очень близка к водам океана. Этот факт иногда используется как аргумент в пользу гипотезы, что жизнь зародилась и первоначально развивалась в водах океана.
Таблица 81. Главнейшие ионы и питательные вещества в Составе морской воды [288, 346, 45 и другие источники]
| Компоненты | Содержание в мг/кг | Компоненты | Содержание в мг/кг |
| Ионы | |||
| Cl- | B | 4,5 | |
| Na+ | F- | 1,3 | |
| SO42- | Si | 0,5-10 | |
| Mg2+ | O2 | 0,1 -6 | |
| Ca2+ | NO3- | 0,005 - 2 | |
| K+ | PO43- | 0,001 -0,05 | |
| HCO3- | Cорг | 0,3 — 2 | |
| Br- | |||
| Sr | |||
| Микроэлементы (мкг/кг) | |||
| Li | Zr | 0,03 | |
| Be | 6 ·10-4 | Nb | 0,01 |
| Al | Mo | ||
| Sc | 6 ·10-4 | Ag | 0,04 |
| Ti | Cd | 0,05 | |
| V | Sn | 0,01 | |
| Cr | 0,3 | Sb | 0,2 |
| Mn | 0,2 | I | |
| Fe | Cs | 0,4 | |
| Co | 0,05 | Ba | |
| Ni | 0,5 | Редкие земли | 10-3 -10-5 |
| Cu | 0,5 | W | 0,1 |
| Zn | Au | 4·10 -3 | |
| Ga | 0,03 | Hg | 0,03 |
| Ge | 0,05 | Tl | 0,01 |
| As | Pb | 0,03 | |
| Se | 0,2 | Bi | 0,02 |
| Rb | Ra | 1·10 -7 | |
| Y | 1·10-3 | U | 3,3 |
Даже при значительном изменении минерализации океанических водах соотношение главных компонентов остается неизменным, что свидетельствует о хорошей перемешанности вод и о древнем возрасте океана. Одни исследователи предполагают, что состав океана сформировался около 150 млн. лет назад, другие - даже 500 млн. Поэтому межкомпонентные соотношения (Br/Cl=0,0033; SO4/Cl = 0,14; Na/Cl=0,55; Mg/Cl=0,066 и т.д.) являются более надежной характеристикой генетической природы морской воды, чем сами их концентрации. Это положение сформулировано в законе Диттмара:
В воде открытого океана независимо от абсолютных концентраций количественные соотношения между главными компонентами основного солевого состава постоянны.
Этот закон позволяет рассчитывать весь состав океанической воды по содержанию только одного компонента. В качестве такого "реперного" компонента выбран хлор. Хлорность морской воды равняется содержанию хлорного иона выраженной в г/кг или в промиллях. Под соленостью морской воды понимается суммарное содержание всех минеральных веществ в граммах на килограмм морской воды при условии, что бром и иод замещены эквивалентным содержанием хлора, все углекислые соли переведены в окислы, а все органические вещества сожжены при температуре 4800 С. В 1966 году Объединенная группа по океанологическим таблицам и стандартам при ЮНЕСКО на сессии в Беркли (США) рекомендовала следующие уравнения связывающие хлорность -Cl, соленость -S и сумму ионов -I:
S‰ = 1,80655 Cl‰;
I‰ = 1,81578 Cl‰;
I‰ = 1,005109 S‰.
Эти уравнения применимы только к водам открытых районов океана и морей. В изолированных морях, воды которых находятся под влиянием пресного материкового стока, наблюдаются свои хлорные коэффициенты:
Балтийское S‰ =0,115+ 1,805 Cl‰;
Черное S‰ =0,184+ 1,795 Cl‰;
Азовское S‰ =0,210+ 1,794 Cl‰;
Суммарное содержание макрокомпонентов, т.е. минерализация океанических вод, не постоянна, а закономерно меняется подчиняясь определенной зональности. Различают вертикальную и горизонтальную гидрохимическую зональности вод океана.
Как и в случае с изотопным составом в толще океанских вод можно выделить три слоя: приповерхностный, глубиной в несколько сот метров, переходный и глубокий, ниже 2000 м.
Приповерхностный слой океанической воды характеризуется наибольшим диапазоном величин минерализации, изменяющейся преимущественно в горизонтальном направлении от 32 до 37 г/кг. Во внутренних морях отклонения могут быть еще более значительными. Соленость вод Балтийского моря меняется от 2‰ в Финском заливе до 13‰ в южной части. В Белом море соленость 24-30‰, в Черном – около 18‰, а в Красном достигает 42‰.
Поверхностные воды Тихого океана менее минерализованы (в среднем 34,7 г/кг), чем те же воды в Атлантике (35,3 г/кг). Это объясняется тем, что Тихий океан большую часть испаряемой с его поверхности влагу получает обратно в виде осадков, а Атлантический океан ее теряет в сторону Евроазиатского континента и из-за цепи Скалистых гор и Кордельер не получает компенсации с запада, с стороны Тихого.
В целом наблюдается общая субширотная зональность приповерхностных вод океана по минерализации, вызванная изменением количественного соотношения атмосферных осадков и испаряемости. На тропических и субтропических широтах, в зоне пассатов, где отношение испаряемой влаги к осадкам достигает 2,0, наблюдается самая высокая минерализация вод приповерхностного слоя, до 37 г/кг и более. В экваториальной и высокоширотных зонах, где отношение испаряемой влаги к осадкам равно соответственно 0,67 и 0,5, наблюдается относительно пониженная минерализация вод приповерхностного слоя. Самая низкая минерализация, 33-34 г/кг, свойственна водам высокоширотных, приполярных зон. Эта зональность несколько нарушена действием течений вод в океане, перетоками атмосферных масс и влиянием вод континентального стока. О.А. Алекин выделил три основные широтные зоны: 1- полярную и субполярную с минерализацией 32-34 г/кг, 2- тропическую и субтропическую с минерализацией до 37 г/кг и 3- экваториальную, с минерализацией 34-36 г/кг.
Наиболее контрастные изменения состава связаны с внутренними морями, частично изолированными от океана. В условиях аридного климата, например в Красном море и Персидском заливе, содержание солей в морской воде достигает 40-41 г/кг. В условиях гумидного климата, особенно во внутренних морях соленость воды очень низкая. В Черном море 18-22 г/кг, а в Финском заливе - только 5 г/кг. Эти изменения минерализации связаны с влиянием атмосферных осадков, с испарением влаги с поверхности, с притоком вод континентального стока.
Сезонные изменения солености океанических вод редко превышает 0,5 г/кг и достигают наибольших значений в приполярных районах за счет талых вод и в эстуариях крупных рек (до 5 г/кг). При этом наблюдается прямая линейная зависимость между содержанием дейтерия и соленостью. В разных районах эти зависимости носят разный характер, но все они сходятся в точке, с соленостью и содержанием дейтерия в глубоких водах океана. Концентрация дейтерия при нулевой солености близка к величине характерной для поверхностных пресных вод прилегающих районов суши.
Переходный слой характеризуется наиболее резким изменением минерализации вод с глубиной и называется галоклином. По своему положению галоклин обычно совпадает с термоклином и находится на глубинах от 300 до 600-800 м.
В глубоких слоях океанических вод, глубже 2000 м, соленость варьирует в очень узком интервале, около 35 г/кг. Изменение минерализации по мере перехода от приповерхностных вод к глубоким носит не одинаковый и иногда достаточно сложный характер. О.А. Алекин выделил четыре типа таких переходов, В.Н. Степанов и В.А. Шагин - до восьми. В полярной и субполярной зоне минерализация воды с глубиной резко увеличивается и на относительно малых глубинах достигает средних значений глубоких вод. В тропической и субтропической зоне переходный слой океанической толщи характеризуется снижением минерализации в верхней части до некоторого минимума и увеличением в нижней до значений характерных для глубоких вод. В экватариальной зоне переходный слой имеет еще более сложный характер распределения минерализации. Он имеет два минимума, у поверхности и на глубинах 800-1000 м, разделенные максимумом на глубине около 500 м.
Содержание большинства макрокомпонентов в составе вод океана меняется строго пропорционально, согласно закону Дитмара. Их содержание не дает полного представления о природе морских вод. Эти минерализованные воды с ионной силой около 0,7 заметно отличаются от разбавленных растворов. Кроме того одни и те же ионы могут существовать в составе нескольких комплексных образований. Так, согласно модели С.А. Брусиловского, только сульфат в этих водах образует следующие комплексы: MgSO4 – 0,01747 моль/л (60,2%); CaSO4 -0,00341 моль/л (11,75%); NaSO4- - 0,0058 моль/л (19,99%); SO42- -0,00234 моль/л (8,06%). Поэтому несмотря на стабильность аналитического состава, истинный состав океанических вод неоднозначен. Разные авторы дают заметно различающиеся модели этого состава.
Наименее стабильными по содержанию являются карбонаты и кальций, которые образуют плохо растворимый кальцит. Большая часть приповерхностных вод океана перенасыщена относительно кальцита. С глубиной с ростом гидростатического давления и понижением температуры увеличивается содержания CO2 и растворимость этой соли. В связи с на глубинах около 500 м океаническая вода становится недонасыщенной относительно кальцита. Однако скорость его растворения еще недостаточна, чтобы успеть растворить кальцит до его захоронения в осадках. Глубина, где весь кальцит растворяется и не накапливается в виде осадков называется уровнем карбонатной компенсации. Этот уровень характеризуется резким изменением содержания кальцита в донных осадках и располагается на глубинах около 3,5 км в Тихом океане и 5 км в Атлантическом. Некоторая зона выше уровня карбонатной компенсации, в которой меняется характер растворения кальцита, называют лизоклином. В этой зоне сохраняются и захороняются в составе осадков только наиболее массивные раковины. Арогонит более растворим, чем кальцит, и поэтому уровень его компенсации располагается выше, на глубинах от нескольких сот метров в тропическом поясе Тихого океана до 2-3 км на севере Атлантического океана. Поэтому кальцит в виде известняка накапливается в мелководных частях океана и, как снег в горах суши, покрывает только верхние части подводных гор. Ниже лизоклина раковины планктона полностью растворяются. Скорость накопления карбонатов кальция выше лизоклина достигает 35-60 мм за тысячу лет и обеспечивает широкое распространение их на дне морей и океана. На глубинах больше 4 км карбонатные осадки отсутствуют.
В 1979 году группа американских, французских и мексиканских исследователей, спустившись на аппарате "Алвин" на дно океана, впервые увидели клубящиеся черные облака флюидов, выходящих из отверстий в форме каменных труб. Такие выходы назвали черными курильщиками или черными дымами. Флюиды эти представляли собой высокотемпературные (до 3800С) кислые (pH 3-5) и восстановительные гидротермальные растворы, обогащенные рудными компонентами. В настоящее время открыто всего около 60-70 таких выходов, большинство которых связано с рифтовыми зонами, входящими в систему срединно-океанических хребтов и к активным океаническим окраинам островодужного типа, соответственно, дивергентным и конвергентным границам крупных литосферных плит.
Большинство гидротерм океанических рифтов сходны по составу. По содержанию главных макрокомпонентов они сопоставимы с морской водой. Их выделяет резкое снижение концентраций магния и сульфатов, а также повышенное содержание кремнезёма, калия, кальция, марганца и железа в высокотемпературных растворах («черных курильщиках»). Почти полное отсутствие SO42- (близко к 0) и магния (1-25 мг/л) является наиболее характерным признаком их состава. Преобладают хлор (часто почти до 100 экв%), натрий и кальций, содержание которых определяет минерализацию гидротермальных вод. Их металлоносность определяет повышенное содержание марганца, железа и цинка. Их максимальные концентрации превышают средние в морской воде на 5-6 порядков.
При смешивании гидротермального раствора с морской водой формируется корреляционная зависимость между содержанием хлора и сульфатов, образуются сульфиды меди, железа и цинка, которые во взвешенном состоянии образуют черный дым и постепенно осаждаются на дно. Как показали исследования, каждый такой выход действует (курит) всего несколько лет.
Около Галапагосских островов периодически действует источник, в котором разгружается термальные воды (2000 С) с избыточным давлением 3×107 Па. Большое внимание привлекли термальные рассолы (257 г/кг), разгружающиеся во впадинах Красного моря. Рассолы обогащены хлоридом натрия, калием и тяжелыми металлами, имеют высокое отношение кальция к хлору, низкое значение pH (около 5) и очень низкий окислительно- восстановительный потенциал (Eh около -100 мВ). Изотопный состав воды этих рассолов такой же, как в морской воде, но изотопный состав гелия (3He/4He= 1,34×10-5) свидетельствует о его мантийных источниках. Чтобы объяснить температурный режим Красного моря необходимо допустить разгрузку либо 400 л/с при температуре 2100 С, либо 800 л/с при температуре 1050 С.
Распределение биогенных веществ определяется биологическими процессами. Поэтому в их поведении наблюдается большое сходство. В приповерхностном слое океана, а именно в фотической зоне, который просвечивается солнцем, и в котором возможен фотосинтез, биологические процессы наиболее активны. В этом слое сосредоточена основная масса фитопланктона, который продуцирует O2 и потребляет растворенные в воде биогенные элементы, прежде всего минеральные P, N, Si и другие, а также некоторых металлов. Это приводит к заметному снижению содержания биогенных элементов и некоторых металлов у самой поверхности океана. Часть их ОВ с этими элементами оказывается связана с биологическим круговоротом внутри фотической зоны, и не выходит за пределы последней. Часть ОВ в виде детритаопускается ниже фотической зоны и окисляясь отдает биогенные элементы обратно в раствор. Поэтому ниже фотической зоны наблюдается резкое увеличение, а затем плавное понижения содержания биогенных элементов.
Однако среди этих элементов наибольший интерес представляют те, которые присутствуют в недостаточном количестве и ограничивают тем самым развитие фитопланктона. Содержание таких элементов контролируется биогеохимическим круговоротом. К таким элементам, прежде всего, относятся азот, фосфор и кремний.
С континентальным стоком и атмосферными осадками поступает только около 0,1×109 т/год связанного азота. Фитопланктон потребляет при фотосинтезе около 7,7×109 т/год азота. Очевидно, что основное потребление живыми организмами обеспечивается внутренним круговоротом азота в океане.
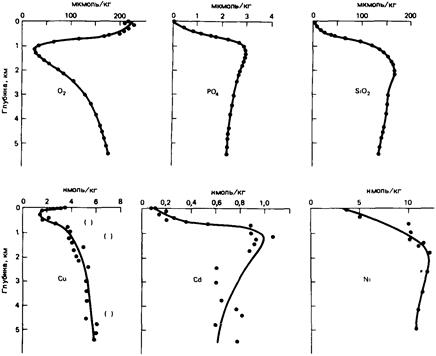
Организмами усваивается преимущественно связанный азот. Последний существует в аммонийной ( 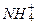 ), нитритной (
), нитритной ( 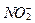 ), нитратной (
), нитратной ( 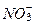 ) формах и в составе органических соединений. Содержание нитрата варьирует от ничтожных концентраций на поверхности, особенно в вегетационный период, до 400-500 мкгN/л (30-40 мкмольN/л).
) формах и в составе органических соединений. Содержание нитрата варьирует от ничтожных концентраций на поверхности, особенно в вегетационный период, до 400-500 мкгN/л (30-40 мкмольN/л).
Растворенный связанный азот наиболее активно потребляется фитопланктоном в зоне фотосинтеза. Поэтому наименьшие концентрации его наблюдаются в этой зоне летом. Глубже он попадает в составе детрита, который постепенно опускается и минерализуется на пути до термоклина и ниже. На первой стадии регенерации образуется аммоний, максимальные концентрации которого непосредственно под зоной фотосинтеза достигают 20-25 мкгN/л (1,4-1,8 мкмольN/л). Еще глубже в присутствии кислорода этот азот окисляется до нитрита, который представляет промежуточную форму связанного азота в присутствии кислорода и достигает 10 мкгN/л, редко 20-30 мкгN/л. Нитриты быстро окисляются до наиболее устойчивой формы - нитрата. Максимальные концентрации этого азота также достигают 20-30 мкгN/л (1,5-2,5 мкмольN/л), так же в слое скачка плотности на глубинах 50-150 м. В прибрежных районах, в эстуариях, содержание нитрата уменьшается линейно с ростом солености.
|
| Рисунок 0‑11. Профили кислорода, фосфата, кремнезема, меди и кадмия по данным GEOSECS, станция 226, и никеля, станция 204 (по Бойлю, Шчлатеру и Эдмонду [40 ]; Бойлю и др. [39]; Шчлатеру и др. [ЗОО]). Растущий фитопланктон в поверхностных слоях продуцирует O2 и снижает содержание в воде биогенных элементов и рассеянных металлов. Процессы разложения ниже фотической зоны сопровождаются потреблением О и переходом в воду биогенных элементов и рассеянных металлов. Профиль меди указывает на наличие ее источников у самой поверхности (атмосферный перенос) и в осадках. Заметьте, что концентрации крайне низкие (1 нмоль/кг = 50 •10-6 млн-1). Скобки указывают на предполагаемое загрязнение. |
Общее содержание связанного азота с глубиной содержание заметно меняется. Он почти отсутствует в фотической зоне, ниже ее его содержание растет до максимума на глубинах термоклина, и имеет стабильные но меньшие концентрации в остальной более глубокой части океана. Только в районах очень высокой продуктивности и накопления органического вещества на глубинах 300-800 м, например, у западных берегов Африки, Южной и Центральной Америки и в некоторых морях (Аравийское море, Бенгальский заливе), наблюдается второй придонный максимум концентрации связанного азота (до 3-10 мкмольN/л), вызванный накоплением и восстановлением нитратов. Это восстановление 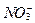 до
до 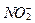 и
и 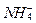 обычно сопровождается появлением сероводорода. В районах апвеллингов этот восстановленный связанный азот периодически выностится в верхнюю зону, где усваивается фитопланктоном.
обычно сопровождается появлением сероводорода. В районах апвеллингов этот восстановленный связанный азот периодически выностится в верхнюю зону, где усваивается фитопланктоном.
Фосфор извлеченный из пород при выветривании поступает вместе с материковым стоком в виде ортофосфата ( 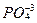 ) и органических соединений в количестве 25 ×106 тP/год. Большая часть этого фосфора адсорбирована взвешенными веществами. В растворенном состоянии поступает только около 0,5 ×106 тP/год. Фитопланктон океана усваивает около 1070 ×106 тP/год. Следовательно, и потребление фосфора живыми организмами обеспечивается исключительно его круговоротом в океане. Поэтому за время своего существования равное в среднем 100 тыс. лет каждый атом фосфора совершает около 100 циклов круговорота внутри океана.
) и органических соединений в количестве 25 ×106 тP/год. Большая часть этого фосфора адсорбирована взвешенными веществами. В растворенном состоянии поступает только около 0,5 ×106 тP/год. Фитопланктон океана усваивает около 1070 ×106 тP/год. Следовательно, и потребление фосфора живыми организмами обеспечивается исключительно его круговоротом в океане. Поэтому за время своего существования равное в среднем 100 тыс. лет каждый атом фосфора совершает около 100 циклов круговорота внутри океана.
Фосфаты в воде подвергаются гидролизу и образуют равновесную систему ионов ортофосфата ( 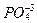 ), гидроортофосфата (
), гидроортофосфата ( 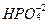 ) и дигидроортофосфата (
) и дигидроортофосфата ( 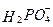 ):
):
H3PO4 « H+ +H2PO4-,
H2PO4- « H+ + HPO42-,
H2PO42- « H+ + PO43-.
Относительное содержание этих ионов определяется величиной pH и константой равновесия.
Концентрация фосфора в океане достигает 100 мкгP/л (3,5 мкмоль P/л) и мало зависит от солености. Как и в случае с азотом, фосфор потребляется преимущественно фитопланктоном в верхнем слое мощностью до 50 м, иногда до 150 м. По этой причине фосфор в водах открытого океана имеет наименьшие концентрации в фотической зоне (до глубин 50 м). Особенно низки концентрации фосфора летом. Незначительная часть фосфора в составе органического вещества опускается глубже фотической зоны. Поэтому ниже ее его содержание возрастает до максимума (около 70-80 мкгP/л) на уровне кислородного минимума, т.е. на глубинах 500-1500 м. На больших глубинах его содержание находится в интервале 50-70 мкгP/л. В морях и неглубоких частях океана часть этого связанного фосфора может достигать дна и накапливаться в илах вместе с органическим веществом. По мере разложения органического вещества этот фосфор переходит в растворенную фосфатную форму и течениями эпизодически выводится на поверхность.
Связанный азот и фосфор распределены в океане почти одинаково. Поэтому соотношение нитрата и фосфата в морской воде относительно постоянно. Максимум нитратов ( 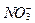 ) и фосфатов (фосфат-ион
) и фосфатов (фосфат-ион 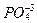 ) наблюдается на глубинах, где располагается минимум концентраций кислорода. Это связано с накоплением продуктов разложения органического вещества, поступающего сверху. Величины отношения N/P в этих продуктах находятся в интервале от 12 до 15. Это означает, что между ними существует прямая линейная зависимость. При этом, их содержание прямо пропорционально содержанию кадмия и обратно пропорционально величине отношения стабильных изотопов углерода 13C/12C. Таким образом основная часть запасов азота и фосфора в океане оказывается за пределами фотической зоны и возвращается в нее только благодаря поднятию глубинных вод на поверхность.
) наблюдается на глубинах, где располагается минимум концентраций кислорода. Это связано с накоплением продуктов разложения органического вещества, поступающего сверху. Величины отношения N/P в этих продуктах находятся в интервале от 12 до 15. Это означает, что между ними существует прямая линейная зависимость. При этом, их содержание прямо пропорционально содержанию кадмия и обратно пропорционально величине отношения стабильных изотопов углерода 13C/12C. Таким образом основная часть запасов азота и фосфора в океане оказывается за пределами фотической зоны и возвращается в нее только благодаря поднятию глубинных вод на поверхность.
Кремний поступает с континентальным стоком в количестве около 4,91×109 тSi/год, а потребляется фитопланктоном в количестве до 31×109 тSi/год. Заметные количества кремния могут поступать в составе океанических гидротерм, воды которых содержат на 1-2 порядка больше кремния (до 1710 мг/кг Si(OH)4), чем морская вода. Поэтому потребление кремния организмами так же, как в случае азота и фосфора, обеспечивается, в основном, его круговоротом в пределах океана.
Кремний присутствует в виде ортокремниевой кислотыSi(OH)4 (H4SiO4) и расходуется на построение скелета диатомовых водорослей, радиолярий, силикофлагеллатов и других организмов. Содержание кремния в океане относительно высокое, от 200 до 1200 мкгSi/л, редко до 4000 мкгSi/л (Японское море).
В фотическом слое кремний активно потребляется диатемовыми водорослями, радиоляриями и другими организмами. Поэтому в этом слое его содержание минимально, и в зависимости от сезона колеблется от 200 до 2000 мкгSi/л. Скелеты из кремнезема (диатомей, радиолярий) постепенно растворяются. Глубже содержание кремния увеличивается, сначала резко, до уровня термоклина, затем медленно и достигает максимальных значений у дна. Однако, при среднем содержании ортокремниевой кислоты9,6 мг/кг, воды океана не насыщены кремнием, и поэтому скелеты погибших организмов почти полностью растворяются. Вследствие дна достигает лишь незначительная часть минерального кремния. Тем не менее диатемовые и радиоляриевые илы занимают до 10% площади дна океана. Альфред Нобиле в 1867 году соединил диатомит, породу из скелетов диатомовых водорослей, с нитроглицерином и получил взрывчатое вещество - динамит. Распределяется растворенный кремний по глубине в общих чертах аналогично азоту и фосфору. Минимальные концентрации его наблюдаются на поверхности, вследствие активного потребления фитопланктоном, ниже фотической зоны его содержание сперва растет по мере минерализации органического вещества и растворения их кремниевых остатков, а затем падает.
Железо в морской и океанической воде присутствует в составе органических соединений в количестве около 6×10-5 мг/кг. Заметные количества железа поступают с гидротермальными растворами, в которых его концентрация достигает 1044 мг/кг. Органические соединения подвергаются гидролизу и образуют коллоидные гидроокислы железа. Коагуляция этих коллоидов приводит к образованию гелевых комочков, которые переносятся водой и постепенно осаждаются вместе с глинистыми частицами. Тем не менее, значительная часть железа усваивается организмами. Одним из основных потребителей железа являются диатомовые водоросли. С их гибелью поглощенное ими железо опускается на дно с органическим веществом.
Среднее содержание марганца в океанической воде едва достигает 5×10-5 мг/кг. В гидротермальных растворах океана его содержание достигает 246 мг/кг. Марганец ведет себя аналогично железу, но его меньше в воде, а соединения его более растворимы и подвижны.
Органическое вещество
Аллохтонное органическое вещество обеспечивает поступление 1×109 т С орг/год преимущественно с материковым стоком. Незначительная часть этого вещества поступает из атмосферы. Это количество составляет только около 2,5-5,0% автохтонного органического вещества, т.е. образованного непосредственно в океане.
Все органическое вещество океана представлено живыми организмами, среди которых преобладают фитопланктон, зоопланктон и бентос, детритом из остатков погибших организмов. Но большая часть его образует коллоидные и истинные растворы. Общее количество органического вещества в океане достигает 4×1012 т.
Растительность распространена в ограниченном по глубине приповерхностном слое мощностью 80-150 м. Этот слой наиболее теплых и освещенных вод океана богатых биогенными и органическими веществами называют фотическим (эвфотической). Растительность преобразовывает растворенное неорганическое вещество в органическое путем фотосинтеза, поглощают растворенную CO2 и обогащают воду O2. Морские животные обитают на всех глубинах океана и на его дне, потребляют преимущественно готовое органическое вещество и O2. Основная часть (более 80%) органического вещества образуют детрит, который медленно опускается на дно, и постепенно минерализуется вплоть до CO2. Этот процесс минерализации длится более 60 суток. Концентрация всего взвешенного органического вещества меняется от 3 до 10 мкгС/л.
Растворенное органическое вещество представлено углеводами, белками и продуктами их разложения, липидами, преимущественно эфирами жирных кислот часто с ортофосфорным радикалом, и сложными гумусовыми и фульвовыми веществами. Содержание растворенного органического углерода характеризуется через углерод органический. Содержание растворенного органического вещества находится в интервале от 0,35 до 0,7 мгС/л (1). Его среднее содержание в водах океана определено равным 1,36 мг/л (2). Общее содержание растворенного органического углерода, около 1,8× 1012 т, почти в сто раз превышает содержание углерода взвешенного органического вещества.
Большая часть автохтонного органического вещества образуется в фотической зоне за счет фотосинтеза, наиболее упрощенной формой выражения которого является уравнение:
6 CO2 + 12 H2O ® C6H12 O6 + 6 O2 + 6 H2O
Продуктивность органического вещества контролируется освещенностью, температурой и достатком питательных веществ. Недостаток света в верхнем приповерхностном слое вод океана наблюдается только в приполярных зонах и в прибрежных мутных водах. Основными лимитирующими продуктивность органического вещества фактором является содержание растворенных в воде нитратов и фосфатов. Наблюдается прямая зависимость между продуктивностью и содержанием фосфатов. Большая часть органического вещества концентрируется на глубинах менее 60-80 м. Ниже этой зоны содержание растворенного органического углерода постепенно уменьшается с глубиной. Вниз с глубиной его содержание падает.
Газовый состав
Молекулярный азот поступает преимущественно из атмосферы. Содержание молекулярного азота в океанических водах зависит преимущественно от их температуры на поверхности и варьирует в относительно узком интервале, от 8,2 мл/л у экватора до 14,1 мл/л в приполярных зонах. Часть этого азота азотфиксирующие бактерии способны переводить в связанное состояние.
В глубоких водах содержание молекулярного азота так же близко к насыщению, а отклонения его содержания от среднего значения обычно не превышают 5%. Некоторую часть этого азота дают организмы способные связанный азот переводить в свободный. В частности, перевод части нитратов в свободный азот наблюдается в анаэробной зоне Черного моря за счет окисления сероводорода. Процесс идет согласно реакции:
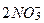 + 6H2S = 6S + N2 + 6H2O
+ 6H2S = 6S + N2 + 6H2O
Поэтому у верхней границы анаэробной зоны Черного моря наблюдается пресыщение вод молекулярным азотом до 105%. Напротив азотфиксирующие бактерии переводят часть свободного азота в связанное состояние.
В последнее время большое внимание уделяется распределению и изотопному составу гелия в океанической воде. Долгое время предполагали, что его содержание определяется только равновесием между океаном и атмосферой. Однако в 1975 году был обнаружен избыточный гелий в гидротермальных водах с почти мантийным изотопным составом. Содержание превышает фоновое иногда в 104 раз, а его изотопное отношение 3He/4He почти в 8 раз выше, чем в атмосфере. Величина его изотопного соотношения находится в прямой корреляционной связи с температурой и содержанием кремния. Исследование изотопного состава гелия позволяет, с одной стороны, трассировать миграцию гидротермальных вод при их рассеивании, с другой, контролировать количество компонентов, поступающих с этими водами из мантийной коры.
Молекулярный кислород поступает из атмосферы или образуется в процессе фотосинтеза. Его содержание находится в интервале от 1,5 до 10 мл/л. Его концентрации достигают максимальных величин в приповерхностной фотической зоне мощностью 50-80 м, где достаточно света, где наиболее интенсивны процессы фотосинтеза. Здесь значительная часть его генерируется хлорофиллсодержащим фитопланктоном. Годовое производство этого кислорода составляет 3,5×1010 т по данным Г.Г. Винберга, 4,5×1010 т по Б.А. Скопинцеву. Вследствие этого воды фотической зоны могут быть пересыщены кислородом на 5-6%, а в вегетативный период на 10-80% и более. Сезонные колебания содержания кислорода наиболее заметны на средних и высоких широтах. Одновременно кислород теряется на окисление органического вещества и дыхание зоопланктона, и это потребление его растет с глубиной. Место, где процессы генерации и расходования кислорода уравновешивают друг друга, называется глубиной кислородной компенсации. Эта глубина опускается от 25-50 м в прибрежных зонах до 100 м в Саргассово море, меняя свое положение в зависимости от сезона.
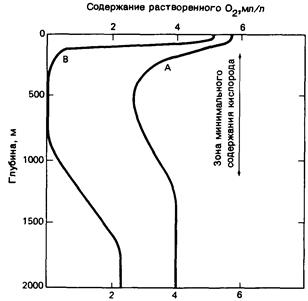
| Рисунок 0‑12. Схематическое распределение O2 с глубиной в океане. Кривая А - район средней поверхностной продуктивности, кривая В — район очень высокой поверхностной продуктивности. |
Глубже фотической зоны содержание кислорода уменьшается и достигает минимальных концентраций, около 1,0 мг/л (менее 30% насыщения) в Атлантическом океане и 0,4 мг/л в Тихом, на глубинах 100-1400 м. Этот слой кислородного минимума располагаются обычно ниже термоклина, на уровне изотермы 80 С.
В основной части океана, на глубинах более 1400-1600 м содержание кислорода увеличивается и стабилизируется при концентрации около 4-5 мг/л, что соответствует 50-70% насыщения. Источником этого кислорода являются холодные полярные воды, которые поступают с глубинными течениями. Даже в глубоководных впадинах распространены эти воды. В Филиппинской впадине содержание растворенного кислорода 3,75 мл/л, в Марианской – до 4,0 мл/л. По мере их распространения и старения содержание кислорода в них уменьшается.
Двуокись углерода океана является основным источником CO2 в атмосфере. В водах океана двуокись углерода образуется в процессе дыхания водных организмов и окисления органического вещества. Локальные интенсивные источники двуокиси углерода связаны с подводными вулканическими извержениями. Одновременно двуокись углерода потребляется фитопланктоном на фотосинтез и ее содержание регулируется карбонатным равновесием. Избыток CO2 расходуется на растворение и выщелачивание карбонатных минералов:
CaCO3 + CO2 + H2O ® Ca+2 + 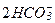
CaSiO3 + CO2 ® Ca+2 + 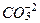 + SiO2
+ SiO2
Вследствие этого содержание двуокиси углерода не превышает 1 мг/л. Его концентрация минимальна в фотической зоне и увеличивается с глубиной по мере снижения интенсивности процессов фотосинтеза и увеличения окисления органического вещества. Наибольших концентраций двуокись углерода достигает в застойной зоне, где наблюдается минимальное содержание кислорода. Максимальные концентрации двуокиси углерода, до 1,3 мл/л (парциальные давления до 0,12 кПа), наблюдаются в восточной части экваториальной и тропической зон Тихого океана на глубинах 400-500 м соответствующих температуре 80 С.
Большие количества двуокиси углерода, очевидно, поступают с гидротермальными растворами и магмой на дне океана. Даже существует гипотеза, что пропажа кораблей в Бермудском треугольнике связана с вскипанием вод океана вследствие мощных разовых выбросов двуокиси углерода. Вследствие образования газовой суспензии плотность океанической воды резко уменьшается, и корабли проваливаются в пучину.
Сероводород в водах открытого океана практически отсутствует. Его обнаруживают лишь в придонных водах прибрежных зон, в водах окраинных или замкнутых морей или заливов. Основной причиной его появления является недостаточность водообмена с поверхностью вследствие высокого градиента плотности. Сероводород установлен в придонных водах впадин Кариако (Карьяко) Карибского моря и Орка Мексиканского залива. В Карибском море содержание кислорода убывает с глубиной и исчезает на глубинах близких к 500 м. Глубже появляется сероводород, содержание которого увеличивается с глубиной и стабилизируется на значении 0,03 mг-атом S/л. Содержание фосфора увеличивается от 1mг-атом/л на поверхности до 2,72 на глубине 700 м. Аммоний присутствует в поверхностных водах, исчезает на глубине 50 м, но еще глубже ниже 270 м вновь появляется и увеличивает свое содержание с глубиной до 8-9 mг-атом/л.
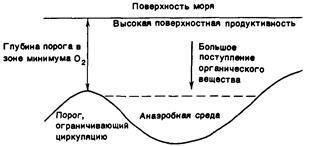
| Рисунок 0‑13. Схематическая иллюстрация условий, необходимых для появления анаэробного бассейна в океане. |
В Аравийском море наибольшие концентрации сероводорода наблюдаются на глубинах от 125-150 до 300-1000 м, в Бенгальском заливе - от 75-150 до 800-1000 м. Содержание сероводорода в этих водах достигает 0,04-0,10 мл/л. Эта зона отличается наибольшим дифицитом кислорода (97-98%), пониженное содержание нитрата ( 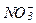 ) и повышенное содержание нитрита (
) и повышенное содержание нитрита ( 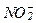 ).
).
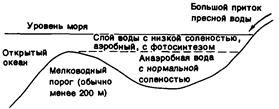
| Рисунок 0‑14. Схематическая иллюстрация анаэробного бассейна типа фьорда. Органическое вещество, продуцируемое в поверхностной зоне с низкой соленостью, осаждается в глубокой зоне и распадается. |
Даже в Балтийском море в периоды длительной стагнации сероводород появляется в придонных водах на глубине около 70 м.
Большую опасность представляет сероводород образующийся вследствие накопления огромного количества органического вещества в прибрежных районах апвеллинга у юго-западных берегов Африки и вдоль западного побережья Южной Америки. Здесь вследствие выноса большого количества биогенных элементов бурно размножаются диатомовые водоросли. На окисление их органического вещества не хватает свободного кислорода, и образуется много сероводорода. При благоприятных ветрах воды насыщенные сероводородом проникают к поверхности и приводят к массовой гибели рыб раз в несколько лет. Такие явления происходят у берегов Перу и Чили. Выходы сероводорода на поверхность моря в 1953 году в районе Уолфиш-Бей юго-западного побережья Африки вызвали массовую гибель рыб в полосе шириной 50 км и длиной более 300 км. Запах сероводорода ощущался на суше в 40 км от берега.
Присутствие сероводорода в этих бассейнах связано с наличием анаэробной зоны. Эта зона как правило занимает придонную часть водоемов и имеет мощность до 1000 м и более. Присутствие сероводорода замечается на верхней границе этой зоны. Восстановленная сера присутствует в виде трех компонентов H2S, HS- и S2-. В анаэробных условиях сероводород образуется в процессе сульфатредукции и разложения сероорганических соединений и накапливается. В аэробных условиях эти компоненты окисляются до тиосульфата - 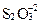 и сульфата -
и сульфата - 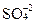 . Содержание биомассы в зоне повышенного содержания сероводорода понижено. В некоторых прибрежных районах наблюдаются выходы сероводородных источников и нефти.
. Содержание биомассы в зоне повышенного содержания сероводорода понижено. В некоторых прибрежных районах наблюдаются выходы сероводородных источников и нефти.
Но наиболее ярким примером сероводородного заражения служит Черное море, которое представляет собой самый крупный и наиболее изученный бассейн сероводородного заражения. Этому способствует резкое увеличение плотности его вод на глубинах 60-100 м и замедленный вертикальный водообмен (150-200 лет). Сероводород появляется в переходном слое. Величина окислительно-восстановительного потенциала в этом, так называемом, С-слое меняет знак с положительного на отрицательный и при Eh от-10 до -20 мВ сосуществуют и кислород (около 0,1 мл/л) и сероводород (от 0,3 до 0,4 мл/л). Мощность этого слоя варьирует от 8 до 35 м, а его верхняя граница располагается на средней глубине 146 м. Глубина залегания этого переходного слоя соответствует галоклину и меняется регионально, куполообразно в центре моря, и в зависимости от сезона года. В любое время года глубина появления сероводорода тесно связана с положением изотермы 80С, что выражается уравнением:
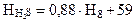
где 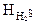 - глубина появления сероводорода, м; H8 - глубина залегания изотермы 80 С. Содержание сероводорода в этом слое и далее вниз увеличивается от 0,01-0,3 мг/л на глубинах около 150 м до 5,5-7,5 мг/л (7 мл/л) на глубине 2000 м и более. Максимальная концентрация сероводорода достигает 13 мг/л. В настоящее время солоноватые сероводородные воды занимают до 90% объема бассейна.~
- глубина появления сероводорода, м; H8 - глубина залегания изотермы 80 С. Содержание сероводорода в этом слое и далее вниз увеличивается от 0,01-0,3 мг/л на глубинах около 150 м до 5,5-7,5 мг/л (7 мл/л) на глубине 2000 м и более. Максимальная концентрация сероводорода достигает 13 мг/л. В настоящее время солоноватые сероводородные воды занимают до 90% объема бассейна.~
Глубина залегания верхней границы зоны сероводородного заражения в последние годы постепенно уменьшается. В восточной части моря эта глубина уменьшилась на 70 м (60 м от поверхности), а толщина слоя С увеличилась до 120 м. Более того, во время экспедиционных работ на шельфе обнаружены признаки выхода сероводорода на поверхность (2). Это вызывает тревогу так как сероводородное заражение грозит гибелью как морской фауне, так и людям прибрежной зоны. Рассекреченный рапорт управляющего Черноморским флотом о "столбах пламени" и "вспышках огня белого цвета" высотой до 500 м и шириной до 1,5-2,0 км непосредственно в море у Севастополя и Евпатория во время Крымского землетрясения в 1927 году вызвал панику среди журналистов. Они сделали предположение, что горел сероводород. Однако растворенный в воде сероводород даже в случае переворота вод, какой имел место в Мертвом море, не способен достичь смертельно опасных концентраций в воздухе. Поэтому катастрофа озера Ниос (3) крымскому побережью не грозит. Тем не менее уже предлагаются проекты откачки сероводородных вод с больших глубин с целью утилизации энергии сгорания и серы сероводорода и сдерживания распространения сероводородного заражения.
Существуют разные гипотезы относительно источников сероводорода в Черном море. Согласно одной из них, 7,5 тысяч лет тому назад[ii], когда последний ледник отступил на север, и общинные охотники на мамонтов и собиратели уже осваивали Русскую равнину, в пресноводное Ново-Эвксинское море (древняя береговая линия обнаружена на глубине 170 м) через пролив Босфор хлынули соленые воды Средиземного моря и стали снизу вытеснять более пресные воды бассейна. В течение почти 5 тысяч лет формировались новые гидрохимические условия сосуществования пресных и соленых вод. Пресные воды постепенно уступили место застойным соленым, в которых сформировались восстановительные условия, благоприятные для образования сероводорода. В конце концов установилось равновесие, при котором глубина распространения сероводородного заражения стабилизировалась. Согласно этой гипотезе сероводород образуется вследствие восстановления сульфатов и гниения органического вещества богатого серой при участии микроорганизмов. Сторонники бактериального происхождения сероводорода полагают, что в настоящее время 97% его количества образовано за счет сульфатредукции и только 3-5% связывают с органическими источниками. Действительно установлено присутствие огромного количества тиофильных бактерий на верхней границе анаэробной зоны и на дне, на глубинах более 2000 м. Кроме того, наблюдается уменьшение с глубиной значения отношения 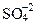 /Cl. Состав и мощность переходной зоны позволяют оценить скорость окисления сероводорода на верхней границе анаэробной зоны равной в среднем 130 г H2S на м2 площади водоема в год. Бактерииже могут обеспечить окисление лишь 25 г H2S на м2 в год.
/Cl. Состав и мощность переходной зоны позволяют оценить скорость окисления сероводорода на верхней границе анаэробной зоны равной в среднем 130 г H2S на м2 площади водоема в год. Бактерииже могут обеспечить окисление лишь 25 г H2S на м2 в год.
Другая гипотеза связывает поступление сероводорода с разгрузкой подземных вод на дне Черного моря. Сторонники глубинного происхождения сероводорода акцентируют внимание на сероводородные минеральные воды Мацесты. Большие запасы этих термальных хлоридно-натриевых вод с минерализацией около 12,6 г/л, с пониженным содержанием сульфата и с H2S до 400 мг/л обнаружены на глубинах до 3000 м, т.е. ниже дна моря. Разгрузка этих вод на дне моря может объяснить не только присутствие сероводорода, но и увеличение минерализации и снижение доли сульфатов в морской воде с глубиной (4).
Присутствие H2S обнаружено и в большинстве гидротерм "черных курильщиков". Содержание H2S в их водах достигает 37-681 мг/кг. В некоторых термах обнаружены повышенные содержания CO2 (до 7480 мл/л) и метана.
Содержание углеводородов в океанической воде измеряется величинами 10-5 -10-4 мл/л. Суммарное содержание тяжелых гомологов метана редко превышает 10-6 мл/л. Содержание этана находится в интервале от 0,54×10-6 до 10,2 10-6 мл/л. 94-99% всего объема углеводородов в водах океана занимает метан. Минимальное содержание метана, около 8×10-5 мл/л, контролируется его парциальным давлением в атмосфере. Содержание метана в морской воде находится в интервале от 0,246 ×10-4 мл/л до 2,83×10-4 мл/л. Наибольшие концентрации метана наблюдаются на глубинах около 30-50 м и уменьшаются с глубиной. В водах этих глубин его содержание имеет значения от 4,0×10-5 до 8,6×10-5 мл/л, превышая равновесное с атмосферой на 30-80%, а в зоне максимального фотосинтеза иногда в 2-5 раз выше, чем на поверхности. В открытых частях океанов и морей это превышение минимально. В Тихом океане среднее содержание метана составляет всего 0,42×10-4 мл/л. В окраинных и внутренних морях, в заливах и эстуариях концентрации метана могут превышать равновесные на 1-5 порядков величин. В частности, в шельфовых частях углеводородных газов в воде больше, чем во внутренних. Так в Мексиканском заливе метана в открытом море почти в 100 раз меньше, чем на шельфе. Аналогично ведут себя и гомологи метана, этан и пропан.
А.А. Геодекян и другие различают три типа распределения метана ниже приповерхностного максимума. В открытых морях и океане его содержание уменьшается с глубиной до самого дна. Так в Тихом океане на глубинах около 500 м их содержание почти в 10 раз меньше, чем в приповерхностных водах. Иначе ведет себя метан в морях с сероводородным заражением. В таких бассейнах его содержание с глубиной заметно, иногда на 2-3 порядка, увеличивается с глубиной. В Черном море содержание CH4 в поверхностных водах составляет около 7×10-4 мг/л, а на глубине 500 м достигает 0,1 мл/л. Наибольшие изменения концентраций CH4 связаны со слоем, отделяющим аэрированные воды от безкислородных на глубинах 200-980 м. Поток метана вверх оценивается равным 47 мл/м2 год. Наконец, в некоторых морях наблюдаются два максимума, в приповерхностном и придонном слоях воды. Придонный CH4 связан с его поступлением из осадков. Как правило, такие выходы имею место в шельфовой части океана. В частности на шельфе Мексиканского залива при глубинах 65-130 м обнаружена обширная площадь (протяженностью около 40 км) выходов газа. У поверхности дна отмечены повышенные концентрации CH4 (более 0,5×10-3 мл/л).
CH4 обнаружен и в гидротермальных выходах на дне океана. Это метан имеет изотопный состав от -5,0 до -1,5%. Предполагают, что большая часть его образуется при термокаталитическом разложении органического вещества осадков. Некоторая часть этого метана генетически связывается с мантией.
Об этом свидетельствует относительное постоянство отношения CH4 /3He. Международная группа исследователей, возглавляемая британским ученым Джулианом Пирсом, утверждает, что разгадала тайну Бермудского треугольника, где за период с 1945 года бесследно исчезло 20 кораблей и 16 самолетов. Пирс и его сотрудники видят причину этих исчезновений в периодических взрывах метана, гигантские количества которого сосредоточены в глубинах моря. Потоки метановой пены не только поглощают корабли, но и лишают прилегающие воздушные пространства способности нести нагрузку, в результате чего самолеты падают в море.
Общие свойства
Океаническая вода имеет самый большой объем и самое продолжительное время формирования. Ее состав формируется, как и в случае бессточных озер, в процессе некоторого баланса между поверхностным стоком и испарением влаги. В этом формировании активно участвуют географические, биологические и геологические факторы. Это участие вызывает изменение состава вод в толще океана, ее гидрохимическую зональность.
Величина pH в океанических водах определяется преимущественно карбонатным равновесием и с глубиной заметно снижается по мере увеличения содержания CO2. В целом морские воды имеют слабощелочную реакцию и характеризуются значениями pH от 8,0-8,4 у поверхности. Этому способствует фотосинтез. В фотической зоне океана под воздействием биологических процессов могут иметь место сезонные или даже суточные колебания величин pH. Кислородное дыхание вызывает резкое понижениее величины pH с глубиной, но потребление водородных ионов на растворение карбонатов и буферное влияние карбонатных солейстабилизируют величину pH в диапазоне 7,6-8,1 на больших глубинах. В полуизолированных морях диапазон значений pH заметно шире. В Балтийском море, например, значения pH варьируют от 7,0 до 8,6. На дне океана, в местах, где разгружаются высокотемпературные кислые гидротермальные воды, pH может иметь значения существенно ниже 7, вплоть до 3-5.
Величины окислительно-восстановительного потенциала закономерно уменьшаются с глубиной. Огромные массы океанической воды достаточно хорошо аэрированы и имеют Eh до +600 мВ (200-400 мВ). В отдельных участках богатых органическим веществом, где большая часть или весь кислород расходуется на окислительные процессы с глубиной значения окислительно - восстановительного потенциала уменьшаются и достигают в анаэробной зоне отрицательных величин. В Черном море значения Eh достигают -100 мВ и менее.
Дата добавления: 2015-05-16; просмотров: 4423;
