Основные сведения о строении вещества и физической природе электричества
ЭЛЕКТРИЧЕСКАЯ ЦЕПЬ И ЕЕ ОСНОВНЫЕ ЗАКОНЫ
Основные сведения о строении вещества и физической природе электричества
Электронной теорией строения атома вещества установлено, что все вещества, как простые, так и сложные, состоят из молекул, а молекулы из атомов.
Наименьшая частица вещества, которая сохраняет его свойства, называется молекулой. Молекула — это химическая комбинация двух или более атомов. Атом — это наименьшая частица элемента, которая сохраняет химические характеристики элемента. Химический элемент — составная часть вещества, построенная из одинаковых атомов.
Простые вещества — медь, алюминий, цинк, свинец и др. — состоят из одинаковых атомов данного вещества. Молекулы сложных веществ состоят из нескольких атомов различных химических элементов. Например, поваренная соль (хлористый натрий) состоит из атомов хлора и атомов натрия. Молекулы воды содержат атомы водорода и атомы кислорода.
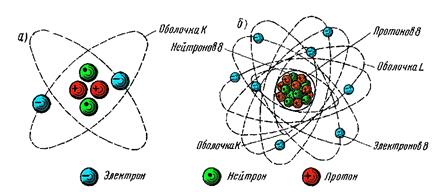
Атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны сгруппированы в центре атома и образуют ядро. Протоны заряжены положительно, нейтроны заряда не имеют. Электроны расположены и вращаются на оболочках на различных расстояниях от ядра.
Атомы различных элементов отличаются друг от друга. Поскольку существует свыше 100 различных элементов, то существует и свыше 100 различных атомов.
Самым простым атомом является атом водорода: он имеет только один электрон, расположенный на первой электронной оболочке. Атом гелия (рис. 2, а) имеет два электрона, расположенных на первой оболочке (К), атом кислорода (рис. 2, б) — два на первой и шесть на второй (всего восемь, расположенных на оболочках К и L).
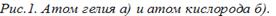
 Внешняя оболочка называется валентной и количество электронов, которое она содержит, называется валентностью. Чем дальше от ядра валентная оболочка, тем меньшие силы притяжения со стороны ядра испытывает каждый
Внешняя оболочка называется валентной и количество электронов, которое она содержит, называется валентностью. Чем дальше от ядра валентная оболочка, тем меньшие силы притяжения со стороны ядра испытывает каждый
валентный электрон.
Таким образом, потен-циальная возможность атома терять увеличивается. Именно валентными электронами определяется способность атомов данного элемента вступать в химические связи друг с другом и с атомами других элементов, а также электропроводность различных материалов.
Физическая природа электричества. Многие электрические явления объясняются на основе электронной теории строения атома. Согласно этой теории,
если электроны валентной оболочки получат достаточно энергии от внешних сил, то они могут покинуть атом и стать свободными электронами, произвольно перемещаясь от атома к атому.
В этом случае они перестают быть нейтральными. Атомы, потерявшие часть своих электронов, становятся положительно заряженными ионами. Атомы, получившие избыточные электроны, становятся отрицательно заряженными ионами.
Если в каком-либо теле накопятся электроны или ионы, то говорят, что в теле накопилось электричество. Такое тело становится электрически заряженным и приобретает электрические свойства. Эти свойства есть по сути дела проявление электрических сил, действующих между электронами и ядрами атомов.
Электрические заряды. Количество электричества, содержащееся в заряженном теле, называется электрическим зарядом. Заряды бывают двух знаков: положительные (обозначаются знаком « + ») и отрицательные (обозначаются знаком « — »).
В Международной системе единиц СИ электрические заряды, т. е. количество электричества, измеряют в Кулонах (Кл). Если по проводу прошло 6,29·1018 электронов, то говорят, что по проводу прошло количество электричества, равное 1 Кл.
При взаимодействии электрических зарядов (электрически заряженных тел) (рис. 2) между ними возникают электрические силы притяжения или отталкивания.
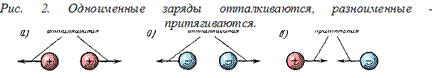 |
Дата добавления: 2015-05-16; просмотров: 1983;
