ЗЛКОНЫ ТЕРМОХИМИИ.
Энтальпия реакции представляет собой разность между суммой энтальпий образования продуктов реакции и суммой энтальпий образования реагентов с учетом стехиометрических количеств веществ:
DHр = S DH0 прод – S DH0 исх
Для некоторой реакции: аА + вВ ® сС + dD стандартная энтальпия реакции равна:
DHр = (cDH0(С)+ dDH0(D))- (aDH0(A) + bDH0 (B))
Раздел химии, который посвящен количественному определению тепловых эффектов химических реакций, называется термохимией.
Расчет тепловых эффектов реакций, в частности при p=const, основан на двух законах термохимии.
Первый закон термохимии (открытый в конце XVIII в. французскими учеными Лавуазье и Лапласом я называемый термохимическим законом Лавуазье — Лапласа. в современной формулировке гласит: при разложении соединения на простые вещества происходит изменение энтальпии, равное (но с противоположным знаком) изменению энтальпии при образовании этого соединения из тех же простых веществ.
Энтальпию образования определить экспериментально можно не для всех веществ из-за сложности проведения или практической неосуществимости многих реакций. Значения DH0 приведенные в таблице, для многих веществ получены расчетным способом, основанным на втором законе термохимии, открытом в 1840 г. русским химиком Г. И. Гессом (закон Гесса).
Второй закон термохимии в современной формулировке гласит: сумма энтальпий двух или более промежуточных реакций (стадий) при переходе от исходного состояния к конечному состоянию равна энтальпии реакции, которая непосредственно ведет от исходного к конечному состоянию.
Таким образом, энтальпия реакции зависит только от вида и состояния реагентов и продуктов, но не зависит от промежуточных состояний и пути перехода от реагентов к продуктам (вторая формулировка закона Гесса).
Закон Гесса позволяет связать энтальпийные эффекты процесса, который может протекать в одну или несколько стадий, и тем самым рассчитать энтальпию той реакции, которую трудно осуществить или довести до конца.
П р и м е р. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями:
I. 2С + О2 = 2СО; 2CO+O2 = 2CO2
II. С + О2 = СО2
Экспериментально определить энтальпию образования СО по первой реакции невозможно, так как идет вторая реакция — превращение СО в CO2. Однако можно экспериментально определить энтальпию реакции превращений СО в CO2, еcли получить (каким-либо другим способом) чистый СО, а затем перевести его в СО2 сжиганием в кислороде. Кроме того, легко находится b энтальпия полного сгорания графита (путь II), т. е. энтальпия образования СО2. Отсюда на основе закона Гесса легко рассчитать энтальпию перехода графита в СО, используя схему:
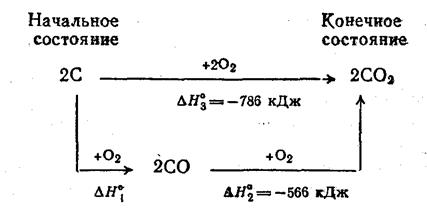
По аакону Гесса DH01+DH02=DH03, следовательно:
DH0(СО)= DH01/n(CO)= DH03/n - DH02/n= [(-786)-(-566)]/2=-110 кДж/моль
Дата добавления: 2015-05-13; просмотров: 1443;
