Генные мутации. Последствия мутаций. Методы выявления генных мутаций
Генные мутации выражаются в изменении структуры отдельных участков ДНК. По своим последствиям генные мутации делятся на две группы: мутации без сдвига рамки считывания и мутации со сдвигом рамки считывания.
Мутации без сдвига рамки считывания происходят в результате замены нуклеотидных пар, при этом общая длина ДНК не изменяется. В результате возможна замена аминокислот, однако из-за вырожденности генетического кода возможно и сохранение структуры белка.
Пример 1. Замена аминокислотного остатка в составе полипептида (миссенс–мутации). В состав молекулы гемоглобина человека входят две a-цепи (a-цепь закодирована в 16-ой хромосоме) и две b-цепи (b-цепь закодирована в 11-ой хромосоме). В состав b-цепи входит 146 аминокислотных остатков, при этом в нормальной b–цепи шестым аминокислотным остатком является глутаминовая кислота. С участием нормальной b-цепи образуется нормальный гемоглобин – HbA. В нетранскрибируемой нити участка ДНК, кодирующего b-цепь, глутаминовая кислота закодирована триплетом ГАА. Если же в результате мутации в ДНК произойдет замена триплета ГАА на триплет ГТА, то на месте глутаминовой кислоты в молекуле гемоглобина в соответствии с генетическим кодом появится валин. В итоге вместо гемоглобина HbA появится новый гемоглобин – HbS. Такая замена всего лишь одного нуклеотида и одной аминокислоты приводит к развитию тяжелого заболевания – серповидноклеточной анемии.
На клеточном уровне серповидноклеточная анемия проявляется в том, что при гипоксии (недостатке кислорода) эритроциты приобретают форму серпа и теряют способность к нормальному транспорту кислорода. Гомозиготы HbS/HbS умирают в раннем детстве. Зато гетерозиготы HbA/HbS характеризуются слабо измененными эритроцитами. При этом изменение формы эритроцитов значительно повышает устойчивость гетерозигот к малярии. Поэтому в тех регионах Земли, где свирепствует малярия (например, в Африке), отбор действовал в пользу гетерозигот. Таким образом, серповидноклеточная анемия – это пример относительности «полезности» и «вредности» мутаций.
Пример 2. Мутация без замены аминокислотного остатка в составе полипептида (сеймсенс-мутации). Если в нетранскрибируемой нити участка ДНК кодирующего b–цепь гемоглобина, произойдет замена триплета ГАА на триплет ГАГ, то из-за избыточности генетического кода замены глутаминовой кислоты не произойдет. В итоге структура b–цепи гемоглобина не изменится, и в эритроцитах будет обнаруживаться только нормальный гемоглобин HbA. Таким образом, вовсе не любая генная мутация проявляется в фенотипе.
Особую группу образуют ликовые мутации, в результате которых происходит незначительное изменение характеристик конечного продукта. Это связано с заменой аминокислотных остатков в пассивной части белка: такие замены не оказывают существенного влияния на структуру и функции белка.
Мутации со сдвигом рамки считывания (фреймшифты) происходят в результате вставки или потери нуклеотидных пар, при этом общая длина ДНК изменяется. В результате происходит полное изменение структуры белка.
Однако если после вставки пары нуклеотидов происходит потеря пары нуклеотидов (или наоборот), то аминокислотный состав белков может восстановиться. Тогда две мутации хотя бы частично компенсируют друг друга. Это явление называется внутригенной супрессией.
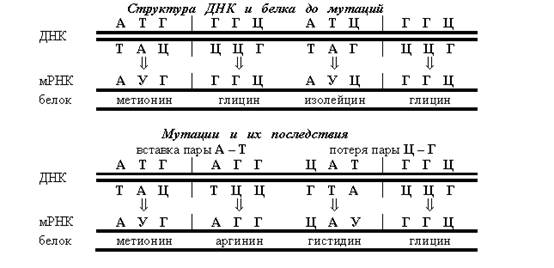
Мутации со сдвигом рамки считывания составляют ~ 80% от всех генных мутаций. Вставки иначе называются инсерциями, а потери – эксцизиями. Процесс образования вставок называется инсерционным мутагенезом. Инсерционный мутагенез необходимо учитывать в генной инженерии.
Нонсенс–мутации. Особую группу генных мутаций составляют нонсенс-мутации с появлением стоп-кодонов (замена смыслового кодона на стоп-кодон). Нонсенс-мутации могут возникать как вследствие замен нуклеотидных пар, так и с потерями или вставками. С появление стоп-кодонов синтез полипептида вообще обрывается. В результате могут возникать нуль-аллели, которым не соответствует ни один белок. Соответственно, возможно и обратное явление: замена нонсенс-кодона на смысловой кодон. Тогда длина полипептида может увеличиваться.
Дополнение 1. Существуют особые мутации, влияющие на экспрессию генов у эукариот
1. Мутации, изменяющие степень компактизации ДНК. В гигантских политенных хромосомах и в хромосомах типа ламповых щеток описаны мутации, инактивирующие ген, расположенный в каком-либо одном участке ДНК, т.е. блокирующие декомпактизацию хроматина. Скрещивание гетерозигот по таким регуляторным мутациям в F2 дает расщепление 3:1, указывая на то, что они затрагивают единичные менделирующие факторы.
2. Гомеозисные мутации. Изменяют порядок экспрессии генов. Фенотипический эффект гомеозисных мутаций заключается в превращении одних органов в другие. Например, у мушки дрозофилы мутация группы bithorax, контролирующих развитие грудных и брюшных сегментов у дрозофилы, может приводить к появлению крылоподобных образований вместо галтеров; мутации группы antennapedia выражаются в том, что у насекомых на месте антенн вырастают ножки; мутации ophthalmoptera – развитие крыла из имагинального диска глаза; мутации proboscipedia – развитие ноги или части антенны (в зависимости от температуры) вместо хоботка; у мутантов tumorous head ткани головы замещаются другими типами тканей, включая структуры, характерные для гениталий.
Дополнение 2. Некоторые мутации обладают плейотропным действием, т.е. приводят к изменению сразу нескольких признаков.
Пример 1. Ароматические аминокислоты – триптофан, фенилаланин, тирозин – образуются из хоризмовой кислоты. Если некоторая мутация заблокирует хотя бы один этап синтеза хоризмовой кислоты, то клетка (организм) утрачивает способность к синтезу сразу трех аминокислот.
Пример 2. Один и тот же фермент (трансаминаза) контролирует синтез валина (из α–кетоизовалериановой кислоты) и изолейцина (из α–кето–β–метилвалериановой кислоты). Если некоторая мутация нарушит функции этого фермента, то клетка (организм) утрачивает способность к синтезу сразу двух аминокислот.
Пример 3. Один и тот же полипептид (продукт экспрессии одного гена) может входить в состав разных ферментов. Например, белок-апофермент липоатдегидрогеназы кишечной палочки в качестве субъединицы входит в состав других ферментов: пируватдегидрогеназы, 2-оксоглутаратдегидрогеназы, глицинового расщепляющего комплекса. Тогда мутация в гене LDH скажется на активности всех перечисленных ферментов.
Дополнение 3. Мутация в одном гене может подавлять мутации, происходящие в других (неаллельных) генах. Это явление называется межгенной супрессией.
Дата добавления: 2015-05-13; просмотров: 2906;
