Портальная гипертензия
Портальная гипертензия – это значительное повышение давления (более 250 мм вод. ст.) в системе v. portae. Она возникает при нарушениях естественного оттока венозной крови от желудка, двенадцатиперстной кишки, желчных путей, поджелудочной железы, селезенки, тонкой и толстой кишки. По локализации препятствия оттоку крови из портальной системы выделяют подпеченочную, печеночную и надпеченочную формы портальной гипертензии (рис. 79).
Подпеченочная (предпеченочная) портальная гипертензия развивается при локализации препятствия в стволе воротной вены или ее крупных ветвях, встречается в 10 % портальной гипертензии.
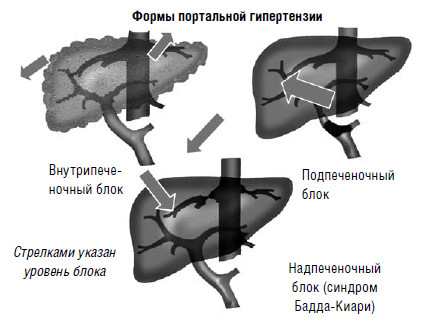
Рис. 79. Уровень нарушения портокавального кровотока и формы портальной гипертензии
Она может быть обусловлена аномалиями развития воротной вены либо ее тромбозом. Приобретенный тромбоз воротной вены может возникать как осложнение при острых заболеваниях брюшной полости (холецистит, аппендицит, панкреатит, холангит), либо при сдавлении извне сосудов портальной системы кистами, опухолями поджелудочной железы с развитием вторичного тромбоза, травмах живота, состоянии гиперкоагуляции. Внутрипеченочная портальная гипертензия возникает при нарушении портокавального перетока крови в печени. Наиболее частой причиной этой формы портальной гипертензии является цирроз печени. На долю внутрипеченочной формы приходится до 85 % всех случаев портальной гипертензии.
Надпеченочная (постпеченочная) портальная гипертензия формируется при нарушении оттока крови локализовано, на уровне печеночных или верхней полой вен. Она возникает при облитерирующем эндофлебите печеночных вен с последующим их тромбозом (болезнь Киари), вено‑окклюзионной болезни, некоторых заболеваниях сердца, сдавлении нижней полой вены опухолью на уровне или выше места впадения печеночных вен (синдром Бадда‑Киари). Надпеченочная форма составляет 5 % от всех случаев портальной гипертензии.
Как видно из классификации, подавляющее большинство случаев портальной гипертензии приходится на внутрипеченочную форму, как правило, связанную с циррозом печени.
Портальная гипертензия является пусковым моментом некоторых патологических процессов в организме, таких как: асцитический синдром, варикозное расширение вен пищевода, печеночная кома.
Рассмотрим механизмы развития этих осложнений при циррозе печени. Печень представляет из себя «клубок» сосудов, в котором портальная система через многочисленные капилляры анастомозирует с кавальной системой. Диаметр капилляров печени суммарно во много раз превышает диаметр самых крупных сосудов человеческого тела (рис. 80).
В норме через «сито» печеночных балок по синусоидным капиллярам легко обеспечивается переток всей портальной крови в нижнюю полую вену. При циррозе печени, по мере сдавления синусоидных капилляров узлами‑регенератами и соединительной тканью, вся портальная кровь не может протечь через печень. Приток крови к печени преобладает над ее оттоком. Повышается давление в системе v. portae. По мере прогрессирования цирроза печени увеличивается портальное давление. Кроме изменения циркуляции жидкости внутри печени, происходит нарушение тока портальной крови в сторону меньшего давления. Клинически эти расстройства проявляются асцитом и варикозным расширением вен пищевода.
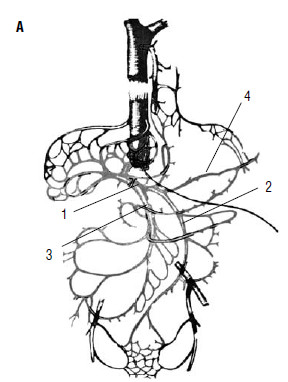
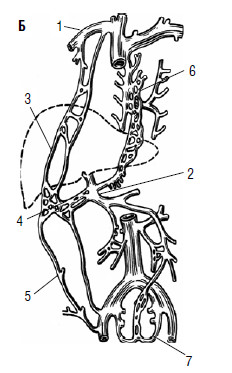
Рис. 80. Печень – это «клубок» портокавальных анастомозов А: 1 – v. portae; 2 – v. mesenterica interior; 3 – v. mesenterica superior; 4 –v. lienal.
Б: 1 – v. cava superior; 2 – v. portae; 3 – v. epigastrica superior; 4 – v. umbilicalis;
5 – v. epigastrica interior; 6 – vv. esofagii; 7 – vv. rectales
В патогенезе асцитического синдрома принимают участие многочисленные факторы, которые могут быть условно отнесены к местным (регионарным) и общим (системным). К регионарным факторам относят: синусоидальную гипертензию, повышенное лимфообразование, лимфатическую гипертензию. К системным факторам относят: гипоальбуминемию, активацию ренин‑ангиотензин‑альдостероновой системы, задержку натрия и воды. Синусоидальная гипертензия возникает при внутрипеченочной портальной гипертензии, вызывает повышенную транссудацию плазмы, богатой белком, в пресинусоидальное пространство Диссе, что приводит к значительному лимфообразованию в печени и увеличению числа отводящих внутрипеченочных лимфатических сосудов. Значительное увеличение истечения лимфы из грудного протока во внутреннюю яремную вену приводит к функциональной недостаточности терминального отдела грудного протока с развитием повышенного давления в лимфатической системе. Г ипоальбуминемия, возникающая вследствие нарушения белковосинтетической функции печени, приводит к снижению онкотического давления и повышению объема интерстициальной жидкости, что вызывает пропотевание жидкости в брюшную полость. Развитие варикозного расширения вен пищевода (равно как вен прямой кишки и передней брюшной стенки) является следствием портальной гипертензии и перестройки циркуляции венозной крови в спланхническом регионе. При этом часть воротной крови начинает оттекать по предсуществующим и малозначимым в норме внепеченочным портокавальным анастомозам (пищеводным, ректальным, передней брюшной стенки) (рис. 81).
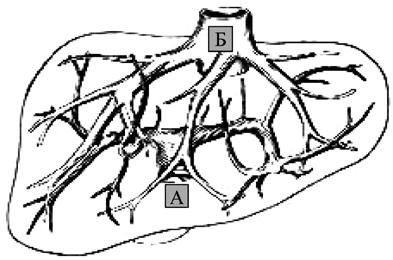
Рис. 81. Портокавальный переток в норме (А); при циррозе печени (Б). 1) печень; 2) пищеводные портокавальные анастомозы; 3) ректальные портокавальные анастомозы; 4) портокавальные анастомозы передней брюшной стенки.
Эти пути варикозно расширяются, принимая на себя значительную часть крови из воротной системы, компенсируя нарушение венозного кровотока в печени. Но даже при значительном расширении не наступает адекватной компенсации. Кроме того, печень, не получая достаточно крови, не выполняет свои синтетические и детоксикационные функции. Развивается гипопротеинемия, гипокоагуляция, гипоферментемия, что ограничивает обменные процессы в тканях. Продукты метаболизма и токсины, всосавшиеся в кишечнике минуя печень, где должны быть обезврежены, в неизмененном виде поступают в системный кровоток, вызывая аммиачную интоксикацию, энцефалопатию и кому. Таковы механизмы развития портальной гипертензии и ее осложнений – асцитического синдрома, варикозного расширения вен пищевода и печеночной недостаточности.
Клиника портальной гипертензии
Ранние проявления портальной гипертензии не имеют патогномоничных признаков и так же как ранние стадии цирроза печени, характеризуются неспецифическими симптомами: слабостью, дискомфортом и вздутием живота, тошнотой, снижением аппетита. При прогрессировании портальной гипертензии появляется асцит, расширение подкожных вен брюшной стенки («голова медузы»), расширение вен пищевода, кардиального отдела желудка, геморроидальных вен, гепато‑и спленомегалия.
С возникновением асцита больных начинает беспокоить дискомфорт, чувство тяжести в животе, увеличение живота. При большом, напряженном асците появляется одышка, особенно в горизонтальном положении, могут формироваться пупочные, паховые грыжи (рис. 82). Резистентный асцит при циррозе печени развивается в 60 % случаев, летальный исход в течение года– 50 %.
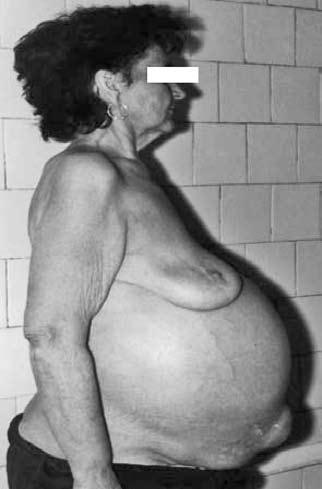
Рис. 82. Больная с напряженным асцитом
При истончении грыжевого мешка и кожного покрова над ним возможен разрыв пупочной грыжи с быстрым истечением асцитической жидкости. Из брюшной полости через плевроперитонеальные щели асцитическая жидкость может проникать в грудную полость с формированием гидроторакса. При инфицировании асцитической жидкости возникает асцит‑перитонит, являющийся опасным осложнением цирроза печени и ведущий к высокой летальности. При асцит‑перитоните необходима экстренная операция (ее можно выполнить и лапароскопически), заключающаяся в санации и дренировании брюшной полости. Грозным осложнением портальной гипертензии является кровотечение из варикозно расширенных вен пищевода и кардиального отдела желудка. При кровотечении возникает рвота или срыгивание неизмененной кровью, без предшествующих болевых ощущений. При затекании крови в желудок может возникать рвота «кофейной гущей», черный жидкий стул – мелена. У больных появляется бледность, тахикардия, снижение артериального давления. При тяжелой кровопотере возникает геморрагический шок, нередко заканчивающийся летальным исходом. Кровотечение может привести к прогрессированию печеночной недостаточности, даже если до этого была ее компенсация. Оно осложняет цирроз печени почти в половине случаев, летальность при этом достигает 60 % (рис. 83).
Печеночная недостаточность проявляется неспецифическими симптомами: расстройством психики в виде неадекватного поведения, дезориентации в пространстве и времени, патологической сонливости, печеночной комы, которая, как правило, является конечной и необратимой стадией заболевания.
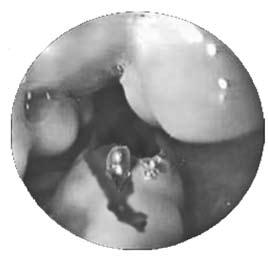
Рис. 83. Эндоскопическая картина при варикозном расширении вен пищевода с признаками кровотечения
Как начальные стадии цирроза печени, так и первые симптомы портальной гипертензии могут не иметь отчетливых признаков. Клинически больные часто практически не предъявляют никаких жалоб и продолжают выполнять привычную работу. На неблагополучие могут указывать незначительные боли после злоупотребления алкоголем и приема острой пищи, чувство тяжести в правом подреберье. Такое скрытое течение заболевания продолжается годами, в течение которых происходит увеличение печени, появление жидкости в животе, венозного рисунка на передней брюшной стенке. Нередко больные обращаются за врачебной помощью уже на этапе декомпенсации цирроза печени при наличии желтухи, асцита или кровотечения из варикозных вен пищевода. При их осмотре выявляют желтушность кожных покровов, напряженный асцит, при кровотечении – бледность кожных покровов, рвоту кровью, черный, дегтеобразный стул (мелену). Иногда эти признаки выявляют одновременно, что является крайне неблагоприятным прогностическим признаком. Для подтверждения диагноза и определения стадии заболевания необходимо проведение лабораторных и инструментальных методов диагностики. Лабораторная и инструментальная диагностика
Из лабораторных данных наиболее информативными являются: уменьшение эритроцитов и гемоглобина в периферической крови, выявляют повышение уровней билирубина, трансаминаз и щелочной фосфатазы в плазме крови, уменьшение содержания альбумина и факторов свертывания крови (в первую очередь протромбина).
Из инструментальных методов диагностики применяют те же, которые используют для диагностики цирроза печени (ультразвуковое исследование, допплерографию воротной вены, фиброгастродуоденоскопию, лапароскопию, биопсию печени).
Кроме того, для оценки уровня препятствия в воротной вене и выраженности портальной гипертензии применяют рентгеноконтрастные методы диагностики, такие как спленопортографию, трансумбиликальную портографию, чрескожную чреспеченочную портографию, целиакографию. Для выполнения спленопортографии пунктируют селезенку, измеряют давление в ее паренхиме и вводят контрастное вещество, которое заполняет селезеночную и воротную вены. Недостатком метода является высокая частота осложнений, связанных с кровотечением в брюшную полость из места пункции селезенки (до 20 %).
Менее опасным методом является катетеризация пупочной вены (трансумбиликальная портография). Однако для его осуществления необходима небольшая операция по созданию доступа к круглой связке печени, бужированию и катетеризации пупочной вены.
Чрескожная чреспеченочная портография позволяет четко визуализировать все основные притоки воротной вены. Также при этом можно выполнить эмболизацию варикозных вен желудка и пищевода. Недостатком метода, так же как при пункции селезенки, является высокая частота осложнений.
В течение последних лет применяют артериальную портографию (т. н. возвратная портография при выполнении целиакографии). При этом контрастное вещество вводят в чревную артерию. В настоящее время это менее инвазивное исследование почти полностью вытеснило прямые пункционные методы контрастирования сосудов портальной системы печени. Повышение диагностических возможностей метода связано с контрастированием как артериальной, так и венозной систем.
Лечение
Как правило, консервативное лечение портальной гипертензии применяют при относительно компенсированных формах цирроза печени. Оно направлено на создание условий для пролонгирования периода компенсации и замедления морфологической и функциональной дегенерации печени. С этой целью назначают глюкокортикоидные гормоны, гепатопротекторы, препараты, улучшающие микро– и макроциркуляцию крови, щадящий режим питания и диету. Больным с преобладанием асцитического синдрома рекомендуют ограничение приема жидкости, назначают мочегонные, сосудорасширяющие средства, вещества, улучшающие сердечную деятельность и реологические свойства крови.
Больным с варикозным расширением вен пищевода рекомендуют питание в виде протертых супов, жидких каш, паровых котлет в надежде на менее травматичное прохождение пищевого комка по пищеводу (пища должна быть слегка теплой). Из лекарственных препаратов назначаются (3‑блокаторы, гипоацидные вещества, обволакивающие средства. Напряженный или резистентный к консервативному лечению асцит, а также рецидивирующие кровотечения из варикозных вен пищевода являются показанием для хирургического лечения.
Хирургическое лечение асцита
Прогрессирование цирроза делает борьбу с асцитом все более сложной задачей. Наступает период, когда асцит становится резистентным к медикаментозному лечению. Накопление жидкости в брюшной полости ограничивает подвижность диафрагмы и вызывает нарушение функции внешнего дыхания. Больных беспокоит постоянная одышка, ощущение нехватки воздуха, они не могут спать и находиться в горизонтальном положении. Такое состояние требует срочной эвакуации асцитической жидкости путем лапароцентеза. При этом удаляется до 8‑10 литров транссудата. Нарушение функции дыхания устраняется, больные чувствуют значительное облегчение. Однако через 2–3 недели жидкость в брюшной полости накапливается вновь в том же количестве. Приходится производить повторную пункцию брюшной полости и эвакуацию асцита. Иногда в таких случаях в животе оставляют дренаж для постоянного удаления асцитической жидкости, но он быстро осумковывается и перестает выполнять свою функцию. Частые эвакуации асцитической жидкости нежелательны, так как эта жидкость содержит большое количество белка, потеря которого приводит к усугублению гипопротеинемии и ухудшению состояния больного. Поэтому повторное появление напряженного асцита нужно постараться предотвратить консервативными мероприятиями (мочегонные средства, гепатопротекторы и т. д.).
Хирургическая коррекция асцита у больных циррозом печени – задача сложная. Как правило, эти пациенты имеют множественные расстройства функционирования жизненно важных органов и систем. Операционно‑анестезиологический риск при этом является крайне высоким. Хирургическими пособиями, облегчающими и продлевающими жизнь таких больных, являются перитонеовенозное шунтирование, лимфовенозные анастомозы. Поскольку асцитическая жидкость по своим химико‑физическим свойствам близка к плазме крови, разработана система по ее фильтрации и возврату в сосудистое русло (рис. 84). Операция лимфовенозного соустья устраняет застой лимфы и направлена на предотвращение проникновения жидкости в брюшную полость.
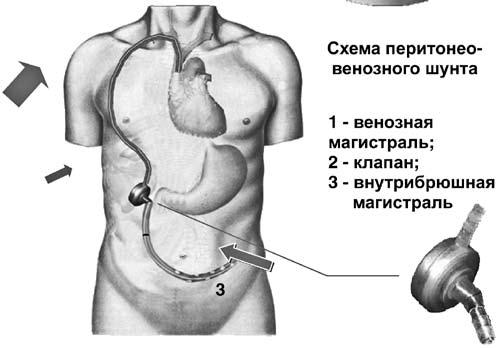
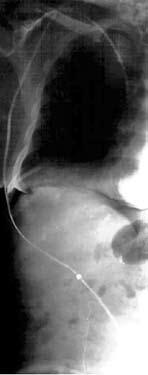
Рис. 84. Схема и рентгенограмма перитонеовенозного шунта при асците
К сожалению, эти методы нерадикальные, временные и часто малоэффективные. Радикальным может быть только пересадка печени. Однако эта операция возможна (при наличии центра, выполняющего такие операции), если: 1) больной может перенести большой объем хирургического вмешательства; 2) имеется соответствующий донор печени (поиск и подбор донорской печени – большая проблема трансплантологии). Хирургическое лечение портальной гипертензии и кровотечений из варикозных вен пищевода
Задачи хирурга: 1) уточнить источник кровотечения; 2) остановить кровотечение; 3) осуществить профилактику повторного кровотечения.
Уточнение источника кровотечения необходимо для целенаправленного применения возможных методов гемостаза. Известно, что при циррозе печени кровотечение может быть обусловлено: варикозно расширенными венами пищевода – 83 %, варикозно расширенными венами желудка – 10 %, синдромом Мэллори‑Вейса – 4 %, язвой двенадцатиперстной кишки – 3 % наблюдений.
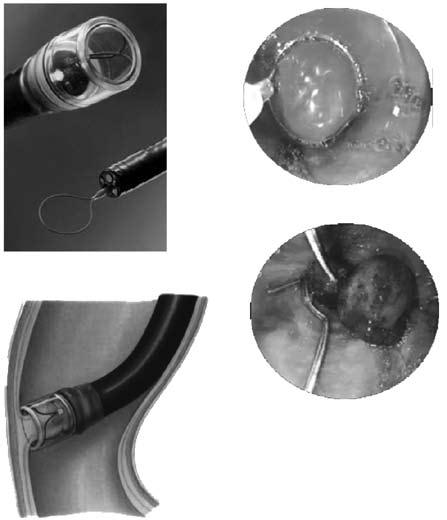
Рис. 85. Эндоскопическое лигирование варикозных вен пищевода
Для каждого вида кровотечения применяют свой метод гемостаза. Важно выбрать адекватный способ, поскольку второй попытки остановки кровотечения может и не представиться. Для определения источника кровотечения используют срочную фиброэзофаго‑гастродуоденоскопию (ФЭГДС), во время которой подтверждают диагноз варикозного расширения вен пищевода, определяют зону нарушения целостности вены и интенсивность кровотечения. При умеренном кровотечении из варикозных вен пищевода, синдроме Мэллори‑Вейса или язвы двенадцатиперстной кишки сразу может быть предпринята попытка его эндоскопической остановки. Наиболее эффективным методом остановки кровотечения из варикозных вен пищевода является их эндоскопическое лигирование. При этом эффективность метода достигает 90 %, а количество рецидивов составляет примерно 10 % (рис. 85). 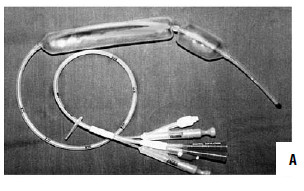
Рис. 86. Зонд Блэйкмора. А – общий вид; Б – схема постановки
При интенсивном кровотечении, когда невозможно найти участок с нарушенной стенкой вены, при тяжелом состоянии больного показана постановка зонда Блэйкмора (с его установки и следует начинать лечение в большинстве случаев, так как эндоскопический гемостаз пока возможен не во всех учреждениях, да и в ночное время может не быть нужного специалиста и соответствующего технического обеспечения, а, кроме того, эндоскопический гемостаз на высоте кровотечения может быть технически невыполним, так как кровь будет заливать оптику). Эффективность метода достигает 85 %, а количество рецидивов – 50 % (рис. 86). Баллонная тампонада зоны кровотечения позволяет временно его остановить, после этого проводится гемостатическая терапия и восполняется кровопотеря. Через сутки давление в баллонах снижают. При остановке кровотечения могут быть предприняты попытки эндоскопической профилактики кровотечения путем паравазальной склеротерапии (при этом эффективность метода составляет около 90 %, а рецидивы кровотечения возникают почти в 30 % случаев) или эндоскопического лигирования вен пищевода (рис. 85; рис. 87).
При возобновлении кровотечения баллонная тампонада может быть продолжена или поставлен вопрос о хирургическом гемостазе. В качестве хирургического вмешательства применяют: открытую перевязку варикозных вен пищевода, операцию Таннера‑Топчибашева – внутрибрюшинное поперечное пересечение желудка в верхней трети с лигированием сосудов и последующим восстановлением его целостности или более простой вариант этой операции с использованием кругового аппаратного шва пищевода в нижней трети (рис. 88). В настоящее время чаще применяют операцию М. Д. Пациоры – гастротомию и прошивание варикозных вен внутрибрюшного отдела пищевода и дна желудка со стороны желудка.
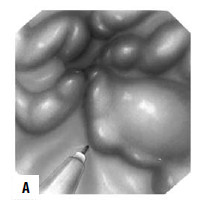
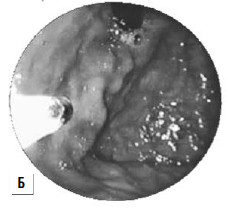
Рис 87. Паравазальное склерозирование. А) момент операции; Б) результат операции
С целью профилактики повторных кровотечений применяют операции, направленные на снижение давления в воротной вене с помощью различных портокавальных анастомозов. Смысл их состоит в создании новых путей оттока крови из системы воротной вены с помощью формирования: 1) прямого портокавального анастомоза, 2) мезентерикокавального анастомоза, 3) спленоренального анастомоза (проксимального или дистального) (рис. 89).
Создание прямых портокавальных анастомозов приводит к быстрому снижению портального давления вследствие сброса крови в систему нижней полой вены. Важно выбрать оптимальный диаметр анастомоза. Большой диаметр (более 10 мм) приводит к ухудшению функции печени, за счет уменьшения ее кровоснабжения, и развитию тяжелой энцефалопатии вследствие гипераммониемии (выпадает детоксикационная функция печени). В последние годы в мировой практике получили распространение портокавальные анастомозы с диаметром искусственного венозного протеза 6, 8 и 10 мм, при которых происходит частичный сброс портальной крови в систему нижней полой вены и указанные осложнения не развиваются. Проксимальный спленоренальный анастомоз требует удаления селезенки, что в условиях обилия венозных анастомозов может быть довольно тяжелой операцией и сопровождаться значительной кровопотерей.
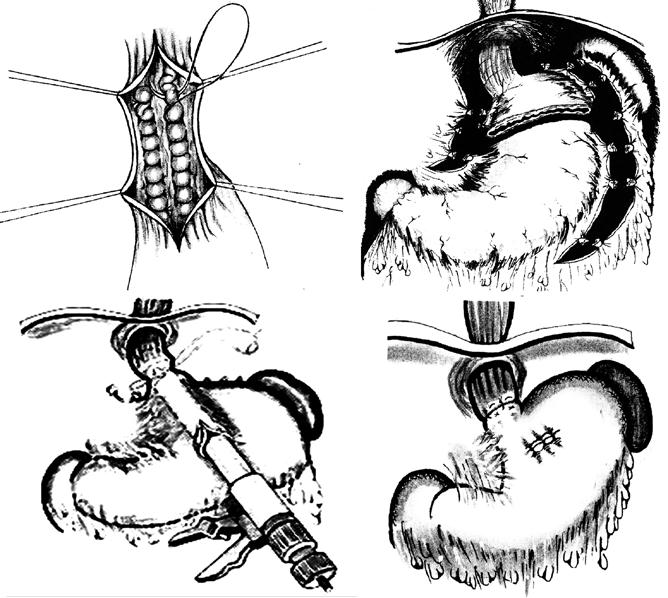
Рис. 88. Варианты хирургических операций при кровотечении из варикозных вен пищевода: А) транссекция пищевода с перевязкой вен; Б) операция Таннера‑Топчибашева; В1, В2 – ее вариант с использованием сшивающего аппарата
Дистальный спленоренальный анастомоз позволяет сохранить селезенку и не так резко снижает портальное давление, поскольку при этом кровь от воротной вены оттекает через сеть анастомозов и паренхиму селезенки. Такие хирургические вмешательства возможны при отсутствии симптомов печеночной недостаточности, грубых нарушений функционального состояния других органов. При функциональной ограниченности жизненно важных органов и систем целесообразно выполнить декомпрессию портальной системы с помощью чрезъяремного внутрипеченочного порто системного шунтирования (TIPS) (рис. 90). Операция осуществляется по следующей технологии: катетеризируют яремную вену, затем катетер проводят в верхнюю полую и потом в одну из печеночных вен. Далее катетер через ткань печени (перфорируя ее) проводят в одну из портальных вен. Баллонным катетером канал в печени между кавальной и портальной системами расширяют до 6–8 мм и стентируют специальным каркасомстентом. 
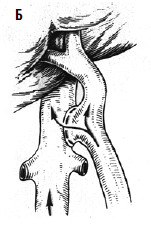
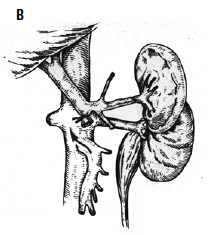
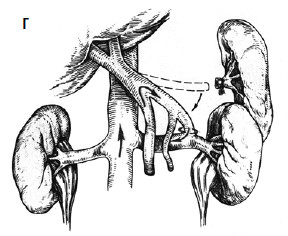
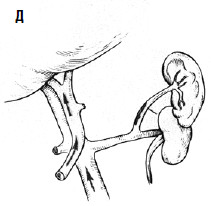
Рис. 89. Варианты искусственных портокавальных анастомозов: А – проксимальный спленоренальный; Б – дистальный спленоренальный;
В – мезентерикокавальный Н‑анастомоз; Г – способ формирования аутовенозного протеза большого диаметра
Все эти методы лечения, к сожалению, паллиативные и направлены на устранение ведущего осложнения заболевания – кровотечения из варикозных вен пищевода. Поскольку это лечение симптоматическое, то заболевание постепенно прогрессирует и заканчивается печеночной недостаточностью и смертью больного. Единственным методом радикального лечения заболевания является пересадка печени (рис. 91). В настоящее время разработаны несколько вариантов этой сложной операции и достигнуты положительные результаты. Хирургическая часть данной проблемы, можно сказать, решена.
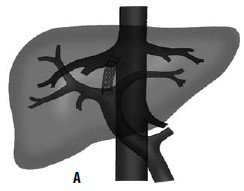
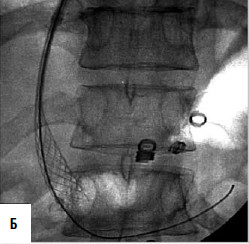
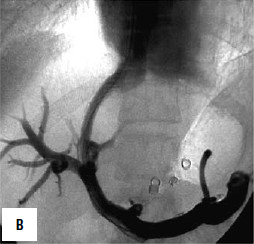
Рис. 90. Операция чрезъяремного внутрипеченочного портосистемного шунтирования (TIPS): А – схема операции; Б – этап постановки стента; В – контроль проходимости стента
Трудности заключаются в более раннем определении показаний для трансплантации печени, пока в организме не развились необратимые расстройства других органов и систем. Другая важная задача – получение донорской печени. Эта задача может быть решена только при разработке программы органного донорства. 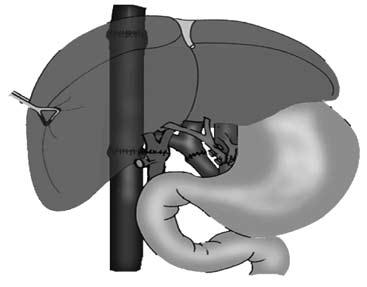
Рис. 91. Принципиальная схема ортотопической трансплантации печени
Таким образом, цирроз печени является исходом многих воспалительных и метаболических процессов в этом органе. Прогрессирование заболевания может быть медленным или весьма стремительным. На этапе выраженных морфологических и функциональных нарушений развивается портальная гипертензия, проявляющаяся асцитическим синдромом и кровотечениями из варикозных вен пищевода. Такие больные становятся инвалидами и нередко, после развития грозных осложнений, многие из них умирают. Консервативные методы лечения на этом этапе являются неэффективными. В настоящее время разработаны многочисленные способы хирургических вмешательств. Большинство из них, как уже указывалось, имеют паллиативный характер. Развитие трансплантологии органов и тканей дало надежду на разработку радикального метода лечения многих тяжелых заболеваний с необратимыми изменениями в органах. Биологические, хирургические и этически‑правовые аспекты этой проблемы во многом решены. Необходимо дальнейшее развитие решение проблем тканевого и органного донорства.
Дата добавления: 2015-05-13; просмотров: 2146;
