Гибриды животных
Изучение гибридов в биологии развития обычно состоит в обнаружении проявления отцовских признаков на различных стадиях развития. При выборе скрещиваемых пар исследователь сталкивается с противоречием: чем ближе скрещиваемые особи, тем лучше развивается гибрид, но тем труднее обнаружить различия между материнским и отцовским видами, особенно в раннем развитии. Действительно, различия между близкими видами обычно затрагивают лишь детали строения, которые проявляются на поздних стадиях развития.
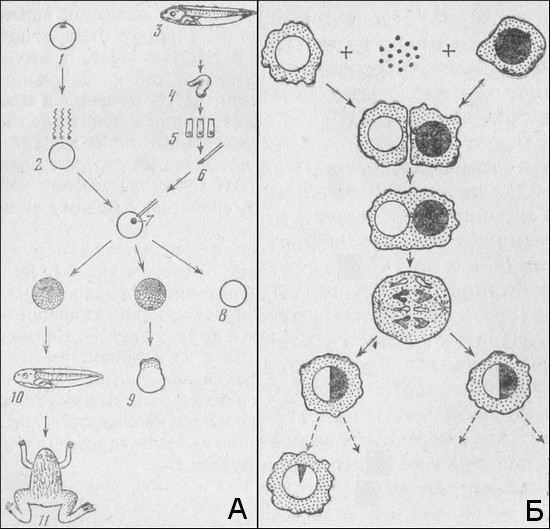
Несовместимость при скрещивании близких и более далеких видов сама по себе может быть предметом изучения, так как позволяет понять многие важные особенности процессов развития. На пути развития гибридов существует несколько препятствий, или порогов. Первый из них: невозможность оплодотворения из‑за несовместимых свойств поверхности яйца и сперматозоидов. Это препятствие мешает скрещиванию многих, даже близких, видов амфибий. Его, однако, иногда удается обойти, если зрелые ооциты одного вида поместить в полость тела лягушки другого вида. Такие ооциты проходят через яйцевод, окружаются чужими наружными оболочками и после этого становятся доступными для оплодотворения. Вместе с тем, например у рыб, оплодотворение часто удается не только между близкими видами, но и между видами из разных родов и даже отрядов и не требует специальных ухищрений.
Если оплодотворение осуществилось и хромосомы обоих видов оказались в одном ядре, их последующая судьба может быть различной. При отдаленном скрещивании часто происходит элиминация (потеря) всех или некоторых чужеродных отцовских хромосом. Механизмы элиминации до конца неизвестны, но элиминируются в первую очередь хромосомы, которые сильнее отличаются по размеру от хромосом материнского вида. Элиминация, как предполагают, происходит из‑за того, что нити веретена «не умеют» растаскивать в митозе чужие хромосомы, или из‑за того, что репликация отцовских хромосом происходит в иное время, чем синтез ДНК в материнских хромосомах. В результате элиминации зародыш по многим хромосомам, а значит, и генам оказывается гаплоидным. Поэтому развитие таких зародышей нарушается, а отцовские признаки не проявляются.
О других препятствиях для гибридизации мы можем только догадываться. Вероятно, одним из них является отсутствие «общего языка» между отцовскими генами и активирующими сигналами материнской цитоплазмы. Из‑за этого отцовские гены вообще не активируются или активируются не те, которые нужны. Однако, как мы уже рассказывали выше (гл. 6), у андрогенетических гаплоидных гибридов рыб (материнское ядро убито и в ядрах находится лишь один набор отцовских чужеродных хромосом) гибель разных гибридов происходит в разные сроки. Это указывает на какое‑то участие ядер в процессе развития и скорее согласуется с тем, что в отцовских хромосомах активируются «неправильные» гены.
Другой порог гибридизации может состоять в том, что чужеродные белки, которые синтезируются под контролем отцовских генов, в лучшем случае не способны обеспечить осуществление процессов развития, а в худшем – нарушают нормальный и сбалансированный ход метаболизма, что приводит к остановке развития и гибели зародьшей. Этим можно объяснить то, что в обычных диплоидных гибридах самок вьюна с самцами из другого отряда, т. е. в присутствии собственных хромосом, развитие ранних стадий протекает относительно нормально, но позже нарушается и в конце концов завершается гибелью всех зародышей или ранних личинок. Развитие же андрогенетических гибридных гаплоидов, лишенных материнских хромосом, обычно останавливается на стадии бластулы.
Наконец, последним порогом гибридизации может быть полноценное участие геномов обоих родителей, в результате чего создаются организмы с «промежуточными» признаками, не способные к жизни. Об этом говорят многочисленные опыты, когда кусочки тканей гибрида, пересаженные на один из родительских организмов, жили нормально, в то время как целые гибридные организмы погибали.
Интересной особенностью многих гибридных комбинаций является различная судьба реципрокных гибридов, когда, например, курица скрещивается с перепелом и перепелка – с петухом. В то время как в первом варианте выводятся жизнеспособные птенцы, во втором они погибают в яйце. Различна судьба у реципрокных гибридов ручьевой и озерной форели. В некоторых случаях было показано, что появление определенных признаков (например, пигментация глаз) у реципрокных гибридов происходит на разных стадиях. Все эти случаи можно объяснить, если предположить, что гены одного вида чувствительны к регуляторным белкам другого вида, а гены второго вида плохо воспринимают регуляцию со стороны первого вида.
Выше мы уже подробно рассматривали, как в биологии развития гибриды используются для установления времени начала работы генов. Возможности, которые они открывают для других исследований, еще далеко не исчерпаны. Дело тут, очевидно, в том, что при гибридизации взаимоотношения между двумя видами происходят одновременно на многих этажах: между хромосомами и генами двух видов, между генами одного вида и цитоплазмой другого, между белками двух видов и т. д. Разобраться в этом обычно не просто. Поэтому метод гибридизации, так много давший для генетики, гораздо меньше мог пока дать для решения проблем биологии развития.
Трансплантация ядер и гибриды соматических клеток
Изучение половых гибридов животных ограничено тем, что в цитоплазму яйца попадают ядра только в одном состоянии – ядра сперматозоида и что это обычно ядра достаточно близких видов. Новые возможности для исследования ядерно‑цитоплазматических взаимоотношений открыли опыты по инъекции в цитоплазму ооцитов или зрелых яиц амфибий ядер различного происхождения. В этих опытах экспериментатор имеет в своем распоряжении два вида цитоплазмы: из ооцитов, в которых происходит активный синтез РНК, но не ДНК, и из активированных яиц, в которых синтеза РНК нет, но активно синтезируется ДНК. Ядра могут быть изолированы на различных стадиях развития и из разнообразных тканей: от бластулы, когда идет активный синтез ДНК и еще нет синтеза РНК, и до нервных клеток, где синтеза ДНК уже нет.
Трансплантации такого рода показали полную зависимость поведения ядер от цитоплазмы: в ооцитах синтез ДНК во всех трансплантированных ядрах быстро прекращался и начинался синтез РНК. Наоборот, в ядрах, помещенных в цитоплазму зрелых яиц, прекращался синтез РНК и начиналась репликация ДНК. Изменялся и состав синтезируемых РНК: при пересадке в ооцит ядер из взрослых тканей другого вида амфибий прекращался синтез тех РНК, которые транскрибировались до трансплантации, и начинался синтез мРНК (и соответственно белков) ооцита, но РНК и белков, свойственных тому виду, чьи ядра были использованы.
Иной подход был использован при получении гибридов соматических клеток в условиях культуры тканей. Если в один сосуд для культуры тканей поместить два вида клеток и добавить туда же агент, обратимо повреждающий их оболочки, часть клеток сольется друг с другом. Слияние клеток происходит случайно, но с достаточной частотой сливаются две (или больше) различные клетки, в результате чего образуется клетка с разными ядрами – гетерокарион. В таких гетерокарионах можно наблюдать взаимоотношения разных ядер и влияние веществ из цитоплазмы одного типа клеток на ядра другого типа.
Гетерокарионы часто вступают в митоз одновременно, хромосомы при этом смешиваются и после деления образуются две одноядерные клетки (синкарионы), содержащие хромосомы обоих типов клеток. Такие клетки продолжают делиться и дают начало клонам соматических гибридов. Если для гибридизации использованы клетки разных видов животных, то обычно в ходе последующих делений часть хромосом постепенно утрачивается (элиминируется, как у отдаленных половых гибридов) и возникают клоны клеток, содержащие весь хромосомный набор одного вида и лишь несколько или даже одну хромосому другого вида. Это дает возможность исследовать функцию генов одной или немногих хромосом.
Для того чтобы выяснить, чем регулируется в клетке синтез ДНК, были получены гетерокарионы из двух клеточных линий, отличающихся по длине предсинтетического периода – G1 и периода синтеза ДНК – S. Оказалось, что в гетерокарионе синтез ДНК начинается одновременно в обоих ядрах, подчиняясь тому ядру, которое вступило в S ‑период раньше. Это означает, что в цитоплазме клеток в конце G1 ‑периода появляется некое вещество, стимулирующее начало репликации. Однако продолжительность S ‑периода в каждом из ядер гетерокариона осталась прежней, свойственной каждой исходной линии, – этот признак, следовательно, зависит от каких‑то особенностей структуры хромосом, а не от цитоплазмы.
При слиянии интерфазной и делящейся клеток в интерфазном ядре начинается преждевременная конденсация хромосом и разрушение ядерной мембраны аналогично тому, что происходит в начале митоза. В этом случае очевидно, что перед началом деления клетки в ней появляются особые факторы (белки), вызывающие спирализацию (конденсацию) хромосом и растворение ядерной мембраны.
Хариссом были получены гетерокарионы между крупными опухолевыми клетками человека линии HeLa и куриными эритроцитами, мелкие ядра которых неактивны. Попадая в окружение цитоплазмы активных клеток, эти ядра разбухают, в них входят ядерные белки человека и начинается синтез различных ГНК. В результате в таком гетерокарионе синтезируются куриные ферменты и белки мембран. В конце концов в этих ядрах начинается синтез ДНК, происходит митоз и образование одноядерных клеток, при делении которых хромосомы кур быстро утрачиваются. На этом примере видно, что при слиянии клеток с активными и неактивными ядрами происходит стимуляция синтезов РНК и ДНК в неактивном ядре, а не подавление этих процессов в активном. Отсюда следует важный вывод о том, что регуляция синтеза нуклеиновых кислот обычно осуществляется позитивно, т. е. с помощью активирующих, а не подавляющих веществ. Дальше мы увидим, однако, что это не общее правило.
При гибридизации клеток человека и хомячка или человека и мыши и длительном перевивании гибридов происходит элиминация хромосом человека, так что в итоге остаются одна – три человеческие хромосомы. Как и у многих отдаленных половых гибридов, это происходит, по‑видимому, из‑за некоторого несоответствия между нитями веретена и хромосомами или из‑за нарушения репликации. Так как процесс элиминации в значительной степени происходит случайно, то возникают синкарионы с различными хромосомами человека, оставшимися в ядре. Это позволяет, используя селективные среды с теми или иными предшественниками биологически важных молекул и ингибиторами, блокирующими пути их синтеза, создавать искусственные условия для размножения только тех клеток, в которых сохранилась не любая, а определенная хромосома человека (их можно отличить друг от друга по размерам, форме и характеру окрашивания). А далее можно выяснить, какие белки человека синтезируются в гибридных клетках, и тем самым определить, какие гены находятся в каких хромосомах, т. е. картировать геном человека.
Может быть, наиболее интересная проблема, которую позволяют изучать соматические гибриды, – это механизмы включения и выключения генов. Однако до сих пор, несмотря на большие усилия, в этом направлении получены лишь отдельные результаты. Так, оказалось, что часто гибридные клетки – синкарионы, пройдя через много клеточных делений, сохраняют активность тех генов, которые были активны в родительских клетках перед гибридизацией. В гибридах клеток, например, крысы и мыши или даже человека и мыши продолжается синтез многих ферментов обоих видов. Ho в других случаях в гибридах работа одного из активных ранее генов подавляется. Так, например, клетки мышиной опухоли меланомы синтезируют черный пигмент – меланин, а другой вид клеток (L‑клетки) его не синтезирует. При гибридизации этих клеток синтез меланина прекращается, хотя в синкарионе сохраняются хромосомы обоих типов клеток.
Клетки печени в ответ на действие стероидных гормонов резко увеличивают активность одного из ферментов – тирозинаминотрансферазы (ТАТ). При гибридизации печеночных клеток крысы с фибробластами человека способность к такой стимуляции гормоном утрачивается. Однако после ряда делений эти гибриды теряют Х‑хромосому человека, и сразу после этого способность гибридных клеток реагировать активацией TAT на действие гормона восстанавливается. Этот опыт позволяет сделать два важных заключения. Во‑первых, одни гены могут подавлять активность других генов. В данном случае даже известно, что этот подавляющий ген находится в Х‑хромосоме. А во‑вторых, оказывается, что стабильная способность к стимуляции гормоном, свойственная клеткам печени, может сохраняться как бы в «скрытом» виде, никак не проявляясь в течение многих клеточных поколений. Ho как только исчезает (с Х‑хромосомой человека) подавляющий ее ген, она восстанавливается снова. Подробнее вопрос о механизмах сохранения дифференцировки в ряду клеточных поколений, т. е. об эпигенетической наследственности, мы обсудим в одной из последующих глав.
В некоторых случаях гибридизация приводит к активации генов. Об общей активации генной активности в ядрах куриных эритроцитов после их гибридизации мы уже говорили. Ho вот еще один пример. Клетки печени (и опухоли печени – гепатомы) синтезируют сывороточный альбумин. При гибридизации клеток гепатомы крысы с различными непеченочными клетками мыши или человека (фибробласты, лейкоциты и др.) у гибридов начинается синтез сывороточного альбумина, и не только крысы, но и соответственно мыши или человека. Очевидно, тот фактор, который активирует ген альбумина в печени крысы, действует и на соответствующие гены мыши и человека.
Техника гибридизации соматических клеток в последние годы дополнилась также новыми методами, позволяющими комбинировать ядра и цитоплазму из различных клеток и создавать различные варианты «реконструированных» клеток. Все эти методы получили название «клеточной инженерии». Однако они не привели пока еще к принципиальным открытиям, позволяющим понять механизмы включения генов и дифференцировки.
Дата добавления: 2015-05-08; просмотров: 1331;
