Коррозионная стойкость сталей и сплавов
Коррозия –это термин, используемый для обозначения широкого класса видов нежелательного повреждения металла в результате его химического или электрохимического взаимодействия с окружающей средой.
Под повреждением понимается образование различных коррозионных дефектов (каверн, язв, питтингов, трещин), утонение толщины стенок, деградация свойств и строения (изменение структуры связано в основном с субструктурой матрицы металла) материала несущих элементов конструкции в процессе эксплуатации, ведущее к потере или снижению её работоспособности. Коррозия многообразна в своём проявлении и ведёт в конечном итоге к разрушению материалов (в первую очередь за счёт локальных видов коррозии) и выходу оборудования из строя.
Коррозия является самопроизвольным процессом, вызванным термодинамической неустойчивостью металлов, т. е. стремлением к уменьшению свободной энергии в различных средах при данных внешних условиях.
Определить возможность протекания коррозии, как химического или электрохимического процесса, можно по изменению энергии Гиббса (свободной энергии):
–ΔG = z·F·E, (12.1)
где F – число Фарадея; Е – разность потенциалов φK и φA, характеризующих катодную и анодную реакции, которые определяются уравнениями Нернста:
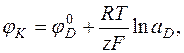
 , (12.2)
, (12.2)
где 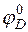 и
и 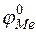 – величины стандартных электродных потенциалов деполяризатора (катода) и металла (анода) соответственно;
– величины стандартных электродных потенциалов деполяризатора (катода) и металла (анода) соответственно; 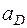 и
и 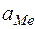 – активность соответствующих ионов на катоде и аноде.
– активность соответствующих ионов на катоде и аноде.
Величины стандартных электродных потенциалов различных металлов позволяют приближенно судить о термодинамической нестабильности металлов: чем более электроотрицателен потенциал металла, тем он активнее отдает свои электроны.
Если рассмотреть типичную реакцию окисления для металлов
2Ме + z2O2 +zН2O → Ме(OН)2,
то ΔG (для стандартных условий) для реакций превращения в гидроксиды Мg, Cu, Аu составит, соответственно, – 598 (φ0 = –2,363 В), – 120 (φ0 =
= 0,520 В) и + 66 КДж/моль (φ0 = 1,692 В). Следовательно, Мg более склонен к окислению, чем Сu, окисление Аu невозможно.
Коррозии подвержены все металлические и неметаллические материалы. Из этого черного списка надо исключить принудительное растворение металлов в кислотах c целью получения солей и процессы гальванотехники, радиоактивный распад, эрозию, износ трущихся деталей, шлифование. На скорость и механизм коррозионных процессов большое влияние могут оказывать внешние факторы – температура, давление среды, напряжение, скорость потока жидкости и газа, наличие трения, кавитации, облучения.
По природе гетерогенных процессов взаимодействия окружающей среды с металлами эти процессы можно разделить на два основных типа:
· химическая коррозия протекает в сухой атмосфере и чаще всего при повышенных температурах (газовая коррозия). Этот же тип коррозии металлических материалов наблюдается при взаимодействии с неэлектролитами;
· электрохимическая коррозия (ЭКХ) – самопроизвольное разрушение металлических материалов вследствие взаимодействия их с электролитически проводящей средой.
Газовая коррозия металла протекает при его взаимодействии с газами (О2, N2, СО2, SO2, H2 и др.) при повышенных температурах (закалка, отжиг, ковка, прокатка – технологические процессы, а также выхлопные газы ДВС и дизелей, отвод газов в металлургической и нефтехимической промышленностях).
К электрохимической коррозии относятся:
· коррозия в электролитах – кислотная, щелочная, солевая, морская
и т. п.;
· почвенная – ржавление металла в грунте (подземные трубопроводы);
· структурная коррозия – разрушение связано с повышенной коррозионной активностью одного из компонентов сплава из-за его структурной неоднородности;
· электрокоррозия – разрушение металлов под действием блуждающих токов;
· контактная коррозия – интенсивное разрушение металлов, имеющих разные электродные потенциалы («медь – алюминий»);
· щелевая коррозия – усиленное разрушение в зазорах, резьбовых соединениях, между фланцами;
· коррозия под напряжением – агрессивная среда в сочетании с внешними нагрузками;
· эрозионная коррозия – разрушение металла вследствие одновременного воздействия среды и механического износа;
· кавитационная коррозия – разрушение металла при одновременном воздействии удара и агрессивной среды;
· фриттинг-коррозия – разрушение металла механическим истирающим воздействием при наличии коррозионной среды.
Электрохимическая коррозия развивается в результате работы множества короткозамкнутых гальванических элементов, образующихся вследствие неоднородности металлического материала или внешней среды. Неоднородность поверхности материалов связана с концентрационной неоднородностью сталей и сплавов (ликвацией), границами зерен, присутствием различных включений, анизотропностью свойств отдельных кристаллитов, несплошностью и различным составом поверхностных пленок, неоднородностью деформаций и напряжений в металлах.
В зависимости от характера разрушения различают равномерную, протекающую примерно с одинаковой скоростью по всей поверхности металла, помещенного в коррозионную среду, и локальную, охватывающую только некоторые участки поверхности (точечная, щелевая, межкристаллитная, избирательная коррозии – в зависимости от характера разрушаемых участков).
По механизму действия все методы борьбы с коррозией можно разделить на две основные группы: электрохимические (термическая обработка, легирование, пассивация, ингибирование среды, химико-термическая обработка, диффузионная металлизация, протекторная защита и т. д.), оказывающие влияние на потенциал металла или его критическое значение, и механические (лакокрасочные и пластмассовые покрытия, консервация, эмалирование и т. д.), изолирующие металл от воздействия окружающей среды созданием защитной плёнки и покрытий.
Дата добавления: 2015-04-25; просмотров: 1448;
