Типы окислительно-восстановительных реакций
Различают три основных типа окислительно-восстановительных реакций:
1. Межмолекулярные (межмолекулярного окисления - восстановления).
К этому типу относятся наиболее многочисленные реакции, в которых атомы элемента окислителя и элемента восстановителя находятся в составе разных молекул веществ. Рассмотренные выше реакции относятся к этому типу.
2.Внутримолекулярные (внутримолекулярного окисления - восстановления).
К ним относятся реакции, в которых окислитель и восстановитель в виде атомов разных элементов находятся в составе одной и той же молекулы. По такому типу протекают реакции термического разложения соединений, например:
+5 -2 -1 0
2KCIO3= 2KCI + 3O2 .
3. Диспропорционирования (самоокисления - самовосстановления).
Это такие реакции, в которых окислителем и восстановителем является один и тот же элемент в одной и той же промежуточной степени окисления, которая в результате протекания реакции одновременно как снижается, так и повышается. Например:
-1 +5
3CI02 + 6 KOH = 5 KCI + KCIO3 + 3H2O,
+1 +5 -1
3HCIO = HCIO3 + 2HCI.
Окислительно-восстановительные реакции играют важную роль в природе и технике. В качестве примеров ОВР, протекающих в природных биологических системах, можно привести реакцию фотосинтеза у растений и процессы дыхания у животных и человека. Процессы горения топлива, протекающие в топках котлов тепловых электростанций и в двигателях внутреннего сгорания, являются примером ОВР.
ОВР используются при получении металлов, органических и неорганических соединений, проводят очистку различных веществ, природных и сточных вод.
9.5. Окислительно – восстановительные (электродные) потенциалы
Мерой окислительно – восстановительной способности веществ служат их электродные или окислительно – восстановительные потенциалы jox/Red (редокс-потенциалы).1 Окислительно – восстановительный потенциал характеризует окислительно – восстановительную систему, состоящую из окисленной формы вещества (Ох), восстановленной формы (Red) и электронов. Принято записывать окислительно-восстановительные системы в виде обратимых реакций восстановления:
Ох + ne- D Red.
 Механизм возникновения электродного потенциала. Механизм возникновения электродного или окислительно-восстановительного потенциала поясним на примере металла, погруженного в раствор, содержащий его ионы. Все металлы имеют кристаллическое строение. Кристаллическая решетка металла состоит из положительно заряженных ионов Men+ и свободных валентных электронов (электронный газ). В отсутствие водного раствора выход катионов металла из решетки металла невозможен, т.к. этот процесс требует больших энергетических затрат. При погружении металла в водный раствор соли, содержащей в своем составе катионы металла, полярные молекулы воды, соответственно ориентируясь у поверхности металла (электрода), взаимодействуют с поверхностными катионами металла (рис. 9.1).
Механизм возникновения электродного потенциала. Механизм возникновения электродного или окислительно-восстановительного потенциала поясним на примере металла, погруженного в раствор, содержащий его ионы. Все металлы имеют кристаллическое строение. Кристаллическая решетка металла состоит из положительно заряженных ионов Men+ и свободных валентных электронов (электронный газ). В отсутствие водного раствора выход катионов металла из решетки металла невозможен, т.к. этот процесс требует больших энергетических затрат. При погружении металла в водный раствор соли, содержащей в своем составе катионы металла, полярные молекулы воды, соответственно ориентируясь у поверхности металла (электрода), взаимодействуют с поверхностными катионами металла (рис. 9.1).
В результате взаимодействия происходит окисление металла и его гидратированные ионы переходят в раствор, оставляя в металле электроны:
 Ме (к) + m Н2Оокисление Меn+*m Н2О(р)+ nе-
Ме (к) + m Н2Оокисление Меn+*m Н2О(р)+ nе-
 Металл становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла (Ме). На границе металл - раствор возникает двойной электрический слой (рис.9.2). Разность потенциалов, возникающая между металлом и раствором, называется электродным потенциалом или окислительно - восстановительным потенциалом электрода φМеn+/Ме (φOx/Red в общем случае). Металл, погруженный в раствор собственной соли, является электродом (раздел 10.1). Условное обозначение металлического электрода Ме/Меn+ отражает участников электродного процесса.
Металл становится заряженным отрицательно, а раствор - положительно. Положительно заряженные ионы из раствора притягиваются к отрицательно заряженной поверхности металла (Ме). На границе металл - раствор возникает двойной электрический слой (рис.9.2). Разность потенциалов, возникающая между металлом и раствором, называется электродным потенциалом или окислительно - восстановительным потенциалом электрода φМеn+/Ме (φOx/Red в общем случае). Металл, погруженный в раствор собственной соли, является электродом (раздел 10.1). Условное обозначение металлического электрода Ме/Меn+ отражает участников электродного процесса.
По мере перехода ионов в раствор растет отрицательный заряд поверхности металла и положительный заряд раствора, что препятствует окислению (ионизации) металла.
Параллельно с процессом окисления протекает обратная реакция - восстановление ионов металла из раствора до атомов (осаждение металла) с потерей гидратной оболочки на поверхности металла:
Меn+ * m Н2О(р) + nе- восстановление Ме(к) + m Н2О.
 С увеличением разности потенциалов между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость процесса окисления будет равна скорости процесса восстановления, устанавливается равновесие:
С увеличением разности потенциалов между электродом и раствором скорость прямой реакции падает, а обратной реакции растет. При некотором значении электродного потенциала скорость процесса окисления будет равна скорости процесса восстановления, устанавливается равновесие:
Меn+ * m Н2О(р) + nе- D Ме(к) + m Н2О.
Для упрощения гидратационную воду обычно в уравнение реакции не включают и оно записывается в виде
Меn+ (р) + nе- D Ме(к)
или в общем виде для любых других окислительно-восстановительных систем:
Ох + ne- D Red.
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом. В рассмотренном случае процесс ионизации в растворе термодинамически возможен, и поверхность металла заряжается отрицательно. Для некоторых металлов (менее активных) термодинамически более вероятным является процесс восстановления гидратированных ионов до металла, тогда их поверхность заряжается положительно, а слой прилегающего электролита - отрицательно.
Устройство водородного электрода. Абсолютные значения электродных потенциалов измерить нельзя, поэтому для характеристики электродных процессов пользуются их относительными значениями. Для этого находят разность потенциалов измеряемого электрода и электрода сравнения, потенциал которого условно принимают равным нулю. В качестве электрода сравнения часто применяется стандартный водородный электрод, относящийся к газовым электродам. В общем случае газовые электроды состоят из металлического проводника, контактирующего одновременно с газом и раствором, содержащим окисленную или восстановленную форму элемента, входящего в состав газа. Металлический проводник служит для подвода и отвода электронов и, кроме того, является катализатором электродной реакции. Металлический проводник не должен посылать в раствор собственные ионы. Удовлетворяют этим условиям платина и платиновые металлы.
Водородный электрод (рис. 9.3) представляет собой платиновую пластинку, покрытую тонким слоем рыхлой пористой пластины (для увели  чения поверхности электрода) и опущенную в водный раствор серной кислоты с активностью (концентрацией) ионов Н+, равной единице.
чения поверхности электрода) и опущенную в водный раствор серной кислоты с активностью (концентрацией) ионов Н+, равной единице.
Через раствор серной кислоты пропускают водород под атмосферным давлением. Платина (Pt) – инертный металл, который практически не взаимодействует с растворителем, растворами (не посылает свои ионы в раствор), но он способен адсорбировать молекулы, атомы, ионы других веществ. При контакте платины с молекулярным водородом происходит адсорбция водорода на платине. Адсорбированный водород, взаимодействуя с молекулами воды, переходит в раствор в виде ионов, оставляя в платине электроны. При этом платина заряжается отрицательно, а раствор – положительно. Возникает разность потенциалов между платиной и раствором. Наряду с переходом ионов в раствор идет обратный процесс – восстановление ионов Н+ из раствора с образованием молекул водорода. Равновесие на водородном электроде можно представить уравнением
2Н+ + 2е- D Н2.
Условное обозначение водородного электрода H2, Pt│H+. Потенциал водородного электрода в стандартных условиях (Т = 298 К, РН2 = 101,3 кПа, [Н+]=1 моль/л, т.е. рН=0) принят условно равным нулю: j02Н+/ Н2= 0 В.
Стандартные электродные потенциалы. Электродные потенциалы, измеренные по отношению к стандартному водородному электроду при стандартных условиях (Т=298К; для растворённых веществ концентрация (активность) С Red = Сох = 1 моль/л или для металлов СМеn+ = 1 моль/л, а для газообразных веществ Р=101,3 кПа), называют стандартными электродными потенциалами и обозначают j0Оx/ Red. Это справочные величины.
Окислительная способность веществ тем выше, чем больше алгебраическая величина их стандартного электродного (окислительно-восстановительного) потенциала. Напротив, чем меньше величина стандартного электродного потенциала реагирующего вещества, тем сильнее выражены его восстановительные свойства. Например, сравнение стандартных потенциалов систем
F2 (г.) + 2e-D 2F  (p.) j0 = 2,87 В
(p.) j0 = 2,87 В
H2 (r.)+ 2e- D 2H  (р.) j0 = -2,25 В
(р.) j0 = -2,25 В
показывает, что у молекул F2 сильно выражена окислительная тенденция, а у ионов H 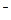 - восстановительная.
- восстановительная.
Ряд напряжений металлов. Располагая металлы в ряд по мере возрастания алгебраической величины их стандартных электродных потенциалов, получают так называемый «Ряд стандартных электродных потенциалов» или «Ряд напряжений», или «Ряд активности металлов».
Положение металла в «Ряду стандартных электродных потенциалов» характеризует восстановительную способность атомов металла, а также окислительные свойства ионов металла в водных растворах при стандартных условиях. Чем меньше значение алгебраической величины стандартного электродного потенциала, тем большими восстановительными свойствами обладает данный металл в виде простого вещества, и тем слабее проявляют окислительные свойства его ионы и наоборот.
Например, литий (Li), имеющий самый низкий стандартный потенциал, относится к наиболее сильным восстановителям, а золото (Au), имеющее самое высокое значение стандартного потенциала, является очень слабым восстановителем и окисляется лишь при взаимодействии с очень сильными окислителями. Из данных «Ряда напряжений» видно, что ионы лития (Li+), калия (К+), кальция (Са2+) и т.д. - самые слабые окислители, а к наиболее сильным окислителям принадлежат ионы ртути (Нg2+), серебра (Аg+), палладия (Pd2+), платины (Pt2+), золота (Аu3+, Аu+).
Уравнение Нернста. Электродные потенциалы не являются неизменными. Они зависят от соотношения концентраций (активностей) окисленной и восстановленной форм вещества, от температуры, природы растворенного вещества и растворителя, рН среды и др. Эта зависимость описывается уравнением Нернста:
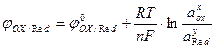 ,
,
где j0Оx / Red – стандартный электродный потенциал процесса; R – универсальная газовая постоянная; T – абсолютная температура; n - число электронов, участвующих в электродном процессе; аох, а Red – активности (концентрации) окисленной и восстановленной форм вещества в электродной реакции; x и у – стехиометрические коэффициенты в уравнении электродной реакции; F- постоянная Фарадея.
Для случая, когда электроды металлические и устанавливающиеся на них равновесия описываются в общем виде
Меn+ + nе- D Ме,
уравнение Нернста можно упростить, приняв во внимание, что для твердых веществ активность постоянна и равна единице. Для 298 К, после подстановки аМе=1 моль/л, x=y=1 и значений постоянных величин R=8,314 Дж/ К*моль; F = 96485 Кл / моль, заменяя активность аМеn+ на молярную концентрацию ионов металла в растворе СМеn+ и введя множитель 2,303 (переход к десятичным логарифмам), получим уравнение Нернста в виде
j Меn+ / Ме = j0 Меn+ / Ме + 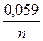 lg С Меn+.
lg С Меn+.
Дата добавления: 2015-04-19; просмотров: 1220;
