Общие представления о химическом равновесии. Константа химического равновесия
Химические реакции, в результате которых хотя бы одно из исходных веществ расходуется полностью, называются необратимыми, протекающими до конца.
Однако большинство реакций являются обратимыми, т.е. идущими в двух противоположных направлениях (прямом и обратном). Особенность таких реакций: они не протекают до конца, в системе всегда остается каждое из исходных веществ. Примеры:
2NO + Cl2 Û 2NOCl;
H2 + I2 Û 2HI;
N2 + 3H2 Û 2NH3;
СО + H2O Û CO2 + H2 и т.д.
 |
Все обратимые реакции идут до состояния равновесия. Реакция, протекающая в правую сторону (→) – прямая реакция, а в левую сторону () – обратная реакция. Кинетические кривые для прямой (1) и обратной (2) реакции представлены на рис. 7.1.
Со временем скорость прямой реакции, V®, уменьшается, а скорость обратной, V, возрастает. В некоторый момент времени V® становится равной V, наступает химическое равновесие (частный случай термодинамического равновесия).
Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции V® равна скорости обратной реакции V. Равенство V® = V является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянством величины энергии Гиббса системы GP,T. Равенство D GP,T = 0 является термодинамическим условием химического равновесия.
Концентрации исходных веществ и продуктов реакции (реагирующих веществ), которые устанавливаются при химическом равновесии, называют равновесными. Обычно их обозначают при помощи квадратных скобок, например, [NO], [Cl2], [NOCl], в отличие от неравновесных концентраций, СNO, ССl2, СNOCl.
Химическое равновесие является динамическим или подвижным. Это означает, что в системе, находящейся в состоянии химического равновесия, с равной скоростью идут прямой и обратный процессы, поэтому в системе видимых изменений не наблюдается, т.е. макроскопические параметры, в том числе концентрации веществ, остаются постоянными.
Допустим, что в гомогенной системе протекает обратимая химическая реакция:
аА + bВ Û сС +dD . (1)
В соответствии с законом действия масс:
V® = k® · [А]a · [В]b, (2)
V = k · [С]c · [D]d. (3)
В состоянии химического равновесия V® = V или
k® · [А]a · [В]b = k · [С]c · [D]d. (4)
После преобразования:
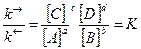 , (5)
, (5)
где К – константа равновесия химической реакции.
Закон действия масс для обратимых химических процессов формулируется следующим образом: отношение произведения молярных концентраций продуктов реакции к произведению молярных концентраций исходных веществ, взятых в степени их стехиометрических коэффициентов, при данной температуре равно постоянной величине, называемой константой химического равновесия.
Константа равновесия, как следует из выражения (5), равна отношению констант скоростей прямой и обратной реакций. Она показывает, во сколько раз скорость прямой реакции больше скорости обратной реакции, если концентрации каждого из реагирующих веществ равны 1 моль/л. В этом заключается физический смысл константы химического равновесия K.
Константа равновесия зависит от температуры протекания процесса (поскольку k® и k зависят от температуры) и природы реагирующих веществ, но не зависит от их концентрации и наличия катализатора.
Например, для гомогенной химической реакции синтеза и разложения йодоводорода:
I2(г) + Н2(г) Û 2HI(г),
выражение для константы химического равновесия будет иметь вид
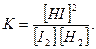
Если в гетерогенной системе протекает обратимая химическая реакция, то к ней также применим закон действующих масс, но в выражение для константы химического равновесия не входят концентрации реагирующих веществ, находящихся в конденсированном состоянии (твердом или жидком), т.к. их концентрации остаются, как правило, постоянными и входят в значение соответствующих констант скоростей химической реакции. Например, для гетерогенной реакции (термического разложения) карбоната кальция:
CaCO3(тв) Û СaO(тв) + CO2(г),
выражение для константы химического равновесия будет иметь вид К = [СО2].
Константа химического равновесия связана с изменением энергии Гиббса химической реакции (изобарно-изотермическим потенциалом) ΔG уравнением
ΔG = - RT lnK или К = ехр 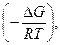 (6)
(6)
где R – универсальная газовая постоянная (8,31 Дж/(моль∙К)); Т – абсолютная температура, К; К – константа равновесия.
При стандартных условиях (Т = 298 К): ΔG0298 (кДж) = - 5,71 · lgK298.
Приведенное уравнение позволяет по величине ΔG вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Если:
· K > 1, то ΔG < 0, в равновесной смеси преобладают продукты взаимодействия, равновесие смещено вправо (протекает прямая реакция);
· K < 1, то ΔG > 0, в равновесной смеси преобладают исходные вещества, равновесие смещено влево (обратная реакция);
· K = 1, то ΔG = 0, скорости прямой и обратной реакций равны между собой, состояние химического равновесия.
Дата добавления: 2015-04-19; просмотров: 859;
