Кислоты
Кислоты – это вещества, диссоциирующие в растворах с образованием катионов водорода и анионов кислотного остатка (с позиций теории электролитической диссоциации).
Кислоты классифицируют по их силе (по способности к электролитической диссоциации – на сильные и слабые), по основности (по числу атомов водорода в молекуле кислоты, способных замещаться атомами металла с образованием соли – на одноосновные, двухосновные, трехосновные), по наличию или отсутствию кислорода в составе кислоты (на кислородсодержащие и бескислородные). Например, азотная кислота HNO3 – сильная, одноосновная, кислородсодержащая кислота; сероводородная кислота H2S – слабая, двухосновная, бескислородная кислота.
Химические свойства кислот:
1. Взаимодействие с основаниями с образованием соли и воды (реакция нейтрализации):
H2SO4 + Cu (OH)2 = CuSO4 + 2H2O.
2. Взаимодействие с основными и амфотерными оксидами с образованием солей и воды:
2HNO3 + MgO = Mg(NO3)2 + H2O,
H2SO4 + ZnO = ZnSO4 + H2O.
3. Взаимодействие с металлами. Металлы, стоящие в “Ряду напряжений” до водорода, вытесняют водород из растворов кислот (кроме азотной и концентрированной серной кислот); при этом образуется соль:
Zn + 2HCl =ZnCl2 + H2 .
Металлы, находящиеся в “Ряду напряжений” после водорода, водород из растворов кислот не вытесняют
Cu + 2HCl ≠.
Взаимодействие металлов с азотной и концентрированной серной кислотами см. в разделе 11.
4. Некоторые кислоты при нагревании разлагаются:
H2SiO3 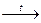
 H2O + SiO2.
H2O + SiO2.
5. Менее летучие кислоты вытесняют более летучие кислоты из их солей:
H2SO4конц + NaClтв = NaHSO4 + HCl↑.
6. Более сильные кислоты вытесняют менее сильные кислоты из растворов их солей:
2HCl + Na2CO3 = 2NaCl + H2O + CO2↑
Номенклатура кислот. Названия бескислородных кислот составляют, добавляя к корню русского названия кислотообразующего элемента (или к названию группы атомов, например, CN – циан, CNS – родан) суффикс -о-, окончание водородная и слово “кислота”. Например, HCl – хлороводородная кислота, H2S – сероводородная кислота, HCN – циановодородная кислота.
Названия кислородосодержащих кислот также образуются от русского названия кислотообразующего элемента с добавлением соответствующих суффиксов, окончаний и слова “кислота”. При этом название кислоты, в которой элемент находится в высшей степени окисления, оканчивается на -ная или -овая; например, H2SO4 – серная кислота, HClO4 – хлорная кислота, H3AsO4 – мышьяковая кислота. С понижением степени окисления кислотообразующего элемента окончания изменяются в следующей последовательности: -оватая (HClO3 - хлорноватая кислота), истая (HClO2 - хлористая кислота), -оватистая (HClO - хлорноватистая кислота). Если элемент образует кислоты, находясь только в двух степенях окисления, то название кислоты, отвечающее более низкой степени окисления элемента, имеет окончание истая (HNO3 – азотная кислота, HNO2 – азотистая кислота).
В некоторых случаях к одной молекуле оксида может присоединиться различное количество молекул воды (т.е. элемент в одной и той же степени окисления образует несколько кислот, содержащих по одному атому данного элемента). Тогда кислоту с большим содержанием воды обозначают приставкой орто- , а кислоту с меньшим числом молекул воды обозначают приставкой мета- . Например :
P2O5 + H2O = 2HPO3 - метафосфорная кислота;
P2O5 + 3H2O = 2H3PO4 - ортофосфорная кислота.
Дата добавления: 2015-04-19; просмотров: 1075;
