Кристаллические и аморфные тела
Увеличение потенциальной энергии взаимодействия по сравнению с кинетической энергией молекул при некоторых условиях приводит к образованию твёрдого тела. Твёрдые тела обычно делят на кристаллические и аморфные.
Аморфные вещества, как и жидкости, имеют ближний порядок в межмолекулярных взаимодействиях. К аморфным телам относят, например, стекло, смолы, пластмассы. Теоретическое описание аморфных тел сложно, как и описание жидкостей. Физические свойства аморфных тел зависят от способа их получения. Аморфные тела изотропны, то есть имеют одинаковые физические свойства по всем направлениям.
Значительно лучше развита физика кристаллического состояния из-за высокой степени упорядоченности их структуры. Различают монокристаллы и поликристаллы. Поликристаллы состоят из множества монокристаллов, расположенных беспорядочно, поэтому поликристаллы изотропны. Монокристаллы же анизотропны, то есть их свойства различны по разным направлениям.
В основе теории твёрдого тела лежит модель бесконечного совершенного монокристалла. Структура монокристалла представляет собой непрерывное повторение в трёхмерном пространстве одинаковых структурных единиц. Для монокристаллов характерно сохранение углов между гранями при их росте или разрушении. Для описания правильной структуры кристаллов удобно использовать понятие кристаллической решётки. Кристаллическая решётка учитывает не только пространственную структуру (решётку), но и тип взаимодействия между частицами решётки. Правильное размещение частиц в кристалле можно описать с помощью операции параллельного перемещения или трансляции. Радиус-вектор, характеризующий положение частицы определяют так:
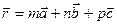 ,
,
где 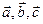 - наименьшие векторы трансляции. Решётка, построенная путём трансляции какого-либо узла по трём направлениям, называется трансляционной или решёткой Бравэ. Пространственная решётка – это чисто геометрическое понятие в отличие от кристаллической решётки, которую можно получить, связав с каждым узлом пространственной решётки атом, молекулу, ион, группу атомов или молекул, называемых базисом. Пространственную решётку можно представить как результат заполнения трёхмерного пространства отдельными ячейками – элементарными ячейками. Применив к элементарной ячейке операцию трансляции, получим пространственную решётку. Выбор элементарной ячейки не является однозначным. Элементарная ячейка, обладающая наименьшим объёмом, называется примитивной ячейкой. Пространственные решётки могут обладать свойствами симметрии не только по отношению к операции трансляции, но и по отношению к повороту, отражению, инверсии и др. Русский кристаллограф Фёдоров Е.С. показал, что существует всего семь классов кристаллических решёток, которые могут образовать 230 пространственных решёток с различными типами симметрии. В кристалле частицы вещества могут располагаться не только в узлах элементарной ячейки, но и в центре граней, тогда решётку называют гранецентрированной. Если частицы вещества располагаются в серединах диагональных плоскостей, проходящих через вершины, то решётку называют объёмноцентрированной. Если частицы вещества располагаются в серединах диагональных плоскостей базиса, то решётку называют базоцентрированной.
- наименьшие векторы трансляции. Решётка, построенная путём трансляции какого-либо узла по трём направлениям, называется трансляционной или решёткой Бравэ. Пространственная решётка – это чисто геометрическое понятие в отличие от кристаллической решётки, которую можно получить, связав с каждым узлом пространственной решётки атом, молекулу, ион, группу атомов или молекул, называемых базисом. Пространственную решётку можно представить как результат заполнения трёхмерного пространства отдельными ячейками – элементарными ячейками. Применив к элементарной ячейке операцию трансляции, получим пространственную решётку. Выбор элементарной ячейки не является однозначным. Элементарная ячейка, обладающая наименьшим объёмом, называется примитивной ячейкой. Пространственные решётки могут обладать свойствами симметрии не только по отношению к операции трансляции, но и по отношению к повороту, отражению, инверсии и др. Русский кристаллограф Фёдоров Е.С. показал, что существует всего семь классов кристаллических решёток, которые могут образовать 230 пространственных решёток с различными типами симметрии. В кристалле частицы вещества могут располагаться не только в узлах элементарной ячейки, но и в центре граней, тогда решётку называют гранецентрированной. Если частицы вещества располагаются в серединах диагональных плоскостей, проходящих через вершины, то решётку называют объёмноцентрированной. Если частицы вещества располагаются в серединах диагональных плоскостей базиса, то решётку называют базоцентрированной.
Расположение атомов или молекул в базисе зависит от сил взаимодействия между ними. Частицы располагаются так, чтобы энергия взаимодействия между ними была минимальной. Положительная разность между энергией изолированных частиц и энергией частиц в кристаллической решётке называется энергией связи. Энергия связи определяется работой, необходимой для удаления частицы из кристалла.
По типу связей различают пять классов кристаллов.
1. Кристаллы молекулярные (с Ван-дер-Ваальсовыми связями). Энергия связи в таких кристаллах имеет значения порядка величины 103 ÷104 Дж/моль. Примерами таких кристаллов являются кристаллы затвердевших инертных газов- неона, аргона, криптона, ксенона.
2. Кристаллы с ковалентной связью. Взаимодействие между частицами в таких кристаллах обусловлено тем, что два электрона принадлежат одновременно двум атомам. Энергия связи в таких кристаллах имеет значения порядка величины 105 ÷106 Дж/моль. Примерами таких кристаллов являются кристаллы кремния, алмаза.
3. Кристаллы с водородной связью. Эта связь обусловлена наличием водорода в веществах. Она слабее ковалентной. Энергия связи в таких кристаллах имеет значения порядка величины 104 Дж/моль. Примерами таких кристаллов являются кристаллы льда, вещества КН2РО-сегнетоэлектрика, применяемого в устройствах обработки информации, фтороводорода НF , синильной кислоты НСN, фторида аммония NH4F и др.
4. Кристаллы с ионной связью. Эта связь обусловлена взаимодействием ионов. Энергия связи в таких кристаллах имеет значения порядка величины 105 ÷106 Дж/моль. Примерами таких кристаллов являются кристаллы поваренной соли NaCl, фторида лития LiF.
5. Кристаллы с металлической связью. В металлах все валентные электроны слабо связаны с остовами атомов (положительными ионами, находящимися в узлах кристаллической решётки) и обобществлены, так что нельзя определить какой валентный электрон к какому остову относится. Валентные электроны в металлах уподобляют идеальному электронному газу, заполняющему пространство между узлами кристаллической решётки, в которых находятся положительные ионы. Энергия связи в таких кристаллах имеет значения порядка величины 104 ÷105 Дж/моль. Примерами таких кристаллов являются кристаллы всех металлов.
В кристаллах также возможны смешанные связи.
Дата добавления: 2015-04-15; просмотров: 1479;
