Молекулярно-поверхностные свойства воды,
система "жидкость - пористая среда"
Чтобы детально разобраться с процессами физико-химического взаимодействия дисперсных систем и дисперсной среды рассмотрим более подробно структуры воды.
Молекула воды, как известно, представлена двумя одновалентными ионами водорода и одним двухвалентным ионом кислорода. Молекула воды не является энергетически нейтральной. Это объясняется тем, что атомы водорода примыкают к кислороду с одной и той же стороны, что и вызывает возникновение электрического момента. По другим данным ионы водорода и кислорода в молекуле воды расположены в вершинах равнобедренного треугольника, причем угол у вершины треугольника, занятый ионом кислорода равен 105°.
Дипольность молекул воды обуславливает их способность вступать друг с другом в связь, притягиваясь полюсами противоположного знака. Это приводит к тому, что структура воды имеет как бы рыхлое строение. Ее истинный объем превышает расчетные значения.
Объяснить отсутствие электронейтральности молекулы воды можно и следующим образом. Атом водорода, имеющий одну стабильную орбиту, способен образовывать лишь одну ковалентную связь. Однако, несмотря на это оказывается, что в некоторых случаях атом водорода может принять к себе и тем самым связать между собой два атома. В этом случае возникает уже ионная связь, т.е. связь, в основе которой лежит кулоновское притяжение между разноименно заряженными телами. Такая водородная связь более вероятна чем более электроотрицательные атомы, соединяемые водородом. Ион кислорода имеет высокий отрицательный заряд и поэтому он легко образует водородные связи с ионами водорода. Вследствие этого же молекулы воды могут легко ассоциироваться между собой в комплексы. При этом структура воды изменяется. Ее изменение возможно и у поверхности твердой фазы.
Наличие электрического поля у молекулы воды обуславливает и чрезвычайную ее растворяющую способность, т.к. силы взаимодействия между заряженными частицами в воде уменьшаются в 81 раз. В результате этого прочность внутри молекулярной связи становится недостаточной и частички под действием броуновского движения переходят в раствор.
Диполи могут притягиваться ионами вследствие взаимного притяжения электрических зарядов, присущих, с одной стороны иону а, с другой - полисами молекул воды. Это явление называется гидратацией ионов и выражается в образовании гидратной оболочки вокруг ионов, состоящей из притянутых ионов молекул воды. Учитывая различный размер ионов, можно заранее предвидеть, что величина этих гидратных оболочек будет у различных ионов разной.
В настоящее время структура твердых тел в основном довольно таки детально изучена. В ее основу положены модели типа жестких шариков, шариков с притяжением и упругих шариков. Как следствие этого существуют количественные теории жидкостей типа идеальных газов, частично жидких металлов и некоторых молекулярных жидкостей. Для ассоциированных жидкостей с водородными связями удовлетворительной теории в настоящее время нет.
В литературе структура электронного облака в основном описывается тетраэдрической моделью, с атомом кислорода в центре и атомами водорода в двух вершинах и двумя отрицательными зарядами, символизирующими уединенные электронные пары в двух других вершинах тетраэдра.
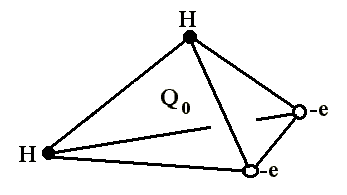
Рис. 1.2.
Поэтому молекула воды может участвовать в четырех водородных связях: в двух за счет протонов и в двух за счет неподеленных пар атома кислорода. Особенности поведения воды обусловлены и ориентацией ядерных спинов двух протонов. Наиболее распространены следующие структурные модели воды: кластерная, клатратная и континуальная (непрерывная).
В кластерной модели (Ж. Немети, Н. Шерега) модель воды представлена в виде кластеров, т.е. в определенной зоне молекул связаны между собой в другой связи нет. При этом имеется возможность распада кластеров, появленье новых.
Клатратная модель (Самойлов С. Я.) предусматривает образование сетки водородных связей между молекулами воды, внутри которой имеются пустоты, заполняемые мономерными молекулами (не имеющими водородных связей).
Континуальная модель (И. Попл) предусматривает отсутствие молекул воды с разорванными водородными связями, образующими кольцевые ассоциаты.
Сложная структура воды обуславливает и ее специфические свойства, а также их зависимости от температуры.
Вот некоторые из них:
| Вода | Лед | Вода/лед | |
| Статистическая диэлектрическая проницаемость | 87,74 | 0,975 | |
| Плотность | 1,00 | 0,917 | 1,0905 |
| Показатель преломления | 1,3339493 | 1,3593 | 1,019 |
| Количество ионов Н+, моль/л | 3,36 × 10- | 1,4 × 10 | |
| Электропроводность, Ом-1 × см-1 | 12 × 10-9 | 3 × 10-9 | |
| Коэффициент самодиф, см/с | 1,4 × 10-5 | 10-11 | 1,4 × 106 |
| Вязкость, Па с | 1,79 | 108 - 104 | 10-8 - 10-1 |
| Теплопроводность, Вт/м × К | 0,551 | 2,21 | 0,241 |
| Теплоемкость, Дж/г × К | 4,21 | 2,05 | 8,61 |
| Скорость звука, м/с | 0,353 |
Удельная поверхность коллекторов нефти и газа нередко достигает тысяч м2. Поэтому между фильтрующееся жидкостью и коллектором существует на границах раздела поверхностное взаимодействие. Это взаимодействие оказывает существенное влияние на фильтрацию.
Важнейшим характеристикой поверхности раздела фаз является поверхностное натяжение. Известно, что поверхностное натяжение на границе жидкость-газ зависит от многих факторов - химического состава жидкости и газа, температуры, давления и др. факторов. С увеличением температуры и давления поверхностное натяжение уменьшается. Сложнее характер изменения поверхностного натяжения на границе нефть-жидкость. Если нефть дегазирована и почти не содержит полярных компонентов, ее поверхностное натяжение на границе с водой практически не зависит от температуры и давления. Если же в нефти содержатся полярные компоненты, растворимые в воде, то с ростом давления и температуры поверхностное натяжение ее на границе с водой может увеличиваться. При наличии растворимых газов зависимость усложняется.
Непосредственно измерить поверхностное натяжение на поверхности твердого тела трудно. В этом случае поверхностное натяжение оценивается косвенно - путем изменения краевого угла смачивания, который также служит и мерой смачивания жидкостью поверхности твердого тела. Поверхность твердого тела смачивается тем лучше, чем меньше разность полярностей между телом и жидкостью. Высокополярные жидкости, т.е. обладающие высоким поверхностным натяжением, смачивает твердую поверхность хуже, чем малополярные. Например, ртуть смачивает лишь некоторые металлы, тогда как менее полярная жидкость - вода смачивает не только металлы, но и многие минералы, а мало полярные масла - все твердые тела.
Величина угла смачивания зависит от многих факторов. Особенно большое влияние на нее оказывает процессы адсорбции. Например, обработкой ПАВ можно значительно увеличить смачиваемость и наоборот уменьшить.
В период вскрытия продуктивного пласта и в период освоения границы раздела фаз не остаются стабильными: при вскрытии - нефть оттесняется от скважины, при освоении наоборот. При таком изменении направления движения меняется и угол смачиваемости.
Дата добавления: 2015-03-09; просмотров: 1250;
