АНЕСТЕЗИЯ ПРИ НЕЙРОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВАХ
Анестезия при нейрохирургических операциях — один из наиболее сложных разделов анестезиологии, что обусловлено главным образом следующим:
1. Поражение ЦНС нарушает естественные защитные механизмы и механизмы регуляции функций жизненно важных органов и систем. Еще до операции могут наблюдаться тяжелые поражения — аспирационный синдром у больных в коме, надпочечниковая недостаточность, дегидратация и отек легких — при поражении гипоталамо-гипофизарной системы, эпистатус — при поражении соответствующих отделов коры, подкорки и ствола мозга, неуправляемая гипотония — при спинальных поражениях.
2. Нередко наблюдается явная или скрытая полиорганная недостаточность, в том числе такие состояния, как нарушения гемостаза, иммунных механизмов, диспротеинемия.
3. Очень часто состояние больных ухудшается под влиянием ятрогенных факторов — дегидратационной терапии, проводимой для борьбы с отеком мозга, противосудорожной терапии, длительного дренирования ликворных путей и т. д.
В еще большей степени все это усугубляется во время и после оперативных вмешательств, которые:
1) осуществляются вблизи или непосредственно на высших центрах регуляции жизненно важных функций и психической деятельности;
2) производятся в так называемых неудобных, создающих дополнительные опасности позициях — сидя, на животе;
3) сопряжены с опасностью большой кровопотери;
4) требуют специфических мероприятий, обеспечивающих доступ к глубинным образованиям мозга (дегидратация, ИВЛ в режиме гипервентиляции, глубокая гипотония);
5) опасны тем, что не всегда можно контролировать рефлексы, характеризующие глубину анестезии, уровень сознания, мышечный тонус и т. д.
Общие вопросы анестезии при нейрохирургических вмешательствах
Оптимально выбор и проведение анестезии у больных этой категории требуют учета как общих, так и специфических компонентов [Маневич А.3., 1973]. Для этого необходимо оценить влияние премедикации, вводной и основной анестезии, специальных методов и приемов анестезии на следующие показатели, определяющие целостное функционирование мозга: функциональное состояние, метаболизм мозга, мозговое кровообращение, внутричерепные объем и давление, гематоэнцефалический барьер.
Подготовка к операции.Важнейшее значение имеют меры, направленные на устранение декомпенсированных нарушений функций системы дыхания (аэрозольная терапия, бронхоскопия, интубация трахеи, трахеостомия и др.), гемодинамики (в первую очередь устранение гиповолемии), нарушений питания, водно-электролитного обмена и функций эндокринной системы.
С большой осторожностью при подготовке следует использовать осмотические диуретики, так как у ряда больных (с инсультом, гематомой, черепно-мозговой травмой) они могут увеличить внутричерепное кровотечение и усугубить повреждения мозга, обусловленные его сдавлением. При необходимости лучше применять салуретики — фуросемид, диакарб, триампур. Однако следует помнить, что использование любого салуретика может усугубить дефицит ОЦК.
Даже в экстренных ситуациях следует попытаться выяснить, не получал ли больной (пострадавший) каких-либо препаратов, которые могли бы изменить течение общей анестезии. В первую очередь это относится к гормональным препаратам, салуретикам, психотропным и противосвертывающим средствам. Если для борьбы с отеком мозга были использованы глкжокортикоидные гормоны, то на любом этапе анестезии может возникнуть сердечно-сосудистый коллапс. Такому больному лучше еще до начала анестезии ввести удвоенную дозу того препарата, который он обычно получает, и иметь наготове 4—8 мг дексазона (или эквивалентную дозу другого препарата) для внутривенного введения.
Если больной принимал фуросемид, то следует учитывать, что на его фоне недеполяризующие релаксанты действуют более длительно, а гипотензивный эффект их более выражен.
У больных эпилепсией, леченных дилантином (дифенин) или гексамидином (противоэпилептические средства), из премедикации следует исключить барбитуровые производные, а для вводной анестезии использовать их в большем разведении и в минимальных дозах, как и недеполяризующие релаксанты, в связи с развитием повышенной чувствительности к ним. У этих же больных не следует применять альтезин, кетамин и энфлуран, так как возможно развитие эпилептического статуса [Беляков В.А., 1983].
Если больного лечили производными дофамина (леводопа) или его агонистами (бромкриптин), то не следует применять фторотан (опасность гипотензии), кетамин (вероятность гипертензионного криза) и очень осторожно применять деполяризующие релаксанты (опасность гиперкалиемии у больных с паркинсонизмом и другими подкорковыми синдромами).
Премедикация.Больным с сохраненным сознанием, в том числе с заболеваниями и травмой головного и спинного мозга, за 30—40 мин до операции вводят внутримышечно 20—40 мг промедола, антигистаминные препараты (10—25 мг супрастина, димедрола или дипразина). Целесообразно включать в премедикацию 0,5 мг фенозепама, а при двигательном возбуждении диазепам в дозе 0,2—0,3 мг/кг, который дает также выраженный противосудорожный эффект и снижает внутричерепное давление на 30—40% по сравнению с исходным [Столкарц И.3., 1983]. При общем тяжелом состоянии целесообразно ограничиться введением половины обычной дозы атропина, который уменьшает вероятность развития тяжелых нарушений ритма сердца.
Вводная анестезия.Следует полностью согласиться с J. Michenfelder и соавт. (1982) в том, что введение в анестезию больных с внутричерепной патологией должно быть максимально быстрым и гладким, без рвотных движений, двигательного возбуждения, перепадов артериального давления. Для этого чаще всего внутривенно вводят барбитураты, реже бензодиазепин (диазепам). Помимо гладкого введения в анестезию, тиопентал-натрий дает профилактический защитный эффект, особенно у больных с сосудистыми поражениями. Этого не отрицают даже противники лечебного барбитурового наркоза, например Г.Н. Миротворская и соавт (1983). На фоне вводной анестезии барбитуратами можно в дальнейшем проводить более глубокую и более продолжительную управляемую гипотонию [Грибова Э.А., 1971]. У больных с разрывами аневризм и у пострадавших с тяжелой черепно-мозговой травмой дополнительные опасности вводной анестезии сопряжены с тем, что дальнейшее повышение внутричерепного давления (именно это является ключевым моментом подготовки» премедикации, вводной и основной анестезии!) возможно вследствие уже имеющихся нарушений дыхания (аспирация, патологические ритмы дыхания, нарушения газообмена). Введение зонда недопустимо. Необходимо использовать прием Селлика и не применять для индукции ингаляционные анестетики. При этом вводный период затягивается, нередко возникают возбуждение и повышение внутричерепного давления.
Обычная методика вводной анестезии заключается во внутривенном введении 1—2% раствора тиопентал-натрия или гексенала При гиповолемии у больных старших возрастных групп, у больных и пострадавших с нарушениями сознания, дыхания и кровообращения лучше использовать 1% раствор Это необходимо и при поражении спинного мозга на уровне TIV-VII. Все более широкое распространение получает вводная анестезия последовательным введением диазепама (20—40 мг), дроперидола (12,5—25мг) ифентанила (300—500 мгк) У особенно тяжело больных дозы уменьшают на 1/3или используют для вводной анестезии натрия оксибутират в дозе 70—100 мг/кг.
Очень заманчиво использовать для индукции кетамин (у больных с артериальной гипотензией, при трансназальных вмешательствах на гипофизе) [Ельников В.И., 1984]. Однако при малейшем подозрении на внутричерепную гипертензию необходимо отказаться от этого анестетика. Если гипертензию, вызываемую фторотаном и метоксифлураном, можно предупредить гипервентиляцией, то при анестезии кетамином этого не происходит и угроза вклинения мозга чрезвычайно велика. Нецелесообразно также использовать сильные наркотические анальгетики типа морфина из-за опасности резкого угнетения не только дыхательного, но и близлежащего сосудодвигательного центра.
Интубация трахеи. Необходимо исключить все факторы, повышающие внутричерепное давление: гипоксию, гиперкапнию, кашель, мышечное напряжение. При пороках развития (гипертелоризм, артроз верхнечелюстного сочленения) и переломе нижней челюсти у пострадавших с черепно-мозговой травмой целесообразно проводить интубацию через нос с помощью фиброво-локонной оптики [Александров В Н. и др., 1984] Если по невозможно, то лучше осуществить трахеостомию.
Интубацию выполняют только в улучшенном положении Джексона, что не только обеспечивает быстроту, атравматичность, но и улучшает венозный отток из полости черепа. Тотальной миоплегии достигают введением деполяризующих миорелаксантов (1,5—2 мг/кг). Больным с параличами во избежание фибрилляций и гиперкалиемии предварительно вводят 3—5 мг тубарина или эквивалентные дозы других недеполяризующих миорелаксантов.
Положение больного на операционном столе. Почти половина вмешательств и исследований в нейрохирургии осуществляется в специальных позициях. Но даже положение на спине рекомендуется заменить умеренным положением Фовлера, поднимая головной конец стола на 20—30° Это улучшает венозный отток из полости черепа, облегчая важнейшую задачу — доступ к глубинным образованиям, и предупреждает внутричерепную гипертензию.
При вмешательствах на задней черепной ямке (чаще у детей) и на спинном мозге используют положение на боку. У этих больных, как правило, имеются явные или скрытые нарушения гемодинамики Общая анестезия усугубляет опасность коллапса при повороте со спины на бок. Прежде чем повернуть больного, необходимо устранить гиповолемию, а в случае низкого сосудистого тонуса применить допамин.
Еще более опасно положение на животе, так как, помимо возможности развития гемодинамических нарушений, резко затрудняются внешнее дыхание н отток крови из полости черепа Чтобы уменьшить отрицательные последствия (акого положения, используют специальные приспособления, приподнимающие грудную клетку над операционным столом (упор на таз и плечевой пояс) Обязательно проведение ИВЛ.
Все опасности многократно возрастают при необходимости проведения вмешательств (операции на задней черепной ямке) и исследовании (пневмо- и вентрикулография) в положении сидя. Достоинства этой позиции бесспорны: облегчается доступ ко всем образованиям задней черепной ямки, операции с новятся менее травматичными, улучшается венозный отток, значительнс уменьшается кровопотеря. Однако резко усиливается опасность сердечно- сосудистого коллапса и воздушной эмболии. Чтобы предупредить эти осложнения, необходимо полностью устранить до анестезии и предупреждать в ход< операции гиповолемию, регулировать ЦВД, используя «улучшенное» положений сидя (рис. 26.1). При снижении ЦВД и артериального давления ножной конец стола поднимают, а при повышении ЦВД опускают, снижая темп инфузии. Постоянно выслушивают тоны сердца или проводят допплерографию [Michei; felder J. et al., 1972]. Разумеется, применяют и все другие меры профилактики: ИВЛ с постоянным перемежающимся положительным давлением, бинтование ног, замазывание воском ячей в костях черепа. При развившейся эмболии (коллапс, кошачье мурлыканье) отсасывают воздух из правого желудочка и используют вазопрессоры.
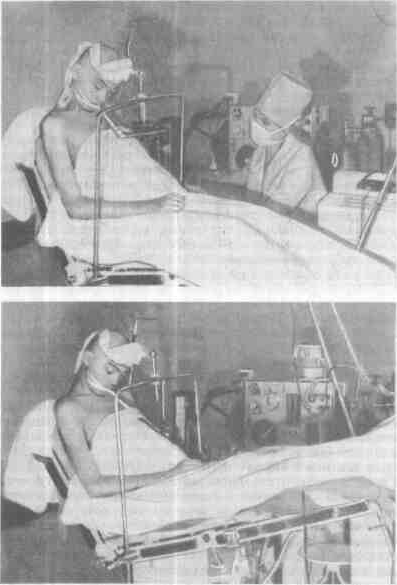
Рис. 26.1.Положение больного сидя [Маневич А 3, Салалыкин В И., 1977].
а (слева) —обычное положение со спущенными ногами (постуральные реакции резко выражены), б (справа) — улучшенное положение (опасность сердечно-сосудистого коллапса и воздушной эмболии минимальна)
Поддержание анестезии.Общие анестетики, используемые в периоде поддержания, должны: 1) не повышать внутричерепное давление; 2) быстро элиминироваться из организма, чтобы не нарушать неврологическую симптоматику; 5) быть минимально токсичными даже при очень длительном применении; 4) не создавать опасность воспламенения и взрыва (постоянное использование диатермокоагуляции!), 5) сочетаться с другими препаратами, используемыми и этом периоде,— миорелаксантами, ганглиоблокаторами, вазопрессорами и др. В большинстве случаев в качестве основного анестетика используют закись азота. В безопасных концентрациях (Fio2=0,25) она обеспечивает при нейрохирургических вмешательствах лишь выключение сознания и аналгезию, но не предупреждает избыточных нейроэндокринных реакций и двигательного возбуждения. При этом если FiN2О составляет 0,7 и более, то внутричерепное давление на этапах до вскрытия твердой мозговой оболочки повышается на 30—60%, что создает угрозу вклинения [Столкарц И.3., 1984]. В связи с этим закись йота применяют в более низких концентрациях (FiN2o=0,5—0,6), которые не грожают нарастанием внутричерепной гипертензии, а адекватную анестезию обеспечивают добавлением ингаляционных или неингаляционных анестетиков, нейролептиков и центральных анальгетиков.
В известной мере о методах анестезии, используемых в настоящее время в нейроанестезиологии, можно судить на основании данных, полученных нашим отрудником В.И. Салалыкиным (1985). Всего в Институте нейрохирургии (М.Н.Н. Бурденко АМН СССР в 1985 г. было проведено 3803 анестезии. Только 4 вмешательства, главным образом стереотаксические, осуществлены под местным обезболиванием и 185 — под электроанестезией. Примерно равное число оперативных вмешательств выполнено под внутривенной анестезией (нейролептаналгезия, атаралгезия) — 923 (25%) и ингаляционной анестезией фторотаном — 835 (22%). Однако если рассматривать соотношение различных методов не только при оперативных вмешательствах, но и при исследованиях, то станет ясно, что число неингаляционных анестезий почти в 2,5 раза превышает количество ингаляционных (соответственно 2481 и 1005). Правда, при стереотаксических вмешательствах эти соотношения изменяются: у 2/3 больных используется ингаляционная анестезия.
Из ингаляционных анестетиков, несмотря на общеизвестные недостатки, наиболее часто используют фторотан (1—1,5 об.%). Следует только учитывать, что артериальная гипотензия и снижение сердечного выброса при фторотановой анестезии сопровождаются увеличением кровенаполнения мозга, что служит основной причиной усиления внутричерепной гипертензии при использовании этого анестетика. Хотя поданным большинства авторов, повышение внутричерепного давления можно предупредить гипервентиляцией, у больных с внутричерепными объемными процессами, особенно локализованными супратенториально, лучше не применять данный анестетик до того момента, когда будет вскрыта твердая мозговая оболочка.
К сожалению, негативное воздействие метоксифлурана заставляет ограничить его использование или вовсе отказаться от этого препарата. Однако в наблюдениях, проведенных в клинике, отмечена большая ценность его при вмешательствах на сосудах мозга (предупреждение вазоспазма) [Емельянов В.К., и др., 1976].
Возможности использования эфира для моноанестезии и в качестве ингредиента комбинированной анестезии, по-видимому, исчерпаны. Обладая известными достоинствами и недостатками, он, кроме того, повышает внутричерепное давление, полностью нивелируя в концентрации 6—8 об. % благоприятный эффект снижения этого параметра, достигаемый при анестезии смесью закиси азота и кислорода (1:1) с гипервентиляцией [Столкарц И.3., 1978]. Общая анестезия эфиром, как и азеотропной смесью фторотана и эфира, при нейрохирургических вмешательствах должна быть резервирована для особых обстоятельств (при проведении анестезиологического пособия в примитивных условиях).
С 1962 г., когда появились сообщения Е. Pierce и соавт. о благоприятных эффектах (с позиций нейроанестезиологии) комбинированной анестезии, включающей применение тиопентал-натрия, интерес к этому методу то угасает, то повышается. Его безусловными достоинствами являются устранение внутричерепной гипертензии, профилактика гипоксических поражений мозга и управляемость анестезией. На фоне подачи закиси азота в потоке кислорода (2:1 — 1:1) 1 —1,5% раствор тиопентал-натрия вводят фракционно из расчета 2—3 мг/кг. Через 20—30 мин после этого и прекращения подачи закиси азота начинается стадия пробуждения (разумеется, если не повреждены срединные структуры мозга).
Этот метод анестезии не показан (точнее, противопоказан) больным с уже нарушенной гемодинамикой (гиповолемия, синдром низкого сердечного выброса) и нарушениями белкового обмена, а таких больных в нейрохирургии очень много. Тиопентал-натрий приходится заменять диазепамом (0,2—0,3 мг/кг) или натрия оксибутиратом (50—70 мг/кг). Но при этом значительно ухудшается управляемость анестезией и в случае замедленного пробуждения трудно установить его причину (действие препарата или повреждение срединных структур).
Широкое распространение получила нейролептаналгезия, правда, не в чистом виде, а как часть комбинированной анестезии (барбитураты + закись азота). При этом практически не наблюдается таких ее осложнений, как угнетение дыхания, повышение бронхиального сопротивления, экстрапирамидных расстройств. Одновременно сохраняются все достоинства метода: управляемость функциональным состоянием мозга, стабильность гемодинамики даже в положении сидя, отсутствие тошноты и рвоты в периоде пробуждения и, главное, надежная защита от ноцицептивных стимулов и предупреждение избыточных нейроэндокринных реакций.
После индукции одновременно с ингаляцией закиси азота в потоке кислорода медленно вводят дроперидол (0,25 мг/кг). Через 5 мин, если нет нарушений гемодинамики, эту дозу повторяют. Затем вводят фентанил ('/so дозы дроперидола). Поддержание анестезии осуществляют введением 100—200 мкг фентанила примерно каждые 30—40 мин в зависимости от адекватности анестезии (отсутствие тахикардии, гипертензии, двигательной реакции). Дроперидол используют в дозе, составляющей половину первоначальной через 1—2 ч.
Мышечные релаксанты. Методика их применения несколько отличается от общепринятой в связи с тем, что патологический процесс в нервной системе, особенно, если он сочетается с гипервентиляцией, подавляет активность дыхательного центра и мышечный тонус. Зато миорелаксанты в обычных дозах могут давать чрезмерный ганглиоблокирующий эффект, особенно при возвышенном положении больного, поэтому любые миорелаксанты используют в меньших дозах и с большими интервалами. Дитилин, исключая интубацию, вводят в дозе 40—60 мг 2—3 раза на протяжении 2 ч операции. Очень редко его приходится вводить чаще. Недеполяризующие миорелаксанты, например тубо-курарин, пипекуроний, применяют в дозе, равной 2/3 обычной (20—30 мг тубокурарина), а последующие дозы (через 1,5—2 ч анестезии) составляют не более половины первоначальной.
У больных с поражением головною и спинного мозга лучше не осуществлять декураризацию, а продолжить ИВЛ до полною прекращения действия миорелаксантов, поскольку оценка рекураризации часто затруднена из-за уже имевшихся или возникших после операции параличей.
Специальные компоненты анестезии.В зависимости от локализации и характера патологического процесса в ЦНС ведущее значение приобретает какой-либо из специфических компонентов: управление функциональной активностью, внутричерепным давлением, мозговым кровотоком и т.д. Но все же центральное место в нейроанестезиологии принадлежит управлению внутричерепными объемами и давлениями, т.е. фактически предупреждению внутричерепной гипертензии. Еще раз подчеркнем, что наилучшие условия и, следовательно, наименьшая травматичность оперативных вмешательств достигается с помощью специфических компонентов, но только при идеальном соблюдении общих принципов анестезиологии, в первую очередь обеспечении проходимости дыхательных путей, адекватного газообмена и стабильной гемодинамики.
Обеспечение доступа (управление внутричерепными объемами и давлениями). Условно внутричерепное содержимое состоит из следующих объемов: самого мозга (клетки и межклеточная жидкость), крови (в артериях, капиллярах и венах) и цереброспинальной жидкости. Поражение нервной системы нарушает их нормальные соотношения (локальное или диффузное увеличение объема самого мозга при опухолях, травме, абсцессах, отеке и др., увеличение кровенаполнения, в частности при травме мозга у детей, увеличение объема цереброспинальной жидкости при нарушении ее циркуляции). Но даже если до операции нет таких патологических объемов, доступ к глубинным образованиям возможен лишь при снижении суммарного объема внутричерепного содержимого с целью создания оперативного простора и уменьшения травматизации мозга. Для этого предложены различные методы, обычно временно уменьшающие один из указанных объемов. При уже имеющейся патологии целесообразно направить усилия на нормализацию (уменьшение) патологически увеличенного объема, т.е. сочетать проведение анестезии с интенсивной терапией. В настоящее время используются следующие основные методы.
Постуральный «дренаж». При свободной проходимости ликворных путей в положении Фовлера, а тем более в положении сидя снижается объем цереброспинальной жидкости в полости черепа и облегчается доступ к глубинным образованиям. Однако уменьшение суммарного объема длится недолго, так как компенсаторно возрастает внутричерепной объем крови. Данный метод, являющийся базовым для других методов, чаще всего сочетают с гипервентиляцией, применением салуретиков или искусственной гипотонией.
Люмбальный и вентрикулярный дренаж. У больных с нормальным внутричерепным давлением с помощью спинномозговой пункции (реже катетера) выводят 10—15 мл цереброспинальной жидкости. Если отмечается внутричерепная гипертензия, то метод допустимо использовать лишь после того, как все готово для рассечения твердой мозговой оболочки. Иначе при выведении даже небольшого количества цереброспинальной жидкости могут развиться вклинение и необратимое повреждение мозга.
При вмешательствах на задней черепной ямке и при гидроцефалии осуществляют вентрикулопункцию и цереброспинальную жидкость выводят непосредственно из желудочков. Важно учитывать, что избыточное выведение ее может способствовать коллабированию мозга, обрыву вен и субдуральной гематоме.
Салуретики. Наиболее часто внутривенно вводят фуросемид в дозе 20—40 мг (1 2 мл 2% раствора). Через несколько минут начинается обильный шурез. Эффект препарата продолжается около 3 ч. Уменьшение объема ткани мозга, межклеточной и цереброспинальной жидкости достигается за счет общей 1егидратации (гиповолемия!) с одновременной потерей Na + , K+ и С1-. При этом снижаемся реакция сосудов на катехоламины, усиливается действие тубокурарина и ганглиоблокирующих препаратов. Учитывая быстроту эффекта препарата, целесообразно использовать его для облегчения доступа не сразу, а лишь тогда, когда постуральный дренаж и гипервентиляция оказываются неэффективными. Следует учесть, что почти аналогичный, во всяком случае достаточный, эффект, обеспечивает медленное внутривенное введение 4—10 мл 2,4% раствора эуфиллина. Его не следует вводить больным с артериальной гипотонией и нарушениями ритма сердца по типу тахиаритмий.
Осмодиуретики. Для обеспечения доступа и борьбы с остро развившимся во время нейрохирургического вмешательства отеком мозга используют осмотические диуретики — мочевину, маннитол, глицерин. Их главное достоинство — быстрое действие, поэтому в критических ситуациях они незаменимы. Для обеспечения же доступа они являются средствами резерва в тех случаях, когда другие методы неэффективны или противопоказаны.
Мочевину применяют в дозе 1 г/кг в виде 30% раствора на 10% растворе глюкозы (раствор готовят ex tempore), предварительно подогревая его до 22— 25 °С Раствор вводят со скоростью 100—140 капель в минуту Уже через 15—30 мин наступает релаксация мозга.
Аналогично (по дозам и темпу введения) применяют 20% раствор манни-тола и 20% раствор глицерина (специально для внутривенного введения!)
Уменьшение объема мозга достигается за счет дегидратации преимущественно межклеточныхх пространств и уменьшения объема цереброспинальной жидкости на фоне общей дегидратации организма и гиповолемии, поэтому необходимо компенсировать водные и электролитные потери (при использовании мочевины из-за усиления кровоточивости нужно применять гемостатики), не опасаясь феномена «рикошета». Последний имеет большое значение при повторном длительном использовании осмодиуретиков, что не относится к рассматриваемой проблеме.
Важное место в уменьшении внутричерепных объемов занимает ИВЛ в режиме гипервентиляции — при PaО2 около 4 кПа (30 мм рт ст ) При этом уменьшается кровенаполнение мозга за счет сужения сосудов Кровенаполнение снижает и управляемая гипотония, но объем сосудистого русла при этом увеличивается (за исключением случаев применения натрия нитропруссида). Гипотермия уменьшает объем ткани мозга, но, разумеется, применять ее лишь для обеспечения доступа нецелесообразно.
Таким образом, в распоряжении анестезиолога имеется много методов управления внутричерепными объемами и давлениями Важны не сами методы, а соблюдение следующих принципов.
1) необходимо учитывать двухфазный эффект любого метода, снижающего внутричерепное давление (после окончания действия препарата или метода давление может вновь повыситься и даже стать больше исходного);
2) любой метод изменяет преимущественно один из объемов, вызывая противоположно направленный эффект других компонентов;
3) желаемого уменьшения внутричерепного объема (давления) лучше достичь сочетанием методов, а не интенсивным применением какого-либо одного метода;
4) любой метод нарушает механизмы ауторегуляции, поэтому нужно постоянно контролировать внутричерепное давление на протяжении всего периода управления этим параметром,
5) следует корригировать функции жизненно важных органов и систем, нарушенные методами, направленными на снижение внутричерепных объемов, в первую очередь водно-злектролитный обмен.
Управляемая гипотония безусловно показана при вмешательствах по поводу аневризм (особенно гигантских) сосудов головного мозга. Однако этот метод часто используют и при удалении богато васкуляриюванных опухолей (менингиомы, ангиоэндотелиомы).
Применяя управляемую гипотонию в неироанестсмиолог ии, необходимо решить две противоположные задачи обеспечить максимальное уменьшение кровокжа в аневризме или опухоли и предупредить ишемическое поражение мозга. Опасность последнего усугубляется отдавливанием мозга для обеспечения доступа к патологическим образованиям, что на фоне искусственной гипотонии ведет к запустеванию сосудов (ректракционная ишемия).
Можно считать доказанным, что снижение систолического артериального ывления до 60 мм рт ст на 30—40 мин является безопасным [Маневич и др., 1974; Eckenhoff J. et al., 1963] Однако иногда необходимо более глубокое снижение аргериального давления. Предлагалось даже полностью прекращать кровообращение но под защитой гипотермии [Brown A et al., 1966]. В большинстве случаев при нейрохирургических вмешательствах достаточно указанных выше уровня и продолжительности гипотонии.
Артериальное давление снижают с помощью ганглиоблокирующих препаратов — пентамина, арфонада и др Пентамин вводят внутривенно в дозе 10-15 мг, после чего оценивают эффект и углубляют гипотонию дополнительным введением 20—50 мг. Длительность действия одной дозы от 20 до 60 мин. Арфонад вводят в виде 0,1% раствора на 5% растворе глюкозы (1 мг/мл) со скоростью 60— 80 капель в минуту. Через 2—4 мин после введения 20—30 мг достигается необходимый уровень гипотонии. Для его поддержания продолжают вводить препарат со скоростью 40—60 кап/мин.
С середины 70-х годов в нейроанестезиологии для проведения управляемой гипотонии все шире используют натрия нитропруссид. Исследованиями, проведенными отечественными и зарубежными авторами (в частности, в нашей клинике В.И. Салалыкиным и сотр ), показано, что являясь прямым вазодилататором, этот препарат надежно обеспечивает вазоплегию, причем действием его легко управлять. При этом мозговой кровоток или не изменяется или несколько увеличивается (рис 26.2). Единственная серьезная специфическая шасность — отравление цианидами. Однако это бывает только в том случае, если превышают допустимую суммарную дозу. Нитропруссид вводят капельно в 0,01% растворе, и практически артериальное давление изменяется (снижается или повышается) тотчас после изменения скорости введения препарата.
Ряд факторов усиливает действие веществ, используемых для управляемой гипотонии при нейрохирургических вмешательствах. Это возвышенное положение, при котором доза уменьшается в 2 раза, а в положении сидя вообще нет необходимости в таких препаратах. Существенно уменьшают дозы на фоне анестезии фторотаном, неиролептаналгезии и при использовании тубокурарина.
Для уменьшения отрицательного воздействия снижения артериального давления на мозг к управляемой гипотонии приступают непосредственно перед тем этапом операции, когда это необходимо. Только при вмешательствах по поводу артериальных аневризм давление стремятся снижать с того момента, как начинают подход к аневризме, чтобы предупредить разрыв. Если необходимо длительное и глубокое снижение артериального давления, то дополнительно вводят тиопентал натрий по описанной методике.
Управляемая гипотермия. В настоящее время этот метод используют в нейроанестезиологии очень редко. Однако следует согласиться с Vlichenielder и соавт. (1982) в том, что по мере усложнения вмешательств на глубинных структурах интерес к гипотермии может возродиться. Пракгически методика проведения гипотермии не отличается от ее методики в других областях анестезиологии. Следует только учитывать, что температура мозга может быть выше центральной температуры тела, поэтому целесообразно дополнительно охлаждать голову или магистральные сосуды шеи. В эксперименте разрабатываются методы зксгракорпоральной гипотермическои перфузии головы для целей нейрохирургии (удаление гигантских аневризм и базальных опухолей. Однако эти методы еще не могут быть рекомендованы для клинического применения.
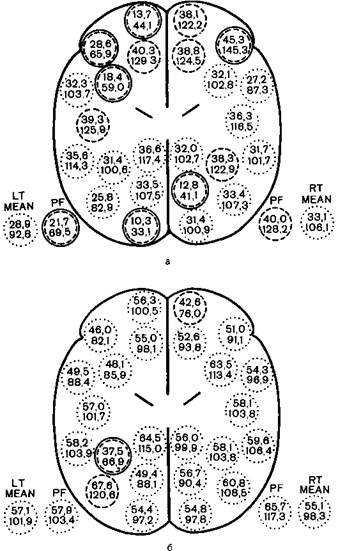
Рис. 26.2.Изменение мо и овен о кровотока при управляемой гипотонии на фоне атаралгезии. Сканограмма.
а - на фоне атаралгезии, б – на фоне управляемой гипотонии натрия нитропруссидом .
Стабилизация гематоэнцефалического барьера. Этот компонент анестезии приобретает наибольшее значение в послеоперационном периоде. Однако и во время вмешательства тяжелые его нарушения могут явиться одной из причин вспучивания мозга, нарушений микроциркуляции. Профилактические меры следует принимать уже в начале анестезии. Это в первую очередь введение глюкокортикоидных гормонов, которые, помимо того, что дают общеизвестные эффекты, непосредственно стабилизируют мембраны сосудов мозга и, по-видимому, эпендимы желудочков. Следует учесть, что само нейрохирургическое вмешательство и ряд препаратов, в частности мочевина, могут не только усиливать проницаемость мембран, но и локально нарушать состояние свертывающе-противосвертывающей системы. Если уже возникли нарушения мозгового кровотока, то у больных с глиальными опухолями при длительных микрохирургических вмешательствах целесообразно использовать такие препараты, как этамзилат, добезилат-кальций и ингибиторы протеолиза (гордокс, контрикал). Эта проблема мало изучена, но ее значение будет возрастать по мере увеличения радикальности вмешательств на глубинных структypax мозга.
Функциональная активность мозга. Практически все вещества, используемые для премедикации и общей анестезии, обратимо угнетают функциональную активность мозга. Тем самым предупреждаются избыточные реакции на патологическое воздействие. По мнению ряда авторов ленинградской школы нейроанестезиологов, необходимо усиливать этот компонент нейро-вегетативной блокадой срединных структур мозга. Большинство же отечественных и зарубежных авторов считают достаточным нейровегетативную стабилизацию, достигаемую обычными методами. Более того, сохранение в определенной степени этих реакций необходимо для того, чтобы после операции возникла нормальная метаболическая реакция — обязательное условие благоприятного течения послеоперационного периода [Данелия Т.3., 1986; Bennotti P. et al., 1979].
По специальным показаниям, например с целью выявления эпилептогенного очага при хирургическом лечении эпилепсии, необходимо стимулировать функциональную активность мозга. Чаще всего для этого используют гипервентиляцию.
По данным D. Flemming и соавт. (1980), оптимальные условия для выявления эпилептического фокуса создает энфлуран.
Оценка анестезии (мониторинг). В нейрохирургии мониторинг показателей гемодинамики и газообмена является обязательным при вмешательствах на головном и спинном мозге. Гипер- и гипотензия или нарушения сердечного ритма свидетельствуют не столько об осложнениях анестезии, сколько о реакциях мозга на манипуляции в тех его зонах, которые непосредственно связаны с регулированием витальных функций.
Особый интерес представляют методы, позволяющие оценивать функциональное состояние мозга, мозговой кровоток и метаболизм. Наиболее широко применяют регистрацию спонтанной биоэлектрической активности мозга электроэнцефало- и элекгрокортикография). Хотя у многих больных ЭЭГ уже изменена, все же можно дифференцировать влияние патологического очага, анестезии, осложняющих факторов, ведущих к гипоксии мозга, и раздражения специфических структур. Большое значение этот метод имеет при эндартерэкомии внутренней сонной артерии. Разумеется, для квалифицированной оценки необходима специальная подготовка.
Вероятно, важную информацию можно получить методами регистрации вызванной биоэлектрической активности мозга — так называемые вызванные погенциалы, используемые в послеоперационном периоде [Greenberg R. et al., 1980].
В последнее время показана ценность соматосенсорных вызванных поонциалов (ССВП) для своевременного распознавания ишемической гипоксии мозга, в частности при управляемой гипотонии (рис. 26.3).
К сожалению, пока не существует методов интраоперационной оценки мозгового кровотока, кроме визуальною наблюдения за сосудами. Ряд авторов рекомендуюг регистрировать Р02 в луковице яремной вены, хотя достоверность этого показателя с точки зрения диагностики гипоксии оспаривается [Larson С., et al., 1967]
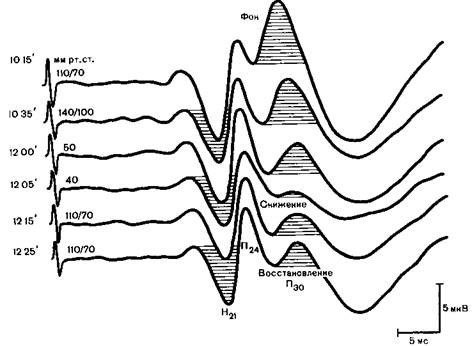
Рис. 26.3.Динамическая регистрация ССВП, позволяющая своевременно распознать ишемию — гипоксию мозга (наблюдение Г.А. Щекутьева).
10.15 — исходный ССВП амплитуда компонентов H21, П24, П30 в пределах нормальных значений (1 мкВ), 10.35—анестезия закисью азота (FiN2O)= 0,7), фентанилом, дроперидолом, амплитуда всех компонентов, особенно П30, снижается, 12.00— начало клипирования аневризмы правой среднемозговой артерии, управляемая гипотония нагрия нитропруссидом амплитуды всех компонентов по сравнению с таковыми на предыдущем этапе существенно не изменилось, 12.05 — дальнейшее снижение систолического артериального давления выраженное снижение амплитуды всех компонентов, особенно П30, 12.15 прекращение гипотонии начало восстановления амплитуды всех компонентов, 12.25 - полное восстановление амплитуды компонентов
Дата добавления: 2015-03-09; просмотров: 1516;
