Основы кинетики химических реакций
Процесс горения характеризуется быстрым протеканием реакций окисления горючих компонентов топлива кислородом воздуха, при котором имеет место значительное тепловыделение и создается высокий уровень температуры. Реакции с выделением теплоты называются экзотермическими. Преимущественное тепловыделение при горении топлив определяется содержанием в топливе углерода. Горение углерода в основном характеризуется протеканием трех химических реакций:
полное окисление углерода кислородом с образованием диоксида углерода
| С + О2 = СО2 + 409,1, МДж/моль; | 4.1 |
частичное окисление с выходом монооксида углерода
| 2С + О2 = 2СО + 2·123,3 МДж/моль; | 4.2 |
доокисление монооксида до диоксида в объеме около поверхности горения
| 2СО + О2 = 2СО2 + 2·285,8 МДж/моль. | 4.3 |
Реакции по уравнениям (4.1) и (4.2) являются гетерогенными, так как в реакции участвуют горючее и окислитель, находящиеся в разном фазовом состоянии: твердое горючее и газообразный окислитель-кислород. Реакция по уравнению (4.3) относится к гомогенной, так как здесь оба вещества, вступающие в реакцию, являются газообразными (возможны гомогенные реакции веществ в жидком состоянии).
В условиях высоких температур в ядре факела могут протекать реакции с поглощением теплоты, которые являются эндотермическими. К эндотермическим реакциям, например, относится реакция образования оксидов азота
| N2 + О2 = 2NO - 180 кДж/моль, | 4.4 |
или восстановление диоксида углерода на раскаленной поверхности углерода при недостатке кислорода
| С + СО2 = 2СО - 162,5 МДж/моль. | 4.5 |
Реакция является химически обратимой, если может идти как в прямом, так и в обратном направлении, однако внешние условия для протекания реакции в том или другом направлении могут существенно различаться. Так, реакция образования оксидов азота имеет место только в зоне высоких температур, а обратная реакция их разложения на газообразные кислород и азот протекает в земной атмосфере под действием солнечной радиации. При горении топлива в топочных камерах скорость прямого процесса окисления горючих кислородом несоизмеримо больше скорости обратного, поэтому химическое равновесие этих реакций смещено в сторону образования конечных продуктов, и в указанных условиях эти реакции можно считать необратимыми.
Однако всегда по мере роста концентрации продуктов в реакции и температуры в зоне горения находится в равновесии с конечными продуктами какое-то количество исходных веществ. Этот процесс связан с термической диссоциацией части образовавшихся продуктов сгорания. В топочных камерах при температуре горения выше 1600 °С подвергаются термической диссоциации в заметном количестве диоксид углерода СО2 и водяные пары Н2О
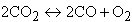
| |
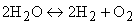
| 4.6 |
Таким образом, в зоне высоких температур горения всегда останется небольшое количество СО, Н2 и O2, догорание которых возможно при более низких температурах.
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимается массовое количество вещества, реагирующее в единице объема и в единицу времени. Скорость реакции в этом случае измеряется по изменению концентрации одного из реагирующих веществ. Например, в реакции (4.3) средняя скорость реакции wр, моль/(м3·с), за промежуток времени Δτ, с, имеет выражение
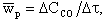
| 4.7 |
где ΔCCO - изменение концентрации СО в объеме, моль/м3.
Скорость гетерогенных реакций (4.1) и (4.2) КS, г/(м2·с), выражается количеством углерода Δg, г, прореагировавшим с кислородом на единице поверхности контакта S, м2, в единицу времени Δτ, с:
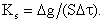
| 4.8 |
Скорости реакций подчиняются закону действующих масс, согласно которому в однородной среде при постоянной температуре в каждый момент времени скорость реакции пропорциональна произведению концентраций реагирующих веществ с учетом числа молей. Так, для уравнения (4.3) скорость реакции составит
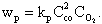
| 4.9 |
Здесь kР - константа скорости реакции, зависящая от температуры и химической природы реагирующих веществ.
В условиях гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции на основе закона действующих масс будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива
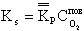
| 4.10 |
Здесь CПОВO2- концентрация кислорода у поверхности топлива. При неизменной концентрации реагирующих веществ во времени (постоянный подвод топлива и окислителя в зону горения) скорость реакции зависит от константы скорости реакции kР, 1/с, по закону Аррениуса
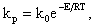
| 4.11 |
где k0 - предэкспоненциальный множитель, 1/с; Е - энергия активации, кДж/моль; R - универсальная газовая постоянная, кДж/(моль·К); Т - абсолютная температура процесса, К. Константа скорости реакции kр и энергия активации Е называются кинетическими константами реакции, которые определяют реакционные свойства топлива.
Химическая реакция может происходить при столкновении молекул, вступающих в реакцию веществ. Если бы все столкновения приводили к реакциям, то горение происходило бы с огромной скоростью и константа скорости равнялась бы k0. В действительности реакция может произойти только в том случае, когда за счет соударения произойдет разрушение старых молекулярных связей и образовавшиеся осколки молекул (заряженные радикалы) смогут перегруппироваться и создать молекулы новых веществ.
Энергия, достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации E. Так, при горении кокса по реакции (4.1) энергия активации зависит от вида кокса: для кокса бурого угля Е = 92…105 МДж/моль, для кокса каменных углей Е = 117…134 МДж/моль, для антрацита Е = 147 МДж/моль. В результате число молекул NE ,обладающих необходимым уровнем энергии Е, определяется статистическим законом Максвелла-Больцмана
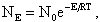
| 4.12 |
где N0 - полное число молекул в единице объема. Энергия активации зависит не только от энергии межатомных связей в молекулах, но и от того, в каком состоянии находятся вступающие в реакцию вещества. При высоких температурах в зоне реакции за счет диссоциации молекул с более слабыми внутренними связями накапливается определенное количество заряженных частиц (радикалов) типа ОН-, Н+, О2-, которые легко вступают в промежуточные реакции с исходными молекулами (такие реакции имеют низкие значения Е) и способствуют ускорению реакций горения.
На рис. 4.1 показана зависимость константы скорости kР и скорости реакции wР от определяющих факторов. Рост скорости химической реакции с температурой на известном уровне тормозится аэродинамическим фактором - возможностью доставки в зону горения окислителя (кислорода), определяемым скоростью диффузионного массообмена kД, который слабо зависит от температуры (рис. 4.1, а). Повышение энергии активации требует больше энергетических затрат на каждый акт реакции, что ведет к торможению скорости (рис. 4.1, б).
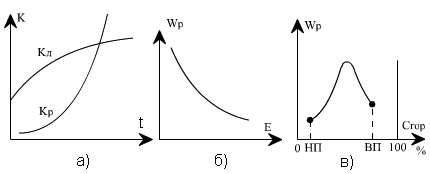
Рис. 4.1. Кинетические характеристики процесса горения: а - зависимость константы реакции горения kр и диффузионного массообмена kд от температуры; б - изменение скорости реакции wр от энергии активации Е; в - изменение скорости реакции при повышении концентрации горючего вещества Сгор в смеси с воздухом; НП, ВП - нижний и верхний пределы концентрации, соответствующие горению
В топочных устройствах происходит постоянная подача топлива и окислителя в зону горения, и, следовательно, в ядре горения сохраняется практически постоянная концентрация реагирующих веществ во времени. В этих условиях максимальная скорость реакции может быть достигнута при соотношении концентраций исходных веществ, близком к стехиометрическому, когда в результате реакции не остается избытка любого из них (рис. 4.1, в). При избытке горючего (богатая смесь) или при малой его концентрации (бедная смесь) скорость реакции снижается из-за уменьшения тепловыделения на единицу объема. Как видно, существует нижний предел концентрации горючего (НП), ниже которого горение становится невозможным, и верхний предел (ВП), когда дальнейшее увеличение концентрации горючего в смеси также прекращает горение. Во всем диапазоне концентраций между этими пределами горение возможно.
При сгорании горючей смеси в замкнутом объеме и отсутствии отвода теплоты в процессе реакции тепловыделение передается продуктам сгорания и приводит к максимальному повышению их температуры.
Этим условиям отвечает понятие теоретической (адиабатной) температуры горения ТТЕОР =Та. Наивысшее ее значение достигается при подводе окислителя в строгом соответствии с химической формулой (при стехиометрическом соотношении горючего и окислителя). Эту температуру часто называют жаропроизводительностью топлива.
В топочных устройствах всегда имеет место отвод теплоты из зоны реакции к поверхностям нагрева. С повышением температуры в зоне основного горения увеличивается и отвод теплоты, далее по мере выгорания топлива тепловыделение снижается, а вместе с ним происходит спад температуры продуктов сгорания, так как теплоотвод сохраняется достаточно высоким (рис. 4.2).
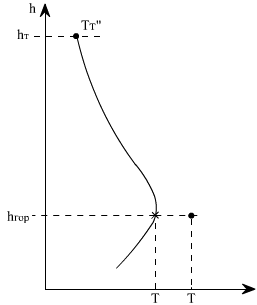
| Рис. 4.2. Изменение температуры газов по высоте топки hт: hгор - высота расположения горелок |
Температура смеси, начиная с которой система способна к самоускорению реакции до устойчивого горения, называется температурой воспламенения. Эта температура не является постоянной для реагирующих веществ и зависит от условий отвода теплоты из зоны реакции. Тепловыделение в ходе реакции горения топлива (при постоянной концентрации реагирующих веществ) определяется скоростью реакции в данных условиях и теплотой горения топлива
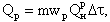
| 4.13 |
где mwР - скорость реакции по сгорающему топливу, кг/(м3·с); QРН -теплота горения топлива, кДж/кг.
Из (4.13) следует, что тепловыделение QР определяется только изменением скорости реакции wР. Скорость реакции, в свою очередь, зависит от константы диффузионного массообмена kД и константы химической реакции kР на поверхности топлива. При этом в области низких температур скорость реакции wР ограничивается константой kР, а в области высоких температур условиями массообмена у поверхности топлива константой kД. В итоге на графике кривая wР = f(T) имеет два перегиба (см. рис. 4.3).
Теплоотвод из зоны реакции в окружающую среду (к тепловоспринимающим поверхностям) выражается формулой
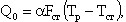
| 4.14 |
где α - коэффициент теплоотдачи, кВт/(м2·К); FСТ - тепловоспринимающая поверхность, м2; ТР, TСТ - температуры в зоне реакции и у поверхности стен, К.
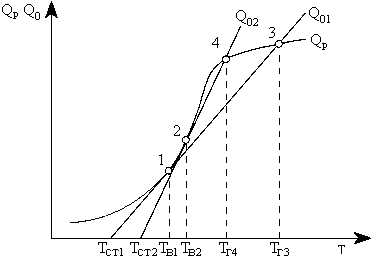
| Рис.4.3. Графическое определение температуры воспламенения ТВ, горения ТГ при разной интенсивности теплоотвода к стенам топки (Q02 > Q01): QР - тепловыделение в результате реакции горения; ТСТ - температура стен (экранов) топки. Из (4.14) следует, что при постоянстве условий отвода теплоты из зоны реакции (α = const) теплоотвод изменяется линейно в зависимости от разности температур TР - ТСТ. |
На рис.4.3 показан характер изменения значений QР и Q0 от температуры. Точка 1 касания кривой QР и линии теплоотвода Q0 соответствует температуре воспламенения ТВ, так как при любом отклонении от нее значение QР> Q0 и происходит саморазогрев горючей смеси и рост тепловыделения за счет реакций окисления. Точка пересечения 3 кривой QР и линии Q0 характеризует наивысшее устойчивое тепловыделение, а соответствующая температура - температура горения ТГ3. Как видно на рис. 4.3, чем интенсивнее теплоотвод из зоны горения (круче наклон линии отвода 2-4, выше ТСТ2, так как α2 > α1), тем выше температура воспламенения топлива ТВ2 и ниже температура горения ТГ4.
Дата добавления: 2015-02-28; просмотров: 1782;
