Трансдукция и геном человека
В 1955 году Джошуа Ледерберг предположил, что трансдуцирующие вирусы можно использовать для введения генов в клетки человека. В то время такая идея казалась чистой фантазией, но сейчас она все более и более приобретает черты реальности, особенно в свете развития технологии рекомбинант-ных ДНК, описанной в гл. 12.
Трансдукцию можно использовать для того, чтобы: 1) внедрить доминантные «хорошие» гены и исправить наследственный дефектный фенотип; 2) внедрить гены в пищевые растения и увеличить их полезность; 3) изменить бактерии так, чтобы они выполняли полезные биологические функции; 4) вызывать заболевание в определенном организме. Главный технический вопрос заключается в том, могут ли вирусы захватывать гены животных и внедрять их в другие клетки. Ответ на этот вопрос положительный. Например, если вирусом простого герпеса заразить штамм мышиных клеток, в которых отсутствует определенный белок (тимидинкиназа), то у 0,1% клеток появляется нормальный аллель. Нормальный аллель могли привнести только вирусы. Клетки с привнесенным аллелем довольно стабильны и производят тимидинкиназу на протяжении 8 месяцев. В других экспериментах используют аденовирусы и другие вирусы животных, с помощью которых переносят гены, например для лечения генетических заболеваний. Были выведены трансдуцирующие полиомовирусы, которые могут захватывать гены мыши и переносить их в ядро клетки человеческого эмбриона.
Некоторые медицинские технологии иногда разрабатываются до того, как удается определить этические правила их применения. В истории науки так бывало часто, например, когда Бантинг и Бест разрабатывали и тестировали опытные образцы инсулина или когда Кристиан Барнард поразил общественность заявлением об удачной трансплантации сердца. То же можно сказать и о трансдукции генов в клетки человека. В 1958 году Стэнли Роджерс изучал вирус папилломы Шопа, которая вызывает повреждения кожи у кроликов. Он обнаружил у инфицированных клеток высокий уровень содержания фермента аргиназы, вызванный, по всей видимости, генами вируса. В сыворотке крови аргиназа расщепляет аминокислоту аргинин. Затем обнаружилось, что у трети сотрудников лаборатории, работавших с вирусом папилломы Шопа, уровень аргинина меньше обычного. Вероятно, вирус перенес ген аргиназы в клетки людей.
В 1970 году Роджерс узнал о семье из Германии, в которой две сестры (позже родилась третья) страдали от наследственной гипераргинемии, вызванной недостатком аргиназы. В их крови и костном мозге наблюдалось очень высокое содержание аргинина, которое часто приводит к замедлению умственного развития, параличу конечностей и эпилептическим припадкам. Роджерс внутривенно ввел девочкам (в возрасте 2 и 7 лет) вирус папилломы Шопа, а позже ввел его и их пятимесячной сестре. Однако остановить или замедлить развитие заболевания не удалось, и эксперимент сочли неудачным. Тем не менее, он заставляет задуматься, насколько свободно ученые должны экспериментировать с методами, имеющими огромные социальные последствия. Генную терапию попытались применить без всякого представления о вызываемом ею непосредственном эффекте, не говоря уже о долговременных последствиях. Это даже скорее не генная терапия, а технический эксперимент. Фридман и Роблин3 предупреждают, что такое поспешное и необдуманное экспериментирование может «послужить толчком для других попыток в ближайшем будущем», и ратуют за то, чтобы воздержаться от подобных попыток, пока не будет получена дополнительная информация. Роджерс на это возражает:
Когда на руках у врача пациент с безнадежно прогрессирующим заболеванием и когда известно, что ни диетические, ни какие другие меры не помогут, и когда имеется средство, предположительно способное остановить развитие заболевания, причем при помощи агента, подробно исследуемого на протяжении 40 лет, то почти не остается другого выхода, как попробовать им воспользоваться4.
Однако биологи редко вспоминают о том, что любой метод, способный исправить дефекты человеческой природы, почти с тем же успехом может быть использован и для того, чтобы намеренно вызвать такие дефекты у нормальных людей.
В 1971 году Карл Меррилл и его сотрудники заявили, что возможно лечить заболевания искусственно разводимых человеческих клеток при помощи трансдуцирующего фага лямбда. Они брали клетки кожи у пациентов, страдающих галактосемией, аутосомным рецессивным заболеванием, характеризующимся неспособностью превращать галактозу в глюкозу (сахар, из которого наш организм черпает энергию). Клетки этих людей не выполняют функцию, присущую одному из генов gal бактерии Е. coli. Заразив дефектные человеческие клетки штаммом, лямбда с бактериальными генами gal+, Меррилл и его коллеги получили клетки, в которых уровень необходимого фермента был даже выше обычного. Сами по себе эти эксперименты еще не являются окончательным доказательством трансдукции генов, как и эксперименты Роджерса. Тем не менее, опыты Меррилла позволяют предположить, что фаг лямбда может встраивать бактериальные гены в клетки человека и вызывать заметный эффект. Как мы увидим в дальнейшем, сейчас разработаны еще более изощренные способы переноса генов из одного организма в другой. Таким образом, в этой главе мы увидели, как такая, казалось бы, узко специфическая отрасль биологии, как бактериальная генетика, может повлиять на развитие научной мысли и иметь далеко идущие последствия для общества. Например, бактериальные плазмиды и вирусы можно использовать в качестве векторов, которые переносят фрагменты ДНК. Эксперименты с плазмидами и вирусами показали, что они могут реплицировать гены, перемещать их из одной клетки в другую и вставлять дополнительные фрагменты в геном клетки-хозяина. Эти ключевые явления послужили отправной точкой дош развития техники клонирования ДНК и генетической инженерии, о которых говорится в гл. 12.
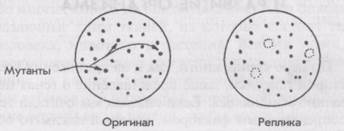
| Отбор мутантов Отбор мутантных бактерий, таких как /s (чувствительные к температуре), или ауксотрофные штаммы, обычно начинается с выращивания бактерий и подвергания их воздействию мутагена, то есть вещества или фактора (например, ультрафиолетового света), вызывающего мутации. Если мы хотим получить мутант ts, то нам нужно сделать посев клеток в чашку с агаром и держать их при низкой температуре (28°С), пока не образуется достаточное количество колоний. Затем мы берем цилиндр, конец которого покрыт круглым куском бархатной ткани приблизительно того же диаметра, что и чашка, и слегка промокаем поверхность культуры. Если посмотреть на бархат под микроскопом, можно понять, почему раствор бактерий так легко впитывается в него: бархат представляет собой своего рода спутанный клу- |
| бок крохотных иголок. Затем мы промокаем этим куском бархата поверхность чашки с чистым раствором, перенося колонии бактерий на новое место и получая реплику первой чашки, то есть ее точную копию. Затем реплику нагреваем до температуры 42°С и сравниваем чашки: |
|
| Бактерии, не выросшие на реплике, очевидно, имеют мутацию ts, и их можно отобрать и вырастить для дальнейших исследований. При помощи метода реплик первую чашку можно копировать много раз и тестировать реплики в разных условиях. Например, в первой чашке может содержаться весь набор аминокислот, необходимых для роста бактерий, а реплику можно сделать в чашке с отсутствием некоторых аминокислот, например триптофана. Бактерии, не выросшие в новой среде, скорее всего, являются ауксотрофами trp кодон) (UAG, UGA или UAA), который служит сигналом для прекращения синтеза полипептидной цепи. |
Глава одиннадцатая
Дата добавления: 2015-02-28; просмотров: 855;
