Обнаружение сульфатов в почве
Берут пипеткой 3 мл почвенный вытяжки, добавляют несколько капель концентрированной соляной кислоты и 3 мл 20%-го раствора хлорида бария. Раствор в пробирке медленно нагревают до кипения. Если в почве содержатся сульфат-ионы, то появляется белый мелкокристаллический осадок:
Na2SO4 + BaCl2 = BaSO4 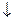 + 2NaCl
+ 2NaCl
или в ионном виде:
SO42- + Ba2+ = BaSO4 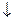
По характеристике полученного осадка можно сделать предположение о содержании сульфат-иона (табл. 19).
Таблица 19
Определение содержания сульфат-иона
по характеристике осадка
| Осадок | Содержание SO42- | |
| мг/100 мл вытяжки | г/100 г почвы, % | |
| Медленно появляется слабая муть (заметна на черном фоне) | 0,5 – 1 | Тысячные доли |
| Муть, появляющаяся сразу | 1 – 10 | Сотые доли |
| Продолжение таблицы 19 | ||
| Большой осадок, быстро оседающий на дно | Десятые доли |
Сульфат ионы могут быть связаны с токсичными солями Na2SO4 и MgSO4.
Результаты исследования занести в табл. 4 и сравнить с ПДК.
Контрольные вопросы
1. Какие формы химических элементов в почве относят к легкорастворимым? Перечислите. Почему они так называются?
2. К чему приводит избыток растворенных в почве солей?
3. Какие типы почв являются засоленными? В какой части почвы накапливаются минералы?
4. Определение наличия хлорид-сульфат ионов и карбонатов в лабораторной работе проводят с помощью качественных реакций. На чем основано обнаружение ионов?
5. Почему для хлорид- и сульфат-ионов большие значения предельных концентраций, а для нитратов и нитритов – маленькие? Мотивируйте.
УИРС
Дата добавления: 2015-02-23; просмотров: 1246;
