Краткие теоретические сведения. Диаграмма состояния представляет собой графическое изображение фазового состава сплава в равновесном состоянии в зависимости от температуры и концентрации
Диаграмма состояния представляет собой графическое изображение фазового состава сплава в равновесном состоянии в зависимости от температуры и концентрации. Под сплавом понимают вещество, полученное сплавлением двух и более химических элементов. Сплав, состоящий преимущественно из металлических элементов и обладающий металлическими свойствами, называют металлическим сплавом. Химические элементы, образующие сплав, называются компонентами.
Фазой называют однородную часть системы, имеющую одинаковый состав, кристаллическое строение и свойства, одно и то же агрегатное состояние и отделенную от остальных частей поверхностью раздела, при переходе через которую вышеуказанные свойства изменяются скачкообразно.
Совокупность фаз, находящихся в равновесии, называют системой.
В сплавах, в зависимости от физико-химического взаимодействия компонентов, могут образовываться следующие фазы: жидкие растворы (далее не рассматриваются), твердые растворы, химические соединения, механическая смесь нескольких фаз.
Твердыми растворами называют фазы, в которых один из компонентов сплава сохраняет свою кристаллическую решетку, а атомы другого (или других) компонента располагаются в решетке первого компонента, изменяя ее размеры (период). Твердые растворы подразделяются на твердые растворы замещения и внедрения.
Твердый раствор замещения образуется путем замены атомов основного элемента (растворителя) атомами другого компонента (растворяемого). Эти растворы могут быть: с неограниченной растворимостью, когда компоненты обладают полной растворимостью друг в друге, и с ограниченной растворимостью, когда компоненты только частично растворяются друг в друге. Условия существования неограниченной растворимости: близкие температуры плавления компонентов, близкие размеры атомов, одинаковый тип решеток.
Твердые растворы внедрения образуются путем внедрения атомов растворенного элемента в кристаллическую решетку растворителя и размещения их между атомами растворителя. Эти растворы могут иметь только ограниченную растворимость компонентов. Причем количество растворенного вещества зависит от температуры; с понижением температуры растворимость уменьшается, что приводит к выделению вторичных фаз из твердых растворов.
Если два или несколько компонентов вступают в химическую реакцию, то образующееся вещество называется химическим соединением. Химическое соединение имеет свою собственную кристаллическую решетку, отличную от решеток компонентов, собственные связи и обладает собственными новыми свойствами. Между компонентами в химическом соединении сохраняется строгое стехиометрическое соотношение, которое можно записать химической формулой, и поэтому химической соединение является фазой постоянного состава.
Механические смеси могут состоять из чистых компонентов, твердых растворов, химических соединений и т. д. Различают простую, эвтектическую и эвтектоидную механические смеси.
Процессы, протекающие в металлах и сплавах при фазовых превращениях, подчиняются правилу фаз:
С = К + 1 - Ф,
где С – число степеней свободы, т. е. количество независимых переменных (например, концентрация компонентов, температура и давление), изменение которых не приводит к изменению состояния равновесия системы, т. е. к изменению числа фаз, находящихся в равновесии;
К – число компонентов, образующих систему;
Ф – число фаз, находящихся в равновесии;
1 – число внешних факторов (температура).
Типы диаграмм состояния. Диаграмму состояния строят в координатах «температура – концентрация». Таким образом, каждая точка диаграммы отвечает определенному составу сплава при определенной температуре в условиях равновесия. Тип диаграммы состояния зависит от характера взаимодействия компонентов, т. е. от того, какие фазы в твердом состоянии образуют компоненты друг с другом.
Диаграмма состояния сплавов, образующих неограниченные твердые растворы. Два компонента А и В с температурами плавления соответственно ТА и ТВ в жидком и твердом состоянии полностью растворяются друг в друге.
Линию ТАаТВ, (рис. 5.1 а) называют линией ликвидус. Линия ликвидус – это геометрическое место точек (температур) начала кристаллизации сплавов. Выше линии ликвидус сплавы находятся в жидком состоянии (Ж).
Линию ТАвТВ называют линией солидус. Линия солидус – это геометрическое место точек (температур) конца кристаллизации сплавов. Ниже линии солидус все сплавы находятся в твердом состоянии (α-твердый раствор). Между линиями ликвидус и солидус сплавы состоят из двух фаз: жидкой и твердой.
Для определения количества жидкой и твердой фаз и их химического состава (концентрации) при любой температуре, лежащей между линиями ликвидус и солидус, используют правило отрезков.
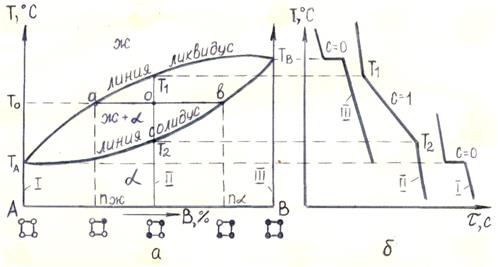
Рисунок 5.1 – Диаграмма состояния сплавов, образующих неограниченные твердые растворы (а) и кривые охлаждения (б)
Пусть требуется определить объемное содержание и химический состав (концентрацию) жидкой и твердой фазы в точке о (при температуре То и концентрации сплава II) (рис. 5.1 а). С этой целью через точку о проводят горизонтальную линию, параллельную оси концентрации, называемую конодой, до пересечения с линиями ликвидус и солидус (линия аов). Точка пересечения коноды с линией ликвидус (точка а), спроецированная на ось концентрации, покажет химический состав жидкой фазы (nж) при температуре То (рис. 5.1. а). Точка пересечения коноды с линией солидус (точка в), спроецированная на ось концентрации, покажет химический состав твердой фазы (nα) при той же температуре.
Для определения количества жидкой или твердой фаз при температуре То (рис. 5.1 а) нужно взять отношение длины отрезков, расположенных противоположно составу фаз, к длине всей коноды. В нашем случае объемное содержание жидкой (Vж) и твердой (Vα) фаз в сплаве будет равно соответственно:
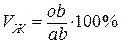 ,
,
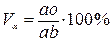 .
.
Рассмотрим кривые охлаждения чистых компонентов и сплавов (рис. 5.1 б). Температура охлаждаемого чистого компонента равномерно понижается (С=1+1-1=1) (моновариантная система) до температуры ТА, при которой компонент А переходит в твердое состояние. Процесс кристаллизации компонента А происходит при постоянной температуре (горизонтальное плато на кривой охлаждения) (рис. 5.1 б, кривая 1), т. к. согласно правилу фаз, две фазы – твердая и жидкая – могут находиться в равновесном состоянии только при строго постоянной температуре (С=1+1-2=0) (нонвариантное состояние). После кристаллизации компонента А температура снова будет равномерно понижаться. Аналогично может быть рассмотрена кристаллизация компонента В (рис. 5.1 б, кривая III).
При охлаждении сплава II кристаллизация с образованием α-твердого раствора начинается при температуре Т1 (рис. 5.1 б) и заканчивается при температуре Т2, т. е. кристаллизация сплава протекает в интервале температур Т1 - Т2. На кривой охлаждения отмечается перегиб. Согласно правилу фаз, число степеней свободы С=1 (С=2+1-2=1). При дальнейшем снижении температуры происходит охлаждение только α-твердого раствора.
Аналогично кристаллизируются и другие сплавы этой системы.
Диаграмма состояния сплавов, образующих механические смеси из чистых компонентов. Два компонента А и В с температурами плавления соответственно ТА и ТВ в жидком состоянии неограниченно растворимы, а в твердом состоянии нерастворимы друг в друге.
Линия ТАСТВ является линией ликвидус, линия ТЭСD – линией солидус или эвтектической горизонталью (рис. 5.2 а). При охлаждении сплава при температурах, соответствующих линии ТАС, начинают выделяться кристаллы компонента А, а при температурах, соответствующих линии СТВ, кристаллы компонента В. При температуре Тэ, соответствующей линии ТЭСD, из жидкости концентрации точки С одновременно выделяются кристаллы А и В. Образующаяся механическая смесь называется эвтектикой. Эвтектическое превращение – это превращение, при котором жидкость определенного состава при постоянной температуре кристаллизуется одновременно в смесь двух твердых фаз.
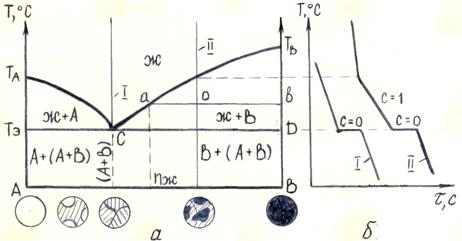
Рисунок 5.2 – Диаграмма состояния сплавов, образующих механические смеси из чистых компонентов (а) и кривые охлаждения (б)
Сплав I называется эвтектическим. Кривая охлаждения эвтектического сплава показана на рис. 5.2 б, кривая I. При температуре ТЭ кривая переходит в горизонтальное плато, свидетельствующее о том, что кристаллизация эвтектики происходит при постоянной температуре (C=2+1-3=0).
Сплавы, расположенные слева от эвтектического сплава, называются доэвтектическими; расположенные справа – заэвтектическими.
Кривая охлаждения заэвтектического сплава II показана на рис. 5.2 б, кривая II.
Для определения количества жидкой и твердой фаз и их химического состава (концентрации) при температурах, лежащих между линиями ликвидус и солидус, используют вышерассмотренное правило отрезков. Отличие заключается лишь в том, что коноду проводят от линии ликвидус до пересечения с одной из осей концентрации (рис. 5.2 а). Это свидетельствует о том, что твердая фаза кристаллизуется в доэвтектических сплавах в виде чистого компонента А, а в заэвтектических сплавах в виде чистого компонента В (рис. 5.2 а).
Диаграмма состояния сплавов с ограниченной растворимостью в твердом состоянии. Два компонента А и В с температурами плавления ТА и ТВ неограниченно растворимы в жидком состоянии и ограниченно в твердом. Твердый раствор атомов компонента В в кристаллической решетке компонента А называется α-раствором; твердый раствор А в В называется β-раствором. В зависимости от того, какая реакция протекает в условиях существования трех фаз (ж, α, β), в нонвариантном состоянии могут быть два вида диаграмм: с эвтектикой и перитектикой.
Диаграмма с эвтектикой. Линия ТАС ТВ является линией ликвидус; линия ТАDE ТВ – линией солидус (рис. 5.3 а). При концентрациях компонентов, соответствующих отрезку DE, сплавы испытывают эвтектическое превращение при температуре Тэ, (рис. 5.3 б, кривая I).
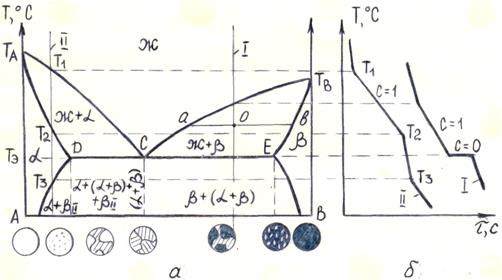
Рисунок 5.3 – Диаграмма состояния сплавов с ограниченной растворимостью в твердом состоянии (с эвтектикой) (а) и кривые охлаждения (б)
При охлаждении сплава II выделение твердого α-раствора начинается при температуре Т1 (рис. 5.3 а). При температуре Т2 кристаллизация заканчивается. Полученные кристаллы α-раствора не претерпевают изменения до температуры Т3. Ниже этой температуры твердый α-раствор является пересыщенным и выделяет избыточные кристаллы β-твердого раствора (рис. 5.3 а). Кривая охлаждения этого сплава представлена на рис. 5.3 б, кривая II.
Кристаллы β, выделившиеся из α-твердого раствора в результате ограничения растворимости в нем компонента В, называются вторичными кристаллами и обозначаются (βII), в отличие от первичных кристаллов β-твердого раствора, выделяющихся из жидкости.
Для определения количества жидкой и твердой фаз и их химического состава при температурах, лежащих между линиями ликвидус и солидус, используют вышерассмотренное правило отрезков (рис. 5.3 а).
Диаграмма с перитектикой. При перитектическом превращении жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов.
Линия ТАСТВ является линией ликвидус; линия ТАEDТВ – линией солидус (рис. 5.4 а), При концентрации компонентов в пределах отрезка СD сплавы испытывают перитектическое превращение при постоянной температуре ТП. Кривые охлаждения сплавов с перитектическим превращением представлены на рис. 5.4 б.
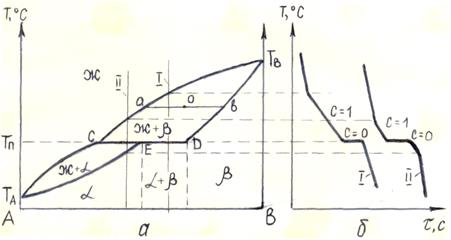
Рисунок 5.4 – Диаграмма состояния сплавов с ограниченной растворимостью в твердом состоянии (с перитектикой) (а) и кривые охлаждения (б)
Объемное содержание жидкой и твердой фаз и их химический состав определяются так же, как и в предыдущих случаях.
Диаграмма состояния сплавов, образующих устойчивое химическое соединение. Химическое соединение характеризуется определенным соотношением компонентов (AnBm). Это отражается на диаграмме вертикальной линией, проходящей через точку на оси абсцисс, отвечающую соотношению компонентов в химическом соединении (рис. 5.5). Твердыми фазами такой системы являются компоненты А, В и химическое соединение AnBm с температурой плавления L. Линия ТАE1LE2ТВ является линией ликвидус; линия СDFK – линией солидус. На диаграмме имеются две эвтектические точки E1 и E2 (рис. 5.5).
Так как химическое соединение плавится при постоянной температуре, его можно рассматривать как однокомпонентную систему. В этом случае диаграмму, представленную на рисунке 5.5, можно рассматривать как две диаграммы состояния сплавов, образующих механическую смесь кристаллов чистых компонентов, приставленные друг к другу. Отличие состоит лишь в том, что кроме выделения кристаллов чистых компонентов A и В, происходит еще образование кристаллов химического соединения AnBm. Построение кривых охлаждения, а также расчет объемного содержания жидкой и твердой фаз и их химического состава проводят так же, как для диаграмм состояния сплавов, образующих механическую смесь кристаллов чистых компонентов.
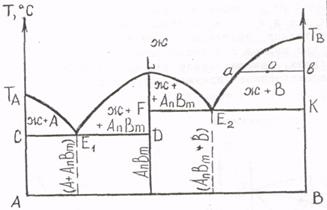
Рисунок 5.5 – Диаграмма состояния сплавов, образующих устойчивое химическое соединение
Дата добавления: 2015-02-19; просмотров: 2516;
