Принцип соответствия
С классической точки зрения электрон, вращающийся вокруг ядра должен излучать электромагнитные волны, так как он движется с центростремительным ускорением. По законам классической электродинамики, электромагнитные волны не излучают те заряды, которые движутся по прямой, с постоянной скоростью. Электрон, излучая свет, должен постепенно падать на ядро. Однако этого не происходит, атомы устойчивы. Устойчивостьатома, классическая механика объяснить не может. Выход, из создавшегося тупика, был найден в 1913 г. датским физиком Нильсом Бором.
Если бы электроны в атоме двигались по законам классической механики, они испускали бы свет всех частот. Однако опыты показали, что атомы испускают свет не всех частот, а только дискретных, точно определенных. Это означает, что электроны в атоме имеют не любую энергию, а только строго определенную.
Размышляя над этими данными и трудностями классической механики, Нильс Бор предложил более совершенную квантовую модель атома. При помощи этой модели, ему удалось объяснить устойчивость атома водорода и линейчатый спектр излучения. С этой целью, он выдвинул три гипотезы, известные под названием три постулата Бора.
Первый постулат Бора (постулат стационарных орбит) гласит: в атоме существует набор стационарных состояний, находясь в которых атом не излучает электромагнитные волны. Стационарным состояниям, соответствуют стационарные орбиты, по которым с центростремительным ускорением движутся электроны, при этом излучения света не происходит.
Второй постулат Бора (правило квантования орбит) гласит: в стационарном состоянии атома, электрон, движущийся по круговой орбите, имеет квантованные значениямомента импульса (L), удовлетворяющие условию: Ln=m 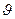 r=n
r=n  , где n=1, 2, 3,ּּּ, - называется главным квантовым числом, m – масса электрона,
, где n=1, 2, 3,ּּּ, - называется главным квантовым числом, m – масса электрона, 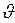 - его скорость, r – радиус n-ой орбиты, величина ћ=h/2π=1,054·10─34 Дж·с– называется постоянная Планка. Целое число nравно числу длин волн де Бройля для электрона, укладывающегося на длине круговой орбиты: n=2π r/λ = 2π r m
- его скорость, r – радиус n-ой орбиты, величина ћ=h/2π=1,054·10─34 Дж·с– называется постоянная Планка. Целое число nравно числу длин волн де Бройля для электрона, укладывающегося на длине круговой орбиты: n=2π r/λ = 2π r m 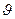 / h
/ h
Гениальность Бора в том, что он впервые угадал квантованность момента импульса и открыл дорогу к созданию квантовой механики.
Третий постулат Бора (правило частот) гласит : при переходе атома из одного стационарного состояния в другое испускаетсяилипоглощается один фотон. Излучение фотона происходит, при переходе атома из состояния с большей энергией в состояние с меньшей энергией. При обратном переходе происходит поглощение фотона. Энергия фотона (hν) равна разности энергий в двух состояниях атома: Wn–Wm=hν. При Wn > Wm происходит излучение фотона, при Wn < Wm - его поглощение.
Постулаты Бора позволили определить частоты линий (ν) в дискретном линейном спектре атома водорода. Он вычисляется по формуле Бальмера-Ридберга: ν=R(1/n2–1/m2), где R=mee4/8 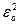 h3 – постоянная Ридберга (R=3,2931ּ1015 с-1), me – масса электрона, ε0=8,85ּ10 -12Ф/м – электрическая постоянная. Целые числа n и m называются главными квантовыми числами, причем m = n+1, n+2 и т.д. Группа линий водородного спектра: n=1 – серия Лаймана, n=2 – серия Бальмера, n=3 – серия Пашена, n=4 – серия Брэкета, n=5 – серия Пафунда, n=6 – серия Хамфери.
h3 – постоянная Ридберга (R=3,2931ּ1015 с-1), me – масса электрона, ε0=8,85ּ10 -12Ф/м – электрическая постоянная. Целые числа n и m называются главными квантовыми числами, причем m = n+1, n+2 и т.д. Группа линий водородного спектра: n=1 – серия Лаймана, n=2 – серия Бальмера, n=3 – серия Пашена, n=4 – серия Брэкета, n=5 – серия Пафунда, n=6 – серия Хамфери.
Для водородоподобных ионов найдена формула Бальмера-Ридберга: ν=Z2R(1/n2–1/m2), где Z – порядковый номер элемента. Энергия водородоподобного иона, в состоянии с главным квантовым числом nопределяется по формуле: Wn=–Z2Rh/n2. Абсолютная величина Wn является энергией связи электрона в атоме. Наименьшее значение W1 соответствует основному (нормальному) состоянию атома. Все значения энергии, при n>1 соответствуют возбужденным состояниям атома. Время жизни электрона в возбужденном состоянии ограничено, оно составляет не более τ=10─8 с. Наибольшее значение энергии WМАКС=0 при n→∞ соответствует ионизации атома или иона, т.е. отрыву электрона от него. Энергия ионизации атома – это энергия связи электрона в атоме или ионе.
Объяснение спектральных линий водорода было большим успехом теории Бора. Квантовые постулаты Бора были лишь первым шагом в создании квантовой теории атома. Теория Бора, по сути, является частным случаем теории квантовой механики. Согласно, принципу соответствия, всякая неклассическая теория, в соответствующем предельном случае переходит в классическую. Теория Бора для многоэлектронных атомов не имела применения, т.к. была несовершенной.
12.2. Создание квантовой механики. Принцип неопределенности. Принцип «запрета» Паули.
Квантовая механика – это теория о состоянии и законах движения микрочастиц и их систем, а также связи величин, характеризующих частицы, с физическими величинами, непосредственно измеряемыми на опыте. В начале ХХ века выяснилось, что классическая механика имеет ограниченную область применения и нуждается в обобщении. В описании движения и состояние микрочастиц в микромире, ее заменила квантоваямеханика, а при движениях с большими скоростями ( 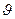
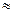 c) ее заменила релятивистская(относительная) механика.
c) ее заменила релятивистская(относительная) механика.
Законы квантовой механики позволили выяснить строение атомов, природу химических связей, периодичность системы элементов, строение атомного ядра, свойства элементарных частиц, температурную зависимость теплоемкости газов, жидкостей и твердых тел, явления ферромагнетизма, сверхтекучесть, сверхпроводимость, а также природу нейтронных звезд, белых карликов, механизмы термоядерных реакций на Солнце и звездах и др.
Квантовая механика была создана за 30 лет, в промежутке 1900 – 1930 годов, усилиями многих ученых мира. В 1900 году немецкий физик Макс Планкпоказал, что свет испускается не непрерывно, а определенными «порциями» энергию – квантами. Величина энергии кванта (Е) определяется по формуле Планка E=hν, где h = 6,62∙10─34 Дж∙с.и является постоянной Планка, а ν - частота излучения. В 1905 году А. Эйнштейн, при разработке теории фотоэффекта, подтвердил точку зрения М. Планка. Эйнштейн пришел к выводу о том, что свет не только испускается и поглощается, но и распространяетсяквантами – фотонами. В 1922 году, американский физик А. Комптон, изучая рассеивание света свободными электронами, доказал корпускулярный характер света. Таким образом, было установлено, что свет наряду с волновым свойством обладает и корпускулярным свойством, т.е. свет обладает дуализмом. В 1924 году французский физик Луи де Бройль выдвинул гипотезу о том, что все элементарные частицы обладают дуализмом. Дуализм элементарных частиц отражается в формуле длины волны де Бройля: λБ=h/p=h/m 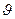 , где λБ – длина волны де Бройля; р – импульс частиц; m - масса, а
, где λБ – длина волны де Бройля; р – импульс частиц; m - масса, а 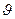 – скорость частиц. В 1927 г. К. Дэвиссон и Л. Джермер, экспериментально, обнаружили дифракцию электрона и тем самым подтвердили гипотезу Луи де Бройля.
– скорость частиц. В 1927 г. К. Дэвиссон и Л. Джермер, экспериментально, обнаружили дифракцию электрона и тем самым подтвердили гипотезу Луи де Бройля.
В 1926 году австралийский физик Э. Шредингер предложил два уравнения, описывающие поведение волны де Бройля во внешних силовых полях. Первое уравнение называют стационарным уравнением Шредингера. Решение уравнения Шредингера, при конкретных условиях, дает возможность определить место нахождения частиц и их энергию.
Второе уравнение называют временным уравнением Шредингера. Решение второго уравнения дает возможность вычислить координаты и потенциальную энергию частицы, в зависимости от времени.
В 1932 г. английский физик-теоретик Поль Дирак заложил основы релятивистской квантовой механики. Он, обобщил уравнение Шредингера, на случай частиц со спином ћ/2, движущихся со скоростью, сравнимой со скоростью света. Он описывает движение электрона во внешнем силовом поле. Уравнение Дирака представляет собой систему из четырех уравнений. Основное следствие уравнения Дирака состоит в том, что наряду с частицами должны существовать античастицы, отличающиеся от частиц только знаком заряда. Так, на кончике пера Дирак предсказал существование позитрона – античастицы электрона. Уравнение Шредингера и релятивистское уравнение Дирака составляют основу квантовой механики. В дальнейшем квантовую механику развили выдающиеся физики: Н. Бор, В. Гейзенберг, М. Борн, П. Иордан, В. Паули и др.
Анализ флуктуации физических величин, характеризующих микрочастицу и его состояние, в 1927 году позволил Гейзенбергу сформулировать принцип неопределенности. Согласно ему, одновременно нельзя точно определят и флуктуация импульса, и флуктуация координаты микрочастиц. Анализ спектра атомов, привел к представлению о том, что электрон (и все элементарные частицы) обладает внутренней характеристикой вращательного момента – спин.Представление о спине, позволило В. Паули (1925) сформулировать принцип запрета, согласно, которому два электрона не могут находиться в одном и том же квантовом состоянии. Этот принцип имел фундаментальное значение для построения теории атома, квантовой химии, теории твердого тела и др.
Дата добавления: 2015-02-19; просмотров: 1143;
