Теплота “сгорания” воздуха
Каким бы сложным ни был состав углеводородного топлива, при его полном сгорании углерод окисляется до СO2, водород — до Н2O, сера — до SO2. Формально полное окисление серы соответствует образованию SO3, однако при топочных температурах SO3 практически не образуется. Окислителем обычно служит воздух. Количество его должно быть, естественно, достаточным для полного сгорания всех горючих элементов. Балансовые уравнения, показывающие исходные и конечные состояния участвующих в реакциях компонентов, называются стехиометрическим и.
В соответствии со стехиометрическим уравнением реакции горения водорода
Н2 + 0,5О2 = Н2О
на 2 кг, т. е. на 1 кмоль водорода, необходимо затратить 16 кг (0,5 кмоль) кислорода, при этом образуется 18 кг водяного пара. Аналогично из реакций
C + O2 = CO2
S + O2 = SO2
следует, что на 12 кг углерода и 32 кг серы нужно затратить по 32 кг кислорода, при этом получается соответственно 44 кг CO2 и 64 кг SO2. Следовательно, для полного сгорания 1 кг углерода теоретически требуется затратить 2,67 кг кислорода, а 1 кг серы и водорода соответственно 1 и 8 кг кислорода. Часть необходимого кислорода, равная 0,01 Оr кг/кг, содержится в топливе, остальное в количестве 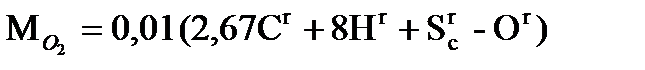 нужно подать с воздухом. Плотность кислорода в нормальных условиях равна 1,43 кг/м3 (молекулярная масса, деленная на объем 1 киломоля, т.е. 32/22,4), содержание кислорода в сухом воздухе составляет по объему 0,21. Следовательно, объем воздуха (приведенный к нормальным условиям), теоретически необходимого для полного сжигания 1 кг топлива, равен, в м3/кг,
нужно подать с воздухом. Плотность кислорода в нормальных условиях равна 1,43 кг/м3 (молекулярная масса, деленная на объем 1 киломоля, т.е. 32/22,4), содержание кислорода в сухом воздухе составляет по объему 0,21. Следовательно, объем воздуха (приведенный к нормальным условиям), теоретически необходимого для полного сжигания 1 кг топлива, равен, в м3/кг,
V° = 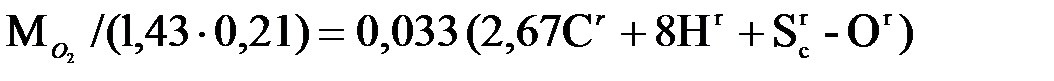
Выше указывалось, что теплоту, выделяющуюся в реакции горения, принято относить к единице массы топлива, называя теплотой его сгорания. Поскольку в реакции в равной мере участвуют и горючие элементы (топливо), и кислород (воздух), эту теплоту можно отнести и к единице массы воздуха. Расчеты показывают, что отнесенная к единице полностью прореагировавшего воздуха теплота сгорания различных топлив несколько различается, однако в среднем ее можно принять равной 3,8 МДж на 1 м (в нормальных условиях) действительно прореагировавшего воздуха.Эта цифра удобна для приближенных расчетов, обеспечивающих точность в пределах 10—15 %. Поэтому для оценочных расчетов можно принять V°= 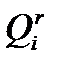 /3,8.
/3,8.
Поскольку равномерно перемешать воздух с топливом трудно, в топку приходится подавать больше воздуха, чем необходимо теоретически. Отношение количества воздуха VB, действительно поданного в топку, к теоретически необходимому 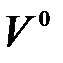 называется коэффициентом избытка воздуха:
называется коэффициентом избытка воздуха:
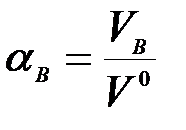
При нормальной организации топочного процесса 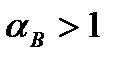 , причем чем совершеннее топка и лучше горелочные устройства, тем меньше приходится подавать «лишнего» воздуха. В лучших топочных устройствах
, причем чем совершеннее топка и лучше горелочные устройства, тем меньше приходится подавать «лишнего» воздуха. В лучших топочных устройствах 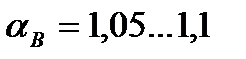 , в плохих — до 1,3…1,5.
, в плохих — до 1,3…1,5.
Дата добавления: 2015-02-16; просмотров: 1238;
