Спектр атома водорода по Бору
Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и водородоподобных систем — систем, состоящих из ядра с зарядом Zeи одного электрона (например, ионы Не+, Li2+), а также теоретически вычислить постоянную Ридберга.
Следуя Бору, рассмотрим движение электрона в водородоподобной системе, ограничиваясь круговыми стационарными орбитами. Решая совместно уравнение (208.1) mev2/r = Ze2/(4pe0r2),предложенное Резерфордом, и уравнение (210.1), получим выражение для радиуса n-й стационарной орбиты:
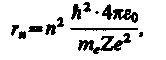 (212.1)
(212.1)
где n = 1, 2, 3, ... . Из выражения (212.1) следует, что радиусы орбит растут пропорционально квадратам целых чисел.
Для атома водорода (Z = 1) радиус первой орбиты электрона при n = 1, называемый первым воровским радиусом (а), равен
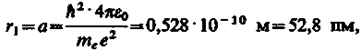 (212.2)
(212.2)
что соответствует расчетам на основании кинетической теории газов. Так как радиусы стационарных орбит измерить невозможно, то для проверки теории необходимо обратиться к таким величинам, которые могут быть измерены экспериментально. Такой величиной является энергия, излучаемая и поглощаемая атомами водорода.
Полная энергия электрона в водородоподобной системе складывается из его кинетической энергии (mev2/2) и потенциальной энергии в электростатическом поле ядра (-Ze2/(4pe0r):
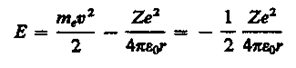
(учли, что 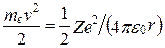 ; см. (208.1)). Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
; см. (208.1)). Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только следующие дозволенные дискретные значения:
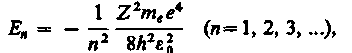 (212.3)
(212.3)
где знак минус означает, что электрон находится в связанном состоянии.
Из формулы (212.3) следует, что энергетические состояния атома образуют последовательность энергетических уровней, изменяющихся в зависимости от значения n. Целое число nв выражении (212.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние с n = 1 является основным (нормальным) состоянием; состояния с n > 1 являются возбужденными. Энергетический уровень, соответствующий основному состоянию атома, называется основным (нормальным) уровнем; все остальные уровни являются возбужденными.
Придавая n различные целочисленные значения, получим для атома водорода (Z= 1), согласно формуле (212.3), возможные уровни энергии, схематически представленные на рис. 294. Энергия атома водорода с увеличением n возрастает и энергетические уровни сближаются к границе, соответствующей значению n = ¥. Атом водорода обладает, таким образом, минимальной энергией (E1 = —13,55 эВ) при n =1. максимальной (E¥ = 0) при n = ¥. Следовательно, значение E¥ = 0 соответствует ионизации атома (отрыву от него электрона). Согласно второму постулату Бора (см. (210.2)), при переходе атома водорода (Z= 1) из стационарного состояния n в стационарное состояние m с меньшей энергией испускается квант
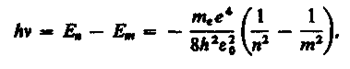
откуда частота излучения
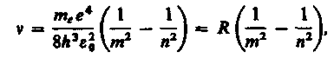 (212.4)
(212.4)
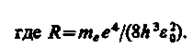
Воспользовавшись при вычислении R современными значениями универсальных постоянных, получим величину, совпадающую с экспериментальным значением постоянной Ридберга в эмпирических формулах для атома водорода (см. § 209). Это совпадение убедительно доказывает правильность полученной Бором формулы (212.3) для энергетических уровней водородоподобной системы.
Подставляя, например, в формулу (212.4) m =1 и n =2, 3, 4, ..., получим группу линий, образующих серию Лаймана (см. § 209) и соответствующих переходам электронов с возбужденных уровней (n =2, 3, 4, ...) на основной (m = 1). Аналогично, при подстановке m = 2, 3, 4, 5, 6 и соответствующих им значений n получим серии Бальмера, Пашена, Брэкета, Пфунда и Хэмфри (часть из них схематически представлена на рис. 294), описанные в § 209. Следовательно, по теории Бора, количественно объяснившей спектр атома водорода, спектральные серии соответствуют излучению, возникающему в результате перехода атома в данное состояние из возбужденных состояний, расположенных выше данного.
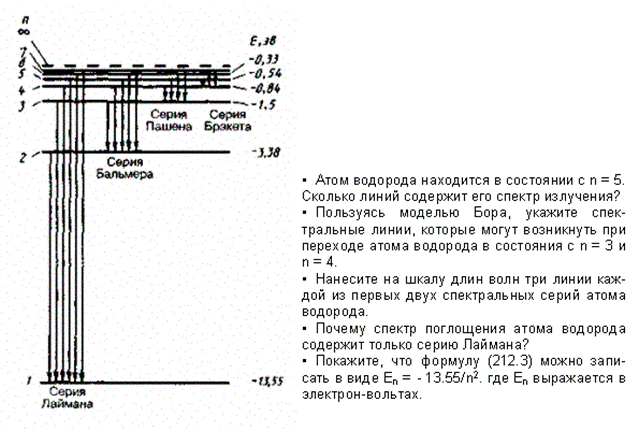
Рис. 294
Спектр поглощения атома водорода является линейчатым, но содержит при нормальных условиях только серию Лаймана. Он также объясняется теорией Бора. Так как свободные атомы водорода обычно находятся в основном состоянии (стационарное состояние с наименьшей энергией при n = 1),то при сообщении атомам извне определенной энергии могут наблюдаться лишь переходы атомов из основного состояния в возбужденные (возникает серия Лаймана).
Теория Бора была крупным шагом в развитии атомной физики и явилась важным этапом в создании квантовой механики. Однако эта теория обладает внутренними противоречиями (с одной стороны, применяет законы классической физики, а с другой — основывается на квантовых постулатах). В теории Бора рассмотрены спектры атома водорода и водородоподобных систем и вычислены частоты спектральных линий, однако эта теория не смогла объяснить интенсивности спектральных линий и ответить на вопрос: почему совершаются те или иные переходы? Серьезным недостатком теории Бора была невозможность описания с ее помощью спектра атома гелия — одного из простейших атомов, непосредственно следующего за атомом водорода.
Задачи
27.1. Определить максимальную и минимальную энергии фотона в ультрафиолетовой серии спектра атома водорода (серии Лаймана). [Emax =13,2 эВ, Emin = 10,2 эВ]
27.2. Определить длину волны, соответствующую границе серии Бальмера. [364 нм]
27.3. Используя теорию Бора, определить орбитальный магнитный момент электрона, движущегося по второй орбите атома водорода. [pm=enℏ/(2m) = 1,8×10-23 А×м3]
27.4. Используя теорию Бора, определить изменение орбитального механического момента электрона при переходе его из возбужденного состояния (n = 2) в основное с испусканием фотона с длиной волны l = 1.212×10-7 м. [DL=ℏ=1.05×10-34 Дж×с]
27.5. Определить потенциал ионизации атома водорода. [13,6 В]
27.6. Основываясь на том, что энергия ионизации атома водорода Ei = 13,6 эВ, определить второй потенциал возбуждения этого атома. [12,1 В]
27.7. Основываясь на том, что энергия ионизации атома водорода Ei =13,6 эВ, определить в электрон-вольтах энергию фотона, соответствующую самой длинноволновой линии серии Лаймана. [10,2 эВ]
Дата добавления: 2015-02-13; просмотров: 2938;
