Жидкие растворы
Жидкости, содержащие молекулы одного вида, называются чистыми.Реальные жидкости не могут быть идеально чистыми и представляют собой смесь различных веществ. Вещество, которое содержится в смеси в преобладающем количестве, называется растворителем, прочие компоненты называются раствореннымивеществами, а смесь в целом называется раствором. Подобно смеси газов, раствор является однофазной системой, в которой молекулы различных компонент равномерно перемешаны. Такие макроскопически однородные системы называются гомогенными.
Количественной характеристикой растворов является концентрация, определяющая содержание того или иного компонента в растворе. Весовой концентрацией некоторого компонента называется отношение веса этого компонента к весу всего раствора. Молярная концентрация некоторого компонента определяется отношением числа молей этого компонента в растворе к общему числу молей вещества в растворе. Объемной концентрациейкомпонента называется его количество в единице объема раствора, выраженное в весовых или молярных единицах.
Пример 11.5. Раствор состоит из 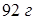 этилового спирта
этилового спирта 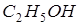 и
и 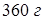 воды и занимает объем
воды и занимает объем 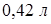 . Весовая концентрация спирта в растворе равна
. Весовая концентрация спирта в растворе равна 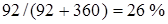 . Учитывая, что молярная масса воды
. Учитывая, что молярная масса воды 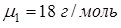 и молярная масса спирта
и молярная масса спирта 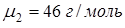 , находим, что раствор содержит
, находим, что раствор содержит 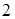 моля спирта и
моля спирта и 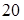 молей воды и его молярная концентрация равна
молей воды и его молярная концентрация равна 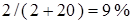 . Объемная концентрация спирта равна
. Объемная концентрация спирта равна 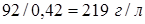 или
или 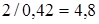 молей на литр.
молей на литр.
* * *
В химические соединения образующие их вещества входят в строго определенных количествах. Например, для образования 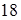 граммов воды требуется
граммов воды требуется 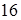 граммов кислорода и
граммов кислорода и 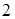 грамма водорода. Растворы отличаются от химических соединений тем, что относительные количества веществ в растворе могут меняться в более или менее широких пределах. Однако растворы не являются чисто механическими смесями молекул, поскольку между молекулами различных компонент имеет место взаимодействие. Одним из проявлений такого взаимодействия является тепловойэффект- выделение или поглощение тепла смесью при образовании раствора. Если тепловой эффект отсутствует или незначителен, то раствор называется идеальным. В частности, близки к идеальным слабые растворы, в которых концентрация растворенного вещества достаточно мала.
грамма водорода. Растворы отличаются от химических соединений тем, что относительные количества веществ в растворе могут меняться в более или менее широких пределах. Однако растворы не являются чисто механическими смесями молекул, поскольку между молекулами различных компонент имеет место взаимодействие. Одним из проявлений такого взаимодействия является тепловойэффект- выделение или поглощение тепла смесью при образовании раствора. Если тепловой эффект отсутствует или незначителен, то раствор называется идеальным. В частности, близки к идеальным слабые растворы, в которых концентрация растворенного вещества достаточно мала.
Бинарными называются растворы, состоящие из двух веществ - растворителя и растворенного компонента.
Растворенным в жидкости веществом может являться газ, находящийся над жидкостью. Как показывает опыт, имеет место закон Генри: концентрация газа, растворенного в жидкости, пропорциональна давлению газа над раствором.
В обмене веществ, происходящем в растениях и в живых организмах, большую роль играют перегородки (мембраны), которые проницаемы для молекул растворителя и непроницаемы для молекул растворенного вещества. Например, животный пузырь (оболочка желудка) проницаем для воды, но малопроницаем для спирта. Аналогичные перегородки могут быть созданы искусственно. Так, трековые мембраны, получаемые путем ионной «бомбардировки» полимерных пленок, проницаемы для молекул воды и малопроницаемы для ионов солей и металлов, что позволяет использовать такие мембраны для очистки воды от примесей. Пленка из железистосинеродистой меди проницаема для воды, но непроницаема для сахара, растворенного в воде.
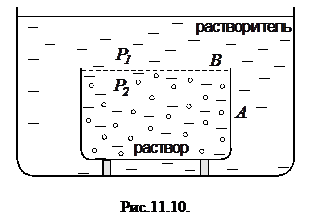 Рассмотрим закрытый сосуд
Рассмотрим закрытый сосуд  , заполненный раствором, стенка
, заполненный раствором, стенка 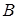 которого является полупроницаемой, рис. 11.10. Этот сосуд помещен в чистый растворитель. Молекулы растворенного вещества не могут из сосуда
которого является полупроницаемой, рис. 11.10. Этот сосуд помещен в чистый растворитель. Молекулы растворенного вещества не могут из сосуда  проникнуть в окружающий раствор вследствие непроницаемости для них перегородки
проникнуть в окружающий раствор вследствие непроницаемости для них перегородки 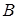 . Таким образом, через эту перегородку происходит лишь обмен молекулами растворителя между сосудами
. Таким образом, через эту перегородку происходит лишь обмен молекулами растворителя между сосудами  и
и 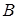 . Поскольку концентрация молекул растворителя в сосуде
. Поскольку концентрация молекул растворителя в сосуде  меньше, чем вне его, то результирующий поток молекул растворителя будет направлен в сосуд
меньше, чем вне его, то результирующий поток молекул растворителя будет направлен в сосуд  и давление в нем начнет возрастать. Возникнет разность давлений
и давление в нем начнет возрастать. Возникнет разность давлений  по разные стороны перегородки
по разные стороны перегородки 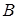 . Этот эффект называется осмосом. Через некоторое время встречные потоки молекул растворителя через перегородку
. Этот эффект называется осмосом. Через некоторое время встречные потоки молекул растворителя через перегородку 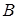 уравновесятся, при этом разность давлений прекратит изменяться, достигнув своего максимального значения
уравновесятся, при этом разность давлений прекратит изменяться, достигнув своего максимального значения  ,
,
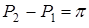 (11.13)
(11.13)
называемого осмотическим давлением. Как показывает опыт, для растворов, близких к идеальным, выполняется закон Вант-Гоффа, выражаемый уравнением:
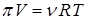 , (11.14)
, (11.14)
где 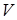 - объем раствора,
- объем раствора,  - его температура,
- его температура, 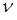 - число молей растворенного вещества,
- число молей растворенного вещества, 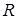 - универсальная газовая постоянная. Сходство равенства (11.14) с уравнением состояния идеального газа указывает на то, что молекулы растворенного вещества в идеальном растворе ведут себя так, как будто растворенное вещество находится в газообразном состоянии в объеме
- универсальная газовая постоянная. Сходство равенства (11.14) с уравнением состояния идеального газа указывает на то, что молекулы растворенного вещества в идеальном растворе ведут себя так, как будто растворенное вещество находится в газообразном состоянии в объеме 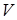 , занимаемом раствором.
, занимаемом раствором.
Задача 11.4. Осмотическое давление  раствора
раствора  глюкозы в объеме воды
глюкозы в объеме воды 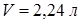 при температуре
при температуре 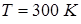 равно
равно 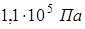 . Найти молярную массу глюкозы.
. Найти молярную массу глюкозы.
Ответ: 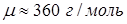 .
.
Указание. Учесть, что объем раствора практически равен объему воды ввиду малости количества растворенной глюкозы.
Дата добавления: 2015-02-05; просмотров: 1505;
