Строение и функции белка
Белки играют важнейшую роль в жизнедеятельности любых организмов. Многообразие и сложность живой материи, по сути дела, отражают многообразие и сложность самих белков. Каждый белок имеет свою уникальную функцию, которая определяется присущими ему структурой и химическими свойствами. Некоторые белки являются ферментами, т.е. катализаторами биохимических реакций в живых организмах. Каждая химическая реакция катализируется определенным ферментом. Без участия ферментов подобные реакции не происходят вовсе, или протекают крайне медленно, что бы обеспечить саму возможность существования живых организмов. Другие белки – структурные – выполняют в организме роль строительных белков – или сами по себе (например, коллаген), или в комплексе с нуклеиновыми кислотами (нуклеопротеины), углеводами (гликопротеины) или липидами (липопротеины). Некоторые белки, вовлеченные в систему запаса и транспорта кислорода, связываются с функционально важными металлосодержащими органическими молекулами. Так, например, миоглобин и гемоглобин специфически связывают железосодержащую группировку, называемую гемом.
Белки – это большие полимерные молекулы, построенные из мономерных аминокислотных звеньев. В состав белков входят двадцать различных видов аминокислот. Все белковые аминокислоты (за исключением пролина) характеризуются общей структурой (рис. 1), обязательными элементами которой являются: аминогруппа, карбоксильная группа, водород и какой-либо радикал.
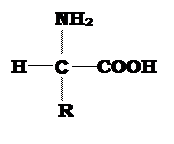
|
| Рис. 1 Структурная формула аминокислот. NH2 – аминогруппа; COOH – карбоксильная группа; (H – атом водорода); радикал R – боковая группа. |
Аминокислоты в белках связаны между собой прочными ковалентными пептидными связями, возникающими между карбоксильной группой одной аминокислоты и аминогруппой следующей кислоты. Образующийся в результате такого взаимодействия олигомер называют пептидом.Аминокислоты, входящие в состав пептида часто называют аминокислотными остатками (табл.1). Структурную основу любого пептида составляет зигзагообразный остов, образованный атомами углерода и азота.
Таблица 1
Классификация аминокислот по природе боковых групп
| Природа боковой группы | Название аминокислоты | Сокращение |
| Нейтральные | глицин | гли |
| Неполярные ароматические | триптофан | три |
| фенилаланин | фен | |
| тирозин | тир | |
| Неполярные серосодержащие | метионин | мет |
| цистеин | цис | |
| Неполярные алифатические | аланин | ала |
| лейцин | лей | |
| валин | вал | |
| изолейцин | иле | |
| пролин | про | |
| Полярные, содержащие ОН-группу | серин | сер |
| треонин | тре | |
| Полярные амиды | аспарагин | асн |
| глутамин | глн | |
| Полярные «–» заряженные | аспарагиновая кислота | асп |
| глутаминовая кислота | глу | |
| Полярные «+» заряженные | гистидин | гис |
| лизин | лиз | |
| аргинин | арг |
Дата добавления: 2015-01-10; просмотров: 757;
