Нарушение барьерной функции биологических мембран
Важную роль в повреждении мембран играют процессы их механического растяженияв результате нарушения осмотического равновесия в клетках. Если поместить эритроциты в гипотонический раствор, то вода будет входить в клетки, они примут сферическую форму, а затем произойдет гемолиз. Митохондрии также набухают в гипотонических средах, но происходит разрыв только внешней мембраны; внутренняя остается целой, хотя теряет способность задерживать небольшие молекулы и ионы. В результате митохондрии утрачивают способность к окислительному фосфорилированию.
Сходные явления наблюдаются и в целых клетках и тканях в условиях патологии. Так, в результате активации фосфолипазы А2 мембран митохондрий при гипоксии они становятся проницаемыми для ионов калия. Если в этих условиях восстановить оксигенацию ткани, то на мембранах митохондрий восстановится мембранный потенциал (со знаком «минус» внутри) и митохондрии будут «насасывать» ионы калия, вслед за которыми в матрикс входит фосфат. Концентрация ионов внутри митохондрий возрастает, и органеллы набухают. Это приводит к растяжению мембран и их дальнейшему повреждению.
Молекулярные механизмы увеличения проницаемости липидного слоя мембран для ионов.При изучении молекулярных основ проницаемости липидного слоя широко используются модельные мембранные системы: изолированные мембранные структуры (эритроциты, митохондрии, везикулы саркоплазматического ретикулума), а также искусственные фосфолипидные мембраны (бислойные липидные мембраны и фосфолипидные везикулы - липосомы). Изучение такого рода систем показало, что сам по себе липидный слой практически непроницаем для ионов. При действии различных химических и физических факторов он становится проницаемым по одной из трех причин (или их комбинаций):
1. В липидном бислое, микровязкость которого близка к вязкости оливкового масла, появляется жирорастворимое вещество, способное связывать ионы. Механизм переноса ионов в этом случае напоминает «перевоз пассажиров в лодке с одного берега на
другой» и называется «челночным», или переносом с помощью подвижного переносчика. Примером подвижного переносчика может служить ионофорный антибиотик валиномицин, который образует комплекс с ионами калия, растворимый в липидной фазе мембраны. К числу подвижных переносчиков, возможно, относятся водорастворимые продукты перекисного окисления липидов, в присутствии которых, как оказалось, увеличивается проницаемость мембраны для ионов водорода.
2. В липидном слое появляются вещества, молекулы которых, собираясь вместе, образуют канал через мембрану. Сквозь такой канал ионы могут проходить с одной стороны мембраны на другую. Каналы образуются молекулами некоторых антибиотиков, например грамицидина А и полимиксина. Продукты перекисного окисления липидов также могут образовывать каналы в липидном слое, если в растворе есть ионы кальция. Продукты расщепления некоторых фосфолипидов (в частности, кардиолипина) фосфолипазой А2 образуют каналы для одновалентных катионов.
3. Электрическая прочность липидного слоя мембраны снижается, и ее участок разрушается электрическим током, который возникает под влиянием разности потенциалов, существующей на мембране. Такое явление носит название «электрического пробоя» (см. ниже). Формирование в мембране «пор» с индукцией пробоя мембраны лежит в основе нарушений барьерной функции мембраны при адсорбции на липидном бислое полиэлектролитов, чужеродных для клетки белков, антител.
Свободные радикалы. Свободнорадикальное (перекисное) окисление липидов (ПОЛ). Хорошо известно, что в органических молекулах (включая те, из которых состоит наш организм) электроны на внешней электронной оболочке располагаются парами: одна пара на каждой орбитали. Свободные радикалы отличаются от обычных молекул тем, что у них на внешней электронной оболочке имеется неспаренный (одиночный) электрон. Это делает их химически активными, поскольку они стремятся вернуть себе недостающий электрон, отняв его от окружающих молекул и тем самым повреждая их. Свободные радикалы вступают в реакции с неорганическими и органическими соединениями - белками, липидами, углеводами, нуклеиновыми кислотами, инициируют аутокаталитические реакции, в ходе которых молекулы, с которыми они реагируют, также превращаются в свободные радикалы. Таким образом, сво-
бодные радикалы - высокоактивные молекулы, способные разрушать структуры клетки.
Основным источником радикалов является молекулярный кислород. К кислородным радикаламотносятся: NO* (оксид азота или нитроксид), RO* (алкоксильный радикал), RO*2 (перекисный или пероксидный радикал), O*2- (супероксидный анион-радикал или супероксид), HO*2 (гидроперекисный радикал, HO* (гидроксильный радикал).
В целом все радикалы, образующиеся в организме человека, можно разделить на природные и чужеродные. В свою очередь, природные радикалы можно разделить на первичные, вторичные и третичные (рис. 3-2).
Первичные радикалы- те радикалы, образование которых осуществляется при участии определенных ферментных систем (НАДФН-оксидазы, NO-синтазы, циклооксигеназы, липооксигеназы, монооксигеназы, ксантиноксидазы и др.). Прежде всего к первичным радикалам относятся семихиноны, образующиеся в реакциях таких переносчиков электронов, как коэнзим Q (обозначим радикал как Q*) и флавопротеины, O*2-, NO*.
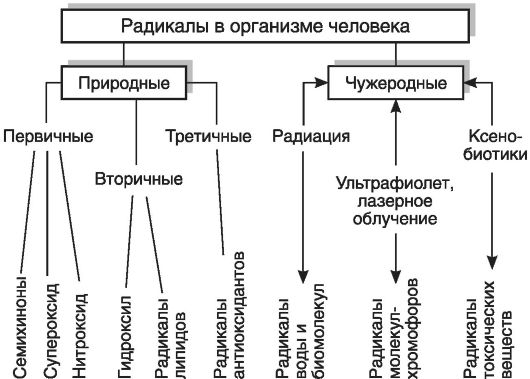 Рис. 3-2.Классификация радикалов в организме человека
Рис. 3-2.Классификация радикалов в организме человека
Из первичного радикала - O*2-, а также в результате других реакций в организме образуются весьма активные молекулярные соединения: перекись водорода (Н2О2), гипохлорит (HOCl), гидроперекиси липидов. Под действием ионов металлов переменной валентности, в первую очередь Fe2+, из этих веществ образуются вторичные радикалы(HO*, радикалы липидов), которые оказывают разрушительное действие на клеточные структуры.
Для защиты от повреждающего действия вторичных радикалов в организме используется большая группа веществ, называемых антиоксидантами (см. ниже), к числу которых принадлежат «ловушки» («перехватчики») свободных радикалов. Примером последних служат альфа-токоферол, тироксин, восстановленный убихинон (QH2) и женские стероидные гормоны. Реагируя с липидными радикалами, эти вещества сами превращаются в радикалы антиоксидантов, которые можно рассматривать как третичные радикалы.
Наряду с этими радикалами, постоянно образующимися в том или ином количестве в клетках и тканях организма человека, разрушительное действие могут оказывать радикалы, появляющиеся при таких воздействиях, как ионизирующее излучение, ультрафиолетовое облучение или даже освещение интенсивным видимым светом, например светом лазера. Такие радикалы можно назвать чужеродными. К ним принадлежат также радикалы, образующиеся из попавших в организм посторонних соединений, ксенобиотиков, многие из которых оказывают токсическое действие именно благодаря свободным радикалам, образующимся при метаболизме этих соединений.
Однако не следует считать, что свободные радикалы являются только повреждающим клетки фактором. Примером положительной роли этих соединений является система клеточного иммунитета. Например, фагоцитирующие лейкоциты (к которым относятся гранулоциты и моноциты крови и тканевые клетки - макрофаги), соприкасаясь с поверхностью бактерий в очаге воспаления, активируются и с помощью НАДФН-оксидазы - фермента, встроенного в мембрану клеток и внутриклеточных везикул-фагосом, генерируют из О2 супероксидный анион-радикал, обладающий бактерицидным действием (рис. 3-3). Нитроксид (NO*), выделяясь клетками-фагоцитами вместе с супероксид-радикалами, используется для борьбы с микробами грибковой природы. Для осуществления своих киллерных функций фагоциты используют также образующийся из перекиси водорода гипохлорит (OCl-). Реакция
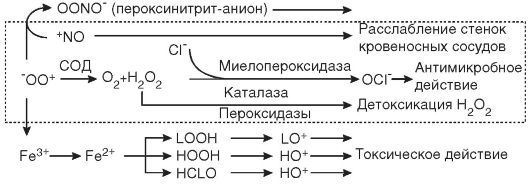 Рис. 3-3.Реакции супероксидного радикала
Рис. 3-3.Реакции супероксидного радикала
образования гипохлорита катализируется с помощью специального фермента - миелопероксидазы: Н2О2 + Cl- - Н2О + ОО-. Гипохлорит сам по себе не является свободным радикалом (относится к группе активных метаболитов кислорода нерадикальной природы), но взаимодействует с органическими молекулами через радикальные механизмы. При участии гипохлорита образуются такие высокоактивные молекулы, как гидроксильный радикал (Fe2+ + OCl- + H+ - Fe3+ + HO' + Cl-), синглетный кислород (Ю2). В активированных лейкоцитах гидроксильный радикал (HO') может образовываться также при разложении перекиси водорода в присутствии ионов двухвалентного железа (Н2О2 + Fe2+ - Fe3+ + HO' + HO'). Цитотоксическое действие OCl- и HO' заключается в их способности разрушать SH-гругты и другие аминокислотные остатки белков, индуцировать разрывы цепей ДНК и РНК, усиливать активность ПОЛ, протеиназ, белков системы комплемента, ингибировать белки деления и ферменты бактерий.
Свободные радикалы выполняют также и другие, в том числе регуляторные, функции. Так, для некоторых тканей, в частности мозга, характерен повышенный синтез простагландинов, тромбоксанов и лейкотриенов, образующихся из арахидоновой кислоты при индукции ПОЛ с участием супероксид-аниона. Радикал убихинона (коэнзима Q) - семихинон (HQ') участвует в цепи переноса электронов; при нарушении работы дыхательной цепи он может стать источником других радикалов, в первую очередь радикалов кислорода.
Кроме того, свободные радикалы активно участвуют в процессах передачи клеточного сигнала, могут выступать в качестве вто-
ричных мессенджеров в сигнальных каскадах, запускаемых ангиотензином II, эндотелином и др. Так, NO', образующийся клетками стенок кровеносных сосудов (эндотелия) при участии гемсодержащего фермента NO-синтазы, играет ключевую роль в регуляции тонуса сосудов и кровяного давления: его недостаток приводит к гипертензии, избыток - к гипотензии. Нарушение метаболизма NO вызывает заболевания, связанные с изменением кровяного давления. Радикалы, образующиеся в цитозоле клетки в ответ на стимуляцию факторами роста, участвуют в регуляции пролиферативного процесса.
В нормальных условиях радикалы кислорода не накапливаются в клетках. Состояние клеток, характеризующееся избыточным содержанием в них радикалов кислорода, называется окислительным стрессом.Окислительный стресс развивается тогда, когда окислительно-восстановительный гомеостаз (редокс-гомеостаз или баланс) в клетке нарушается. Этот дисбаланс может быть обусловлен гиперпродукцией активных форм кислорода или недостаточностью системы антиоксидантной защиты, в состав которой входят низкомолекулярные соединения растительного и животного происхождения (содержатся в плазме крови, в цитоплазме или мембранах клеток). Выделяют несколько основных групп антиоксидантов:
1) ферментативные - супероксиддисмутаза, каталаза, ферменты глутатионового цикла (глутатионпероксидаза, глутатионредуктаза, глутатион-S-трансфераза);
2) фенольные - витамин Е, коэнзим Q, флавоноиды (кверцетин, рутин, гесперетин и др.);
3) каротиноиды - жирорастворимые растительные пигменты, входящие в состав овощей и фруктов (морковь, шпинат, манго, абрикос и др.);
4) аскорбиновая кислота (витамин С) - содержится в свежих овощах, фруктах и ягодах (петрушка, молодая капуста, шиповник, черная смородина, лимон, апельсин, папайя, яблоко и др.), в организме в большом количестве обнаруживается в надпочечниках, гипофизе, вилочковой железе;
5) SH-содержащие соединения - глутатион, тио-, перокси- и глутаредоксины;
6) хелаторы ионов металлов переменной валентности - трансферрины, ферритин, церулоплазмин, металлотионеины, мочевая кислота и др.
По принципу антиокислительного действия выделяют антиоксиданты прямого (направленного) и непрямого (опосредованного) действия. Эффективность последних проявляется только в живых системах (in vivo), в то время как соединения направленного типа действия могут подавлять окислительные процессы с участием активных метаболитов кислорода как in vivo, так и in vitro.
В естественных условиях антиоксиданты (супероксиддисмутаза, каталаза, таурин и др.) защищают фагоциты от аутодеструкции собственными радикалами (супероксидом, гипохлоритом, гидроксильным радикалом), координируют генерацию воспалительных медиаторов нейтрофилами и макрофагами (простагландинов, IL-6, TNF-α и др.). Эффекты некоторых антиоксидантов представлены в табл. 3-5.
Таблица 3-5.Наиболее известные антиоксиданты
| Антиоксидант | Характеристика |
| Церулоплазмин | Окисляет Fe2+ до Fe3+ молекулярным кислородом |
| Апо-белок трансферрина | Связывает Fe3+ |
| Ферритин | Окисляет Fe2+ и депонирует Fe3+ |
| Карнозин | Связывает Fe2+ |
| Супероксиддисмутазы | Удаляют супероксид с образованием пероксида водорода |
| Каталаза | Разлагает пероксид водорода с выделением кислорода |
| Глутатионпероксидазы | 1. Удаляют пероксид водорода за счет окисления глутатиона 2. Удаляют гидроперекиси липидов |
| Глутатионредуктаза | Восстанавливает окисленный глутатион |
| Токоферол, тироксин, стероиды | Перехватывают радикалы липидов |
| Аскорбиновая кислота | Регенерирует окисляющиеся токоферол и убихинон |
| Глутатион | Используется для восстановления пероксидов |
Основные стадии цепного окисления.Реакция цепного окисления липидов играет исключительную роль в клеточной патологии. Она протекает в несколько стадий: инициирование, продолжение, разветвление и обрыв цепи (рис. 3-4).
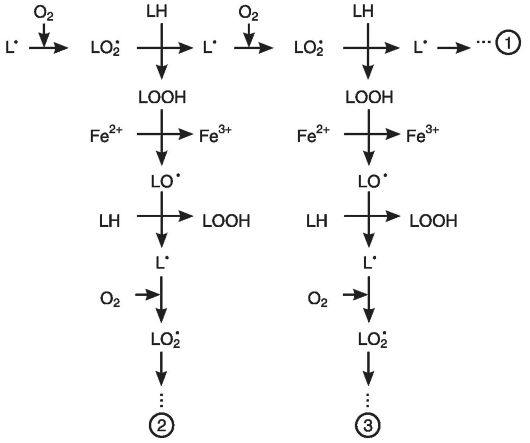 Рис. 3-4.Цепная реакция перекисного окисления липидов: 1-старая цепь окисления, 2, 3 - новые цепи окисления
Рис. 3-4.Цепная реакция перекисного окисления липидов: 1-старая цепь окисления, 2, 3 - новые цепи окисления
Инициирование цепной реакции начинается с того, что в липидный слой мембран или липопротеинов внедряется свободный радикал. Чаще всего это радикал гидроксила. Будучи небольшой по размеру незаряженной частицей, он способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (их принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом образуются липидные радикалы:
HO' + LH - Н2О + L'.
Липидный радикал (L ) вступает в реакцию с растворенным в среде молекулярным кислородом, при этом образуется новый свободный радикал - радикал липоперекиси (LOO ):
L + О2 - LOO
Этот радикал атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала L :
LOO'+ LH - LOOН + L'
Чередование двух последних реакций как раз и представляет собой цепную реакцию ПОЛ (см. рис. 3-4).
Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2+ с гидроперекисями липидов:
Fe2+ + LOOН - Fe3+ + НО- + LO'
Образующиеся радикалы LO' инициируют новые цепи окисления липидов (см. рис. 3-4):
LO' + LH - LOН + L'; L'+ О2 - LOO' - и т.д.
В биологических мембранах цепи могут состоять из десятка звеньев и более. Но, в конце концов, цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2+) или друг с другом:
LOO' + Fe2+ + H+ - LOOН + Fe3+
LOO' + InH - In'+ LOOH
LOO + LOO - молекулярные продукты
Повреждающее действие пероксидации липидов.На рис. 3-5 показаны основные мишени ПОЛ в мембранных структурах клеток. Повреждаются либо белковые структуры, либо липидный бислой в целом. В последнее время ученые уделяют все большее внимание взаимодействию мембран с нуклеиновыми кислотами в ядре и митохондриях. По-видимому, одним из результатов пероксидации липидов может стать повреждение этих молекул со всеми вытекающими последствиями.
Наиболее чувствительны к перекисному окислению липидов сульфгидрильные, или тиоловые, группы (SH) мембранных белков: ферментов, ионных каналов и насосов. В ходе окисления тиоловых групп образуются радикалы (S ), которые затем либо взаимодействуют друг с другом с образованием дисульфидов (SS), либо связываются с кислородом с образованием сульфитов и сульфатов (SO3 и SO4). Большую роль в патологии клетки играет также
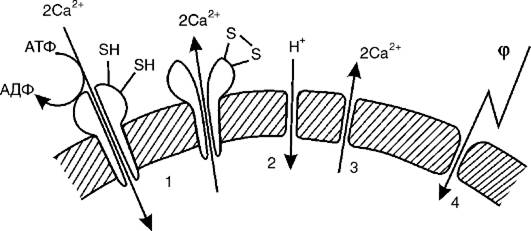 Рис. 3-5.Повреждающее действие перекисного окисления липидов на биологические мембраны
Рис. 3-5.Повреждающее действие перекисного окисления липидов на биологические мембраны
повреждение ионтранспортирующих ферментов (например, Ca2+, Мg2+-АТФазы), в активный центр которых входят тиоловые группы (рис. 3-5, 1). Инактивация Са2+-АТФазы приводит к замедлению откачивания из клетки ионов кальция и ускорению их «протечки» в клетку (где их концентрация меньше). Это вызывает рост уровня ионов кальция в цитоплазме и повреждение клеточных структур.
Окисление тиоловых групп мембранных белков приводит к появлению дефектов в мембранах клеток и митохондрий. Под действием электрического поля через такие дефекты в клетки входят ионы натрия, а в митохондрии - ионы калия. В результате происходит увеличение осмотического давления внутри клеток и митохондрий и их набухание. Это приводит к еще большему повреждению мембранных структур.
Наряду с белками и нуклеиновыми кислотами мишенью повреждающего действия ПОЛ служит сам липидный бислой. Было показано, что продукты ПОЛ делают липидную фазу мембран проницаемой для ионов водорода и кальция (рис. 3-5, 2-3). Это приводит к тому, что в митохондриях окисление и фосфорилирование разобщаются, и клетка оказывается в условиях энергетического голода. Одновременно из митохондрий в цитоплазму выходят ионы кальция, которые повреждают клеточные структуры.
Возможно, наиболее важный результат пероксидации - это уменьшение электрической стабильности липидного слоя, кото-
рое приводит к электрическому пробою мембраны собственным мембранным потенциалом (рис. 3-5, 4). Электрический пробой вызывает полную потерю мембраной ее барьерных функций.
Стабильность липидного слоя мембран и явление электрического пробоя.Как известно, мембраны обладают определенным сопротивлением R электрическому току I, которое при небольшой разности потенциалов φ между двумя сторонами мембраны является постоянной величиной. Иными словами, для мембраны соблюдается закон Ома: I = φ / R. Это означает, что зависимость между напряжением на мембране φ и током через мембрану I - линейная. Однако такая зависимость сохраняется при сравнительно небольших величинах |φ|: не выше 200-300 мВ. При определенной критической разности потенциалов ток резко увеличивается, что может стать причиной разрушения мембраны. Это явление называется электрическим пробоем.
В основе электрического пробоя мембраны лежит спонтанное (вследствие теплового движения молекул) зарождение в липидном бислое дефектов - пор, через которые могут проходить водорастворимые молекулы и ионы. При отсутствии разности потенциалов на мембране увеличения размеров спонтанно образовавшихся пор не происходит, так как данный процесс сопровождается ростом площади раздела фаз «липид - вода» и требует энергетических затрат на преодоление сил поверхностного натяжения на границе раздела фаз. Однако при увеличении разности потенциалов на мембране количество энергии, необходимое для образования и увеличения размеров поры, уменьшается, что способствует ее дальнейшему росту, который после преодоления некоторого энергетического барьера становится самопроизвольным и приводит к полному разрушению мембраны (рис. 3-6). При небольших мембранных потенциалах, существующих в живой клетке (-70 мВ на цитоплазматической мембране и -175 мВ на внутренней мембране митохондрий), этого не происходит, потому что энергетический барьер достаточно высок. Более того, в нормальных условиях, под действием сил поверхностного натяжения образовавшийся дефект «затягивается», и мембрана остается целой. Величина барьера снижается при увеличении поляризации мембраны. Потенциал, при котором начинается электрический пробой, называется потенциалом пробояи обычно обозначается как U* или φ*. Величина потенциала пробоя различна для мембран с разным составом белков и липидов и может служить количественной мерой электрической
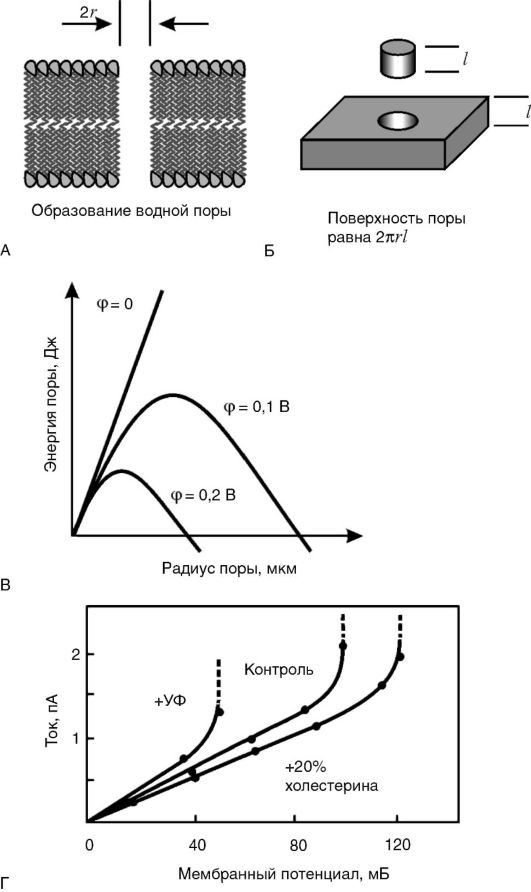 Рис. 3-6.Электрический пробой мембран: А - появление в липидном бислое мембраны поры, заполненной водой; Б - размер внутренней поверхности поры пропорционален ее радиусу; В - энергия мембраны с порой в зависимости от ее радиуса (величина потенциального барьера при росте поры уменьшается); Г - возрастание тока в зависимости от потенциала пробоя
Рис. 3-6.Электрический пробой мембран: А - появление в липидном бислое мембраны поры, заполненной водой; Б - размер внутренней поверхности поры пропорционален ее радиусу; В - энергия мембраны с порой в зависимости от ее радиуса (величина потенциального барьера при росте поры уменьшается); Г - возрастание тока в зависимости от потенциала пробоя
стабильности мембраны. Чем стабильнее мембрана, тем выше ее потенциал пробоя (т.е. |φ*|).
В живых клетках потенциал пробоя выше мембранного потенциала (|φ*|>|φ|), иначе мембраны пробивались бы своим собственным потенциалом и клетка не могла существовать. Однако запас электрической прочности невелик - 20-30 мВ. Это означает, что при |φ*|<|φ|, т.е. при снижении электрической прочности, может произойти «самопробой» мембраны.
Как уже указывалось выше, основными причинами нарушения барьерных свойств мембран при патологии являются их механическое (осмотическое) растяжение, активация ПОЛ, гидролиз фосфолипидов и адсорбция полиэлектролитов на поверхности. Изучение влияния этих факторов на электрическую прочность мембран показало, что все они снижают силы поверхностного натяжения на границе раздела фаз «липидный слой мембраны - окружающий водный раствор», а следовательно, величину потенциала пробоя (рис. 3-7). Таким образом, электрический пробой - это универсальный механизм нарушения барьерной функции мембран при патологии.
Мембранные системы защиты от электрического пробоя.Известны два фактора, с помощью которых живые клетки повышают электрическую стабильность своих мембранных структур:
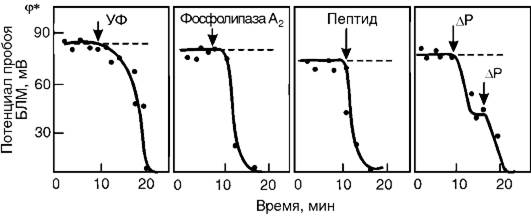 Рис. 3-7.Снижение электрической прочности бислойной липидной мембраны (БЛМ) при действии ультрафиолетового излучения (УФ), фосфолипазы А2, пептидов, при растяжении мембраны, вызванном разностью гидростатического давления (ΔΡ)
Рис. 3-7.Снижение электрической прочности бислойной липидной мембраны (БЛМ) при действии ультрафиолетового излучения (УФ), фосфолипазы А2, пептидов, при растяжении мембраны, вызванном разностью гидростатического давления (ΔΡ)
1. Асимметричный поверхностный потенциал. Поверхностный потенциал возникает на мембране в случае появления на поверхности липидного слоя заряженных химических группировок, например таких, как карбоксил или фосфат. Непосредственно на липидный бислой действует потенциал, равный разности величины мембранного потенциала (т.е. потенциала между водными средами, омывающими мембрану) и поверхностного потенциала (рис. 3-8). За счет неодинаковой плотности зарядов на поверхности мембраны реальная разность потенциалов, приложенная к липидному бислою, отличается от трансмембранной разности потенциалов. Это снижает вероятность пробоя мембраны собственным потенциалом.
2. Холестерин. Было показано, что включение молекул холестерина в фосфолипидный бислой весьма заметно увеличивает электрическую прочность мембран, т.е. повышает потенциал пробоя (см. рис. 3-6, Г). Особенно заметно действие холестерина на поврежденные мембраны. Защитные свойства холестерина против электрического пробоя мембраны можно объяснить его влиянием на вязкость липидного бислоя. Известно, что введение холестерина в фосфолипидный бислой повышает вязкость последнего в 2-3 раза. Это приводит к замедлению образования и роста дефектов (пор) в липидном бислое мембран, лежащих в основе явления электрического пробоя.
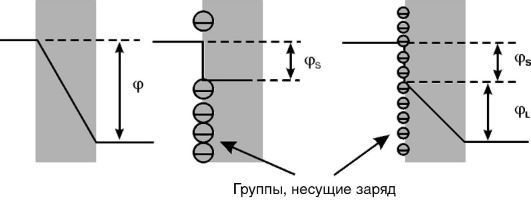 Рис. 3-8.Влияние поверхностного потенциала (cpS) на разность потенциалов на липидном слое мембран (cpL) при одном и том же мембранном потенциале (φ)
Рис. 3-8.Влияние поверхностного потенциала (cpS) на разность потенциалов на липидном слое мембран (cpL) при одном и том же мембранном потенциале (φ)
Критерии оценки нарушений барьерной функции цитоплазматической мембраны.Основными критериями, позволяющими судить о нарушении барьерных свойств цитоплазматической мембраны и увеличении ее проницаемости, являются: уменьшение электрического сопротивления ткани, проникновение водорастворимого красителя в цитоплазму, снижение мембранного потенциала покоя, нарушение ионного баланса, выход внутриклеточных метаболитов в окружающую среду, набухание клеток.
Уменьшение электрического сопротивления (импеданса) ткани. Методом оценки состояния как плазматической, так и внутриклеточных мембран может служить измерение электрического сопротивления - импеданса ткани, который включает в себя омическую и емкостную составляющие, поскольку каждая клетка представляет собой как бы систему конденсаторов (биологические мембраны) и резисторов (биологические мембраны, межклеточная жидкость и цитоплазма). При повреждении или старении клеток регистрируется уменьшение емкостного сопротивления тканей, связанное в основном с нарушением состояния мембран клеток. При набухании, или стрикции, клеток изменяется омическая (высокочастотная) составляющая импеданса. Для количественной оценки указанных нарушений Б.Н. Тарусовым предложено определение коэффициента жизнеспособности клеток (К) как отношения сопротивления ткани переменному току с частотой 104 Гц (R104) к сопротивлению ткани при действии тока с частотой 106 Гц (R106): К= R104 /R106.
Окраска цитоплазмы различными красителями. Водорастворимые красители плохо проникают через мембраны неповрежденных клеток, слабо связываются внутриклеточными структурами и потому слабо их прокрашивают. Увеличение проницаемости плазматической и внутриклеточных мембран приводит к возрастанию количества красителя, вошедшего в клетку и связавшегося с компонентами цитоплазмы. Следовательно, окрашивание клетки красителями усиливается при ее повреждении. На этом основаны многие гистохимические методы определения жизнеспособности клеток (с помощью нейтрального синего, эозина и др.).
Снижение мембранного потенциала покоя. Разность электрических потенциалов между содержимым клетки и окружающей средой (мембранный потенциал покоя) создается, как известно, в основном диффузией ионов калия из клетки в окружающую среду. Неравномерное распределение ионов между клеткой и окружающей
средой, лежащее в основе генерации электрических потенциалов на мембране, обеспечивается постоянной работой молекулярного ионного насоса (Na+/К+-АТФаза), встроенного в плазматическую мембрану клеток.
Так, внутри клеток содержание ионов калия в 20-40 раз выше, а ионов натрия - в 10-20 раз ниже, чем во внеклеточной жидкости. Благодаря различию в концентрации ионов в клетке и окружающей среде на плазматической мембране имеется разность потенциалов со знаком «минус» внутри клетки (около -70 мВ для нервных и мышечных клеток). Уменьшение поляризации мембраны при действии повреждающих факторов происходит как в результате неспецифического увеличения ионной проницаемости, так и при уменьшении градиентов концентрации ионов вследствие выключения ионных насосов.
Последнее происходит как при прямом повреждении Na+/K+- АТФазы, так и при снижении уровня АТФ вследствие нарушения биоэнергетических процессов в митохондриях. Например, установлено снижение мембранного потенциала покоя клеток печени у лабораторных животных при асфиксии. Снижение мембранного потенциала наблюдается также при холодовом, радиационном, аллергическом, токсическом и других повреждениях клеток и субклеточных структур.
Выход ионов калия из клеток. Благодаря разности потенциалов между внутренним содержимым клетки и окружающей жидкостью ионы калия входят в клетку. Этот постоянный поток К+ внутрь клетки компенсирует спонтанный выход калия наружу, который происходит в силу диффузии этих катионов из области с более высокой концентрацией калия в область с более низкой его концентрацией. Повреждение клетки сопровождается снижением содержания в ней АТФ, угнетением Na+/К+-АТФазы, падением электрического потенциала на плазматической мембране, повышением содержания внутриклеточного Ca2+ и выходом калия из клеток. Освобождение калия из клеток описано при механической травме, различных интоксикациях, аллергических состояниях, гипоксии, гипотермии и многих других повреждениях органов и тканей. Понижение содержания К+ в клетке может происходить также под влиянием больших доз минералокортикоидных гормонов, при действии некоторых лекарственных веществ, например сердечных гликозидов. В свою очередь, увеличение концентрации калия во внеклеточной среде приводит к снижению мембранного потенциа-
ла соседних неповрежденных клеток, что в случае электровозбудимых тканей может вызвать генерацию потенциалов действия. Так, увеличение концентрации калия в очаге инфаркта миокарда может стать одной из причин возникновения фибрилляции сердца.
Накопление ионов кальция в цитоплазме. В нормальных клетках концентрация ионов кальция в цитоплазме исключительно низка: 10-7 М или даже 10-8 М, тогда как в окружающей клетку среде содержится 10-3 М ионов кальция. При этом следует иметь в виду, что ионы кальция проходят в клетку не только самопроизвольно (процесс «утечки» через мембрану), но и в некоторых клетках через кальциевые каналы в мембране. Эти каналы могут открываться в ответ на деполяризацию мембраны (потенциалзависимые кальциевые каналы) или присоединение гормонов и медиаторов к мембранным рецепторам (рецепторуправляемые кальциевые каналы). Компенсирует вход Са2+ в клетку работа трех типов кальцийтранспортирующих систем: кальциевого насоса (Са2+/Мg2+-АТФаза) в мембране саркоплазматического ретикулума и плазмолемме, аккумуляции Са2+ в митохондриях и в некоторых клетках Na+/Ca2+- обменника, встроенного в плазмолемму.
При повреждении клетки нарушается работа митохондрий: снижается мембранный потенциал внутренней митохондриальной мембраны, прекращается окислительное фосфорилирование. Как следствие снижения мембранного потенциала уменьшается поглощение митохондриями ионов кальция. Снижение концентрации АТФ в клетке приводит к угнетению Са2+/Мg2+-АТФазы плазматической мембраны и мембраны саркоплазматического ретикулума. Увеличение концентрации Na+ в клетке вследствие угнетения натриевого насоса при недостатке АТФ приводит к выключению и даже обращению направления Na+/Са2+-обмена через плазматическую мембрану. В результате этого происходит увеличение концентрации кальция от 10-8 М - 10-7 M до 10-6 М - 10-5 М, что приводит к активации большого числа кальцийзависимых ферментов (протеинкиназ, фосфатаз, фосфолипаз, фосфодиэстеразы циклических нуклеотидов и др.), нарушениям цитоскелета (см. раздел 3.4), образованию нерастворимых включений кальция в матриксе митохондрий, повреждению внутриклеточных мембран и общей дезорганизации метаболизма. Морфологически это проявляется в замедлении броуновского движения различных включений внутри клетки (увеличение «вязкости протоплазмы») и возрастании светорассеяния; красители начинают легче проникать в
клетку и связываются в большом количестве с внутриклеточными структурами. Все эти признаки типичны для «неспецифической реакции клетки на повреждение» по Д.Н. Насонову и В.Я. Александрову (см. выше).
Выход метаболитов. Увеличение проницаемости мембраны клеток и ухудшение работы ионных насосов приводят к тому, что компоненты цитоплазмы выходят в окружающую среду. Вышедшие из клеток вещества отнюдь не безразличны для других клеток, тканей и органов. Так, среди веществ, выходящих из клеток, поврежденных в результате ишемии (нарушения кровотока) или ожога, имеются полипептиды, обладающие способностью вызвать остановку сердца (ишемический, ожоговый токсины). Обнаружение этих веществ осуществляется различными методами, включая измерение хемилюминесценции плазмы крови, интенсивность которой снижается в присутствии полипептидных токсинов.
Увеличение объема (набухание) клеток. Увеличение объема клеток - один из наиболее ранних признаков ее повреждения, который проявляется, например, при недостатке кислорода в ткани - тканевой гипоксии. Сохранение нормальной формы и объема клеток связано с состоянием цитоскелета и поддержанием определенного соотношения между осмотическим давлением белков и электролитов внутри и вне клетки. При этом форма клетки определяется в большей мере цитоскелетом, тогда как объем - поддержанием осмотического баланса. Поскольку все биологические мембраны хорошо проницаемы для воды, но плохо проницаемы для большинства растворенных в воде веществ, включая соли, клетки, так же как и внутриклеточные структуры, например митохондрии, обладают свойством осмометра: их объем изменяется при изменении концентрации ионов и молекул внутри и вне клетки или органеллы. В нормальных условиях соотношение концентраций всех ионов и молекул внутри и вне клетки строго поддерживается. Как только в цитоплазме начинает увеличиваться концентрация ионов или молекул, объем клетки возрастает, поскольку вода поступает внутрь. Выкачивание ионов мембранными насосами и обменниками сопровождается восстановлением ее объема за счет выхода вслед за ионами избытка воды.
Отек клетки связан с нарушением регуляции ее объема со стороны плазматической мембраны. В нормальных клетках концентрация белка выше, чем вне клеток, вследствие чего клетки млекопитающих обладают более высоким внутриклеточным
коллоидно-осмотическим (онкотическим) давлением, чем внеклеточная жидкость. Это неизбежно привело бы к увеличению объема клетки, если бы для уравновешивания этого «избыточного» давления не происходило удаление (выкачивание) ионов натрия из клетки за счет работы энергозависимой Na+/К+-АТФазы. Поскольку мембрана клеток хорошо проницаема для ионов хлора, то вместе с натрием выходит и хлор за счет разности потенциалов на мембране. Иначе говоря, натриевый насос удаляет из клетки NaCl и снижает концентрацию ионов в цитоплазме, что приводит к уменьшению клеточного объема. Этому процессу противостоит процесс самопроизвольного поступления натрия внутрь клетки через дефекты в липидном бислое, натриевые каналы, переносчики, сопрягающие вход натрия с транспортом сахаров и аминокислот в клетку, Na+/H+- и Na+/Ca2+-обменники, а также Na+/К+/2С1- котранспортер.
Таким образом, живая клетка находится в состоянии динамического равновесия, при котором «протечка» клеточной мембраны компенсируется постоянной работой ионной помпы (это так называемая гипотеза leak and pump).
При патологии может происходить либо увеличение ионной проницаемости клеточной мембраны (возрастание «протечки»), либо нарушение работы ионных насосов, например, при недостатке энергообеспечения вследствие гипоксии, действия цианидов или разобщителей окислительного фосфорилирования (динитрофенол). В опытах с изолированными клетками печени, почек и мозга было показано, что отравление солями ртути или других тяжелых металлов приводит к увеличению ионной проницаемости мембраны клеток (увеличению «протечки»), нарушению АТФ-зависимого транспорта и возрастанию объема клеток (т.е. набуханию ткани).
Второй механизм набухания клеток при гипоксии - увеличение внутриклеточной осмотической нагрузки, вызванное накоплением метаболитов (катаболитов), таких как неорганический фосфат, лактат и пуриновые нуклеозиды.
Набухание клеток - процесс, далеко не безразличный для функционирования клеток и ткани в целом. Первым результатом этого оказывается сдавливание кровеносных сосудов и затруднение кровообращения. Так, при ишемии происходит набухание клеток, и последующее общее возобновление кровообращения не сразу и не всегда приводит к восстановлению жизнедеятельности ткани, потому как кровь не проникает в мелкие кровеносные со-
суды, сдавленные набухшими клетками. То же происходит при трансплантации органов. Иногда применяется предварительное промывание пересаженного органа гипертоническим раствором, который восстанавливает прежний объем клеток и нормализует микроциркуляцию.
Дата добавления: 2015-01-29; просмотров: 2225;
