Глава 4.2. Квантово-механическое обоснование периодического закона элементов.
Отраженное в таблице периодическое изменение физических и химических свойств элементов, определяется строением электронных оболочек атомов, зависящих от величины заряда ядра, и, следовательно, от периодической неравномерности заполнения электронной оболочки атомов электронами.
Из-за невозможности точно указать траекторию движения конкретного электрона (см. принцип неопределенности квантовой теории), введено понятие электронного облака или атомной орбитали как зоны пространства атома, в которой электрон совершает свое движение с наибольшей вероятностью. Энергия и размер орбитали характеризуются главным квантовым числом n , где n = 1 , 2 , 3, … - последовательность целых чисел. Разные электроны могут иметь близкие по размеру и энергии орбитали. Совокупность таких орбиталей с одинаковым n составляет энергетический уровень. Количеству энергетических уровней в атомах соответствует номер периода, в котором они находятся в таблице. Наряду с энергией и размером, орбитали могут отличаться своей формой. Исходя из этого, энергетические уровни делят на подуровни :s ,p ,d ,f. Число орбиталей на каждом подуровне ограничено: s-1 ,p-3, d-5, f-7 орбиталей. На одной орбитали может быть не более 2 электронов, при этом они должны обязательно иметь различные спиновые квантовые числа, отражающие направление движения электрона вокруг своей оси. Порядок заполнения атомных орбиталей электронами происходит по принципу наименьшей энергии, поэтому заполнение происходит от 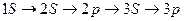 подуровня.
подуровня.
В дальнейшем идет не 3d подуровня, а 4s, поскольку он является менее энергоемким, а после него уже идет 3d – формируются большие периоды таблицы.
Номер группы в периодической таблице показывает число электронов на внешнем электронном слое элементов главной подгруппы или суммарное число электронов на d подуровне предвнешнего и s подуровне внешнего слоя элементов побочных подгрупп. Таким образом, периоды изменения свойств химических элементов и их соединений при увеличении порядкового номера в таблице объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. Т.к. энергетически наиболее устойчивым является электронные структуры с завершенным внешним слоем (с 2 электронами на s подуровне и 6 на p подуровне ), то наличие не спаренных электронов и свободных орбиталей на подуровне внешнего слоя становится причиной и возможностью образования химических связей между элементами, в результате которых при объединении электронных облаков 2-х атомов, образуется устойчивый электронный октет (8 электронов). Число не спаренных электронов в атоме определяет возможность или способность образовывать химические связи. Связь атомов, образовавшаяся в результате формирования общих электронных пар за счет перекрывания электронных облаков не спаренных электронов, называется ковалентной.
Ионная связь образуется между типичными металлами и типичными неметаллами. Т.к. у металлов на внешнем слое как правило мало электронов, для обретения устойчивости они стремятся их отдать неметаллам, которым не хватает 1,2 электронов для завершения слоя и которые стремятся приобрести эти электроны. При столкновении 2-х таких атомов происходит переход электрона от металла к неметаллу, при этом металл приобретает “+” заряд и становится катионом, а неметалл “-“ и становится анионом.Силы электростатического взаимодействия объединяют такие ионы в молекулу. Образование любой химической связи атомов - это процесс, при котором выделяется энергия. Соответственно, для разрыва любой связи требуются затраты энергии. Ряд химических связей требует внешнего притока энергии. Это связано с тем, что внешняя энергия может приводить атомы в возбужденное состояние, перебрасывая часть электронов с одного подуровня на свободные орбитали другого подуровня в пределах одного энергетического уровня. За счет этого, количество не спаренных электронов на внешнем уровне увеличивается, и увеличивается число возможных химических связей. Энергия, необходимая для разрыва такой связи, будет меньше энергии, выделяющейся в результате разрыва связи.
Дата добавления: 2015-01-21; просмотров: 1175;
