НЕПОДАВЛЯЕМАЯ ИНСУЛИНОПОДОБНАЯ АКТИВНОСТЬ
До появления методов радиоиммунологического анализа инсулин в сыворотке определяли in vitro по поглощению глюкозы эпидидимальной жировой тканью или диафрагмой крыс. Последующие определения показали, что только 10% от общей инсулиноподобной активности, находимой с помощью биологических методов, соответствует истинному инсулину поджелудочной железы, судя по результатам применения радиоиммунологических методов. Остальная присутствующая в крови инсулиноподобная активность сохранялась после панкреатэктомии или при добавлении инсулиновых антител и поэтому получила название неподавляемой инсулиноподобной активности (НИПА). По растворимости в кислом этаноле были выделены два компонента НИПА: НИПАр — меньший компонент, растворимый в кислом этаноле, и НИПАн — более крупный полипептид (с молекулярной массой приблизительно 100 000), не растворимый в кислом этаноле.
Недавно НИПАр была очищена в большей степени, причем оказалось, что она состоит из двух полипептидов (с молекулярной массой около 7500), обладающих инсулиноподобной стимулирующей рост активностью на фибробластах куриного эмбриона (ускорение размножения клеток и синтеза ДНК), и поэтому получили название инсулиноподобных факторов роста I и II (ИФР I и II) [101]. Неожиданной находкой оказалась широкая гомология между ИФР I и II, с одной стороны, и первичной структурой А- и В-цепей инсулина, с другой. (рис. 10—24). Отмечена также гомология третичных структур, за счет чего и происходит перекрестная реякпист с, инсулиновыми рецепторами..
В жировой ткани ИФР I и II проявляют 1/60 долю биологической активности инсулина и действуют за счет своего слабого сродства к инсулиновым рецепторам. В отличие от этого в мышце и фибробластах их активность более высока и опосредуется взаимодействием с собственными рецепторами ИФР.
Синтез ИФР происходит в печени и контролируется секрецией гормона роста. Уровень ИФР в плазме снижается при гипопитуитаризме и повышается при акромегалии. Кроме того, как уже отмечалось, ИФР очень близки или идентичны соматомединам — семейству соединений, выступающих в роли медиаторов действия гормона роста на различные клетки-мишени. Как и соматомедины, ИФР I и II стимулируют поглощение сульфата хрящевой тканью (являясь «сульфирующими факторами»), обладают митогенной активностью, и их синтез зависит от присутствия гормона роста. Выяснение первичной структуры соматомединов должно помочь точной оценке их близости к ИФР I и II.
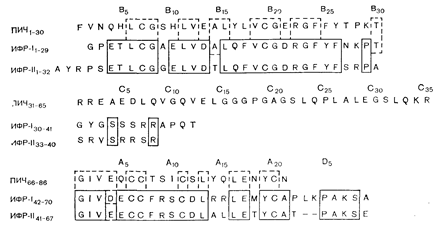
Рис. 10—24. Первичная структура проинсулина человека (ПИЧ) и инсулиноподобных факторов роста (ИФР) I и II. Участки, ограниченные сплошными линиями, включают одинаковые аминокислотные остатки в ИФР I и II; участки, ограниченные пунктирными линиями, включают аминокислотные остатки, одинаковые в ПИЧ и ИФР I и/или II (по Zapf J. et al., Metabolism, 1978, 27, 1803).
Предполагалось, что гипогликемия у больных с внепакреатическими опухолями в отсутствие повышения радиоиммунологически определяемого инсулина обусловлена НИПАр [102]. Однако с помощью более специфических методов определения эти данные подтвердить не удалось [101].
Дата добавления: 2015-01-19; просмотров: 983;
