Тема 6.6. Оксикислоты
Оксикислотами называют органические структуры, содержащие в своем составе две функциональные группы: карбоксильную и гидроксильную. В зависимости от количества карбоксильных групп в молекуле оксикислоты делятся по основности, а в зависимости от количества гидроксильных групп — по атомности. Кроме того, в зависимости от природы углеводородного радикала, связанного с функциональными группами, оксикислоты делятся на алифатические, ароматические и гетероциклические.
Номенклатура. Оксикислоты широко распространены в природе и для большинства из них используются тривиальные названия.
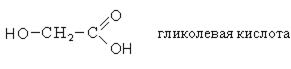

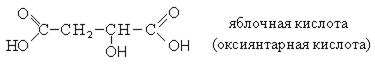
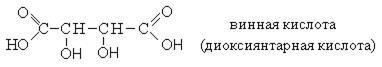
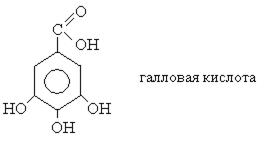
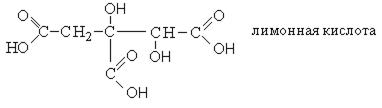
Для названия оксикислот используется также рациональная номенклатура, в соответствии с которой название образуется от соответствующей карбоновой кислоты, а положение гидроксильных групп указывается буквами α, β, γ.
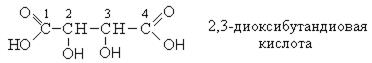
По систематической номенклатуре названия оксикислот образуется от соответствующих карбоновых кислот с окончанием -овая (-диовая, -триовая), положение гидроксильной группы указывается цифрами с приставкой окси- (диокси-, триокси-).
Получение оксикислот.Большинство оксикислот, распространенных в природе, являются продуктами биологического синтеза. Синтетическим путем оксикислоты можно получить из карбоновых кислот, введением гидроксильной группы, или из спирта, введением карбоксильной группы.
1. Гидролиз оксинитрилов:
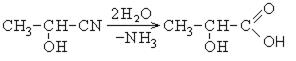
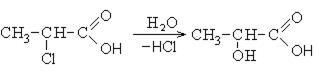
2. Гидролиз галогенпроизводных карбоновых кислот:
3. Гидролиз непредельных карбоновых кислот:
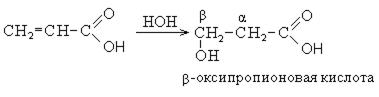
Химические свойства оксикислот.Поскольку оксикислоты являются дифункциональными соединениями, то для них характерны реакции основных функциональных групп: карбоксильной и гидроксильной. Направление химических реакций зависит от реагента и условий проведения реакции.
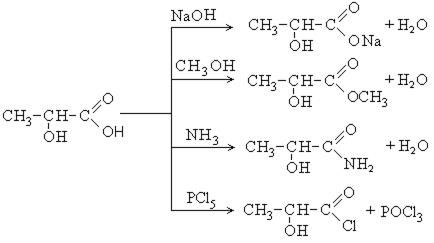
Как кислоты они вступают в следующие реакции:
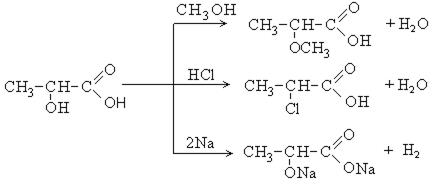
Как спирты оксикислоты вступают в следующие реакции:
Внутри молекулы происходит постоянная борьба между функциональными группами в соответствии с законом единства и борьбы противоположностей, поэтому оксикислоты вступают в свои специфические реакции, характерные только для них:
реакция дегидратации
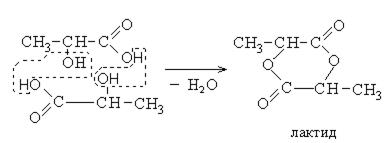
При дегидратации α- оксикислот происходит межмолекулярное отцепление воды с образованием лактидов.
β-оксикислоты дегидратируются с образованием непредельных кислот
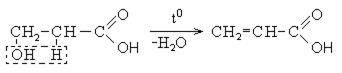
γ- и другие оксикислоты дегидратируются с образованием лактонов
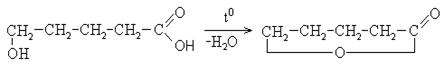
Оптическая изомерия оксикислот и некоторые вопросы стереохимии
Ряд органических соединений обладает оптической активностью, то есть эти вещества реагируют на прохождение через их растворы плоскополяризованного луча света, вращая плоскость поляризации на определенный угол α.
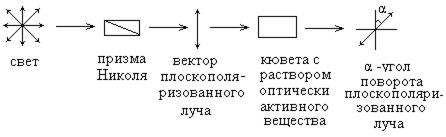
Оптической активностью обладают такие органические структуры, которые содержат в своем составе ассиметрический атом углерода, то есть атом углерода, связанный с четырьмя различными группами атомов.
Одни формы оптически активных веществ вращают плоскость поляризации вправо, они называются правовращающими и обозначаются d (+). Другие формы того же вещества вращают плоскость поляризации влево, называются левовращающими и обозначаются l (-). Смесь равных количеств лево- и правовращающей формы называется рацематом, который не обладает оптической активностью.
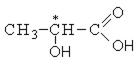
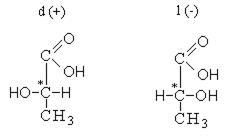
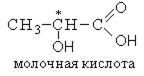
Изображение формул молочной кислоты в виде формул Фишера
Лево- и правовращающие формы молочной кислоты по отношению друг к другу являются оптическими изомерами, то есть относятся друг к другу как предмет к зеркальному изображению и при наложении никогда не совпадают. Существование оптических изомеров молочной кислоты объясняется sp3-гибридизацией ассиметричного атома углерода, который предполагает существование двух тетраэдров с различным расположением функциональных групп.
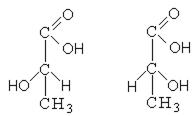
Однако знак вращения не является надежной характеристикой для всех членов ряда.
Для того чтобы произвести классификацию по рядам, за основу выбирается конфигурация. Эталоном для выбора конфигурации выступает глицериновый альдегид.
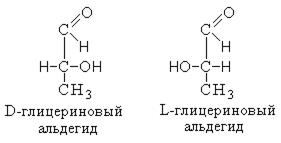
Отнесение соединения к D- или L-ряду проводят путем сравнения строения нижнего тетраэдра данного соединения с D- или L-глицериновым альдегидом. Таким образом, левовращающая форма молочной кислоты относится к D-ряду, а правовращающая – к L-ряду.
Общее количество оптических изомеров N рассчитывается по формуле:
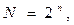
где n – количество ассиметричных центров в молекуле.
Дата добавления: 2015-03-19; просмотров: 17558;
