ПОДАГРА И ДРУГИЕ НАРУШЕНИЯ ПУРИНОВОГО ОБМЕНА
Термином «подагра» обозначают группу заболеваний, которые при своем полном развитии проявляются: 1) повышением уровня уратов в сыворотке; 2) повторными приступами характерного острого артрита, при котором в лейкоцитах из синовиальной жидкости можно обнаружить кристаллы моногидрата однозамещенного урата натрия; 3) крупными отложениями моногидрата однозамещенного урата натрия (tophi), главным образом в суставах конечностей и вокруг них, что иногда приводит к тяжелой хромоте и деформациям суставов; 4) повреждением почек, включая интерстициальные ткани и кровеносные сосуды; 5} образованием почечных камней из мочевой кислоты. Все эти симптомы могут встречаться как порознь, так и в разнообразных сочетаниях.
Распространенность и эпидемиология. Об абсолютном повышении уровня урата в сыворотке говорят тогда, когда она превышает предел растворимости однозамещенного урата натрия в этой среде. При температуре 37° С насыщенный раствор урата в плазме образуется при его концентрации примерно 70 мг/л. Более высокий уровень означает перенасыщение в физико-химическом смысле. Концентрация урата в сыворотке относительно увеличена тогда, когда она превышает верхнюю границу произвольно установленных нормальных колебаний, обычно рассчитываемых как средний уровень урата в сыворотке плюс два стандартных отклонения в популяции здоровых лиц, сгруппированных по возрасту и полу. По данным большинства исследований, верхняя граница у мужчин составляет 70, а у женщин — 60 мг/л. С эпидемиологической точки зрения, концентрация урата в. сыворотке более 70 мг/л увеличивает риск подагрического артрита или нефролитиаза.
На уровень урата влияют пол и возраст. До периода полового созревания как у мальчиков, так и у девочек концентрация урата в сыворотке составляет примерно 36 мг/л, после полового созревания у мальчиков она увеличивается больше, чем у девочек. У мужчин она достигает плато в возрасте после 20 лет и затем остается стабильной. У женщин в возрасте 20—50 лет концентрация урата удерживается на постоянном уровне, но с наступлением менопаузы увеличивается и достигает уровня, типичного для мужчин. Считают, что эти возрастные и половые колебания связаны с различием почечного клиренса урата, на который влияет, очевидно, содержание эстрогенов и андрогенов. С концентрацией урата в сыворотке коррелируют и другие физиологические параметры, такие как рост, масса тела, уровень азота мочевины и креатинина в крови и артериальное давление. Повышенный уровень урата в сыворотке связан и с другими факторами, например с высокой температурой окружающей среды, потреблением алкоголя, высоким социальным статусом или образованием.
Гиперурикемия, согласно тому или иному определению, обнаруживается у 2—18% населения. В одной из обследованных групп госпитализированных концентрация урата в сыворотке более 70 мг/л имела место у 13 % взрослых мужчин.
Частота и распространенность подагры меньше, чем гиперурикемии. В большинстве западных стран частота подагры составляет 0,20—0,35 на 1000 человек: это означает, что ею страдают 0,13—0,37 % от общего числа популяции. Распространенность болезни зависит как от степени повышения уровня урата в сыворотке, так и от длительности этого состояния. В связи с этим подагра — это в основном болезнь пожилых мужчин. На долю женщин приходится лишь до 5 % случаев заболевания. В препубертатном периоде дети обоего пола заболевают редко. Обычная форма болезни лишь изредка проявляется в возрасте до 20 лет, а пик заболеваемости приходится на пятое 10-летие жизни.
Наследование. В США семейный анамнез выявляется в б—18 % случаев заболевания подагрой, а при систематическом опросе эта цифра составляет уже 75 %. Точно определить тип наследования трудно из-за влияния факторов окружающей среды на концентрацию урата в сыворотке. Кроме того, идентификация нескольких специфических причин подагры свидетельствует о том, что она представляет собой общее клиническое проявление неоднородной группы болезней. Соответственно трудно проанализировать характер наследования гиперурикемии и подагры не только в популяции, но и в пределах одной семьи. Две специфические причины подагры — недостаточность гипоксантингуанинфосфорибозилтрансферазы и гиперактивность 5-фосфорибозил-1-пирофосфатсинтетазы — сцеплены с Х-хромосомой. В других семьях наследование соответствует аутосомному доминантному типу. Еще чаще генетические исследования указывают на многофакторность наследования болезни.
Клинические проявления. Полная естественная эволюция подагры проходит четыре стадии: бессимптомная гиперурикемия, острый подагрический артрит, межкритический период и хронические подагрические отложения в суставах. Нефролитиаз может развиться в любой стадии, кроме первой.
Бессимптомная гиперурикемия. Это стадия болезни, при которой уровень урата в сыворотке повышен, но симптомы артрита, подагрические отложения в суставах или мочекислые камни еще отсутствуют. У мужчин, подверженных классической подагре, гиперурикемия начинается в период полового созревания, тогда как у женщин из группы риска она обычно не проявляется до периода менопаузы. В отличие от этого при некоторых ферментных дефектах (см. далее) гиперурикемия определяется уже с момента рождения. Несмотря на то что бессимптомная гиперурикемия может сохраняться в течение всей жизни больного, не сопровождаясь видимыми осложнениями, тенденция ее перехода в острый подагрический артрит усиливается как функция ее уровня и продолжительности. Риск нефролитиаза также повышается по мере увеличения количества урата в сыворотке и коррелирует с экскрецией мочевой кислоты. Несмотря на то что гиперурикемия определяется практически у всех больных подагрой, примерно только у 5 % лиц с гиперурикемией когда-либо развивается эта болезнь.
Стадия бессимптомной гиперурикемии заканчивается с первым приступом подагрического артрита или нефролитиаза. В большинстве случаев артрит предшествует нефролитиазу, который развивается через 20—30 лет стойкой гиперурикемии. Однако у 10—40 % больных почечные колики возникают до первого приступа артрита.
Острый подагрический артрит. Первичным проявлением острой подагры служит крайне болезненный артрит вначале обычно в одном из суставов со скудной общей симптоматикой, но позднее в процесс вовлекается несколько суставов на фоне лихорадочного состояния. Процент больных, у которых подагра сразу же проявляется полиартритом, точно не установлен. Согласно данным одних авторов, он достигает 40 %, но большинство считают, что он не превышает 3—14 %. Продолжительность приступов различна, но все же ограничена, они перемежаются с бессимптомными периодами. Не менее чем в половине случаев первый приступ начинается в суставе плюсневой кости I пальца. В конце концов 90 % больных испытывают приступы острых болей в суставах I пальца ноги (подагра).
Острый подагрический артрит — это болезнь преимущественно ног. Чем дистальнее место поражения, тем более типичны приступы. После I пальца ноги в процесс вовлекаются суставы плюсневых костей, голеностопных, пяточных костей, коленные, костей запястья, пальцев рук и локтевые. Острые болевые приступы в плечевых и тазобедренных суставах, сочленениях позвоночника, крестцово-подвздошных, грудинно-ключичных и нижней челюсти появляются редко, за исключением лиц с продолжительным, тяжело протекающим заболеванием. Иногда развивается подагрический бурсит, причем чаще всего в процесс вовлекаются сумки коленного и локтевого суставов. Перед первым резким приступом подагры больные могут ощущать постоянную болезненность с обострениями, но чаще первый приступ бывает неожиданным и имеет «взрывной» характер. Обычно он начинается в ночное время, боль в воспаленном суставе чрезвычайно сильна. Приступ может провоцироваться рядом специфических причин, таких как травма, прием алкоголя и некоторых лекарственных средств, погрешности в диете или хирургическая операция. В течение нескольких часов интенсивность болей достигает своего пика, сопровождаясь признаками прогрессирующего воспаления. В типичных случаях воспалительная реакция настолько выражена, что заставляет предположить гнойный артрит. Системные проявления могут включать в себя повышение температуры тела, лейкоцитоз и ускорение оседания эритроцитов. К классическому описанию болезни, приведенному Syndenham, трудно что-либо добавить:
«Больной ложится в постель и засыпает в добром здравии. Примерно в два часа ночи он просыпается от острой боли в I пальце ноги, реже — в пяточной кости, голеностопном суставе или костях плюсны. Боль такая же, как при вывихе, да еще присоединяется ощущение холодного душа. Затем начинаются озноб и дрожь, несколько повышается температура тела. Боль, которая вначале была умеренной, становится все сильнее. По мере ее усиления усиливаются озноб и дрожь. Через некоторое время они достигают своего максимума, распространяясь на кости и связки предплюсны и плюсны. Присоединяется ощущение растяжения и разрыва связок: грызущая боль, чувство давления и распирания. Больные суставы становятся настолько чувствительными, что не переносят прикосновения простыни или сотрясений от шагов окружающих. Ночь проходит в мучениях и бессоннице, попытках поудобнее уложить больную ногу и постоянных поисках положения тела, не причиняющего боли; метания столь же продолжительны, что и боль в пораженном суставе, и усиливаются при обострении боли, поэтому все попытки изменить положение тела и больной ноги оказываются тщетными».
Первый приступ подагры свидетельствует о том, что концентрация урата в сыворотке уже давно повышена в такой степени, что в тканях накопились большие его количества.
Межкритический период. Приступы подагры могут продолжаться в течение одного или двух дней или нескольких недель, но, как правило, они купируются спонтанно. Последствий не остается, и выздоровление кажется полным. Наступает бессимптомная фаза, называемая межкритическим периодом. В течение этого периода больной не предъявляет никаких жалоб, что имеет диагностическое значение. Если примерно у 7 % больных второго приступа вообще не наступает, то примерно у 60 % болезнь рецидивирует в течение 1 года. Однако межкритический период может продолжаться до 10 лет и завершаться повторными приступами, каждый из которых становится все более длительным, а ремиссии все менее полными. При последующих приступах в процесс обычно вовлекается несколько суставов, сами приступы становятся все более тяжелыми и продолжительными и сопровождаются лихорадочным состоянием. На этой стадии подагру бывает трудно дифференцировать от других видов полиартрита, таких, например, как ревматоидный. Реже хронический полиартрит без ремиссий развивается непосредственно после первого же приступа.
Скопления уратов и хронический подагрический артрит. У нелеченых больных скорость продукции урата превышает скорость его элиминации. В результате его количество увеличивается, и в конце концов в хрящах, синовиальных оболочках, сухожилиях и мягких тканях появляются скопления кристаллов однозамещенного урата натрия. Скорость формирования этих скоплений зависит от степени и продолжительности гиперурикемии и тяжести повреждения почек. Классическим, но наверняка не самым частым местом скопления служит завиток или противозавиток ушной раковины (рис. 309-1). Подагрические отложения часто локализуются также вдоль локтевой поверхности предплечья в виде выпячиваний сумки локтевого сустава (рис. 309-2), по ходу ахиллова сухожилия и в других испытывающих давление участках. Интересно, что у больных с наиболее выраженными подагрическими отложениями завиток и противозавиток ушной раковины сглажены.
Подагрические отложения трудно отличить от ревматоидных и других видов подкожных узелков. Они могут изъязвляться и сецернировать беловатую вязкую жидкость, богатую кристаллами однозамещенного урата натрия. В отличие от других подкожных узелков подагрические отложения редко самопроизвольно исчезают, хотя при лечении они могут медленно уменьшаться в размерах. Обнаружение в аспирате кристаллов однозамещенного урата натрия (с помощью поляризующего микроскопа) позволяет классифицировать узелок как подагрический. Подагрические отложения редко инфицируются. У больных с заметными подагрическими узелками острые приступы артрита наступают, по-видимому, реже, и они менее тяжелы, чем у больных без этих отложений. Хронические подагрические узелки редко образуются до начала приступов артрита.
Рис. 309-1. Подагрическая бляшка в завитке ушной раковины рядом с ушным бугорком.
Рис. 309-2. Выпячивания сумки локтевого сустава у больного подагрой. Можно видеть также скопления урата в коже и небольшую воспалительную реакцию.
Успешное лечение меняет естественную эволюцию заболевания. С появлением эффективных антигиперурикемических средств только у небольшого числа больных определяются заметные подагрические отложения с постоянным повреждением суставов или другими хроническими симптомами.
Нефропатия. Та или другая степень нарушения функции почек отмечается почти у 90 % больных с подагрическим артритом. До внедрения в практику хронического гемодиализа 17—25 % больных подагрой умирали от почечной недостаточности. Ее начальным проявлением может быть альбумин- или изостенурия. У больного с выраженной почечной недостаточностью иногда бывает трудно определить, она ли обусловлена гиперурикемией или гиперурикемия представляет собой результат поражения почек.
Известно несколько типов повреждения почечной паренхимы. Во-первых, это уратная нефропатия, которую считают результатом отложения кристаллов однозамещенного урата натрия в интерстициальной ткани почек, во-вторых, обструктивная уропатия, обусловленная образованием кристаллов мочевой кислоты в собирательных канальцах, почечной лоханке или мочеточниках, вследствие чего блокируется отток мочи.
Патогенез уратной нефропатии — предмет резких разногласий. Несмотря на то что в интерстициальной ткани почек некоторых больных подагрой обнаруживают кристаллы однозамещенного урата натрия, в почках большинства больных они отсутствуют. И наоборот, отложение урата в интерстиции почек встречается и при отсутствии подагры, хотя клиническое значение этих отложений неясно. Факторы, которые могут способствовать образованию отложений урата в почках, неизвестны. Кроме того, у больных подагрой отмечена тесная корреляция между развитием почечной патологии и гипертензией. Зачастую неясно, обусловливает ли гипертензия патологию почек или подагрические изменения почек служат причиной гипертензии.
Острая обструктивная уропатия — это тяжелая форма острой почечной недостаточности, обусловленная выпадением кристаллов мочевой кислоты в собирательных протоках и мочеточниках. При этом почечная недостаточность теснее коррелирует с экскрецией мочевой кислоты, чем с гиперурикемией. Чаще всего это состояние встречается у лиц: 1) с резко выраженной гиперпродукцией мочевой кислоты, особенно на фоне лейкемии или лимфомы, подвергающихся интенсивной химиотерапии; 2) с подагрой и резким повышением экскреции мочевой кислоты; 3) (возможно) после тяжелой физической нагрузки, при рабдомиолизе или судорогах. Ацидурия способствует образованию малорастворимой неионизированной мочевой кислоты и, следовательно, может усиливать осаждение кристаллов при любом из этих состояний. При аутопсии в просвете расширенных проксимальных канальцев обнаруживают преципитаты мочевой кислоты. Лечение, направленное на уменьшение образования мочевой кислоты, ускорение мочеотделения и увеличение доли более растворимой ионизированной формы мочевой кислоты (однозамещенный урат натрия), ведет к обратному развитию процесса.
Нефролитиаз. В США подагрой страдают 10—25 % населения, тогда как число лиц с мочекислыми камнями составляет примерно 0,01 %. Основным фактором, способствующим образованию мочекислых камней, служит повышенная экскреция мочевой кислоты. Гиперурикацидурия может быть результатом первичной подагры, врожденного нарушения метаболизма, приводящего к повышению продукции мочевой кислоты, миелопролиферативного заболевания и других неопластических процессов. Если экскреция мочевой кислоты с мочой превышает 1100 мг/сут, частота камнеобразования достигает 50 %. Образование мочекислых камней коррелирует также с повышенной концентрацией урата в сыворотке: при уровне 130 мг/л и выше частота камнеобразования достигает примерно 50%. К другим факторам, способствующим образованию мочекислых камней, относятся: 1) чрезмерное закисление мочи; 2) концентрированность мочи; 3) (вероятно) нарушение состава мочи, влияющее на растворимость самой мочевой кислоты.
У больных подагрой чаще обнаруживают и кальцийсодержащие камни; их частота при подагре достигает 1—3 %, тогда как в общей популяции она составляет всего 0,1 %. Несмотря на то что механизм этой связи остается неясным, у больных с кальциевыми камнями с высокой частотой выявляют гиперурикемию и гиперурикацидурию. Кристаллы мочевой кислоты могли бы служить ядром для образования кальциевых камней.
Сопутствующие состояния. Больные подагрой обычно страдают ожирением, гипертриглицеридемией и гипертензией. Гипертриглицеридемия при первичной подагре тесно связана с ожирением или потреблением алкоголя, а не непосредственно с гиперурикемией. Частота гипертензии у лиц без подагры коррелирует с возрастом, полом и ожирением. При учете этих факторов оказывается, что прямая связь между гиперурикемией и гипертензией отсутствует. Повышенная частота диабета также, вероятно, связана с такими факторами, как возраст и ожирение, а не непосредственно с гиперурикемией. Наконец, повышенная частота атеросклероза объясняется одновременными ожирением, гипертензией, диабетом и гипертриглицеридемией.
Независимый анализ роли этих переменных указывает на наибольшее значение ожирения. Гиперурикемия у тучных лиц связана, по-видимому, как с повышенной продукцией, так и со сниженной экскрецией мочевой кислоты. Хроническое потребление алкоголя также приводит к ее гиперпродукции и недостаточной экскреции.
Ревматоидный артрит, системная красная волчанка и амилоидоз редко сосуществуют с подагрой. Причины этой отрицательной связи неизвестны.
Острую подагру следовало бы подозревать у любого человека с внезапным началом моноартрита, особенно в дистальных суставах нижних конечностей. Во всех этих случаях показана аспирация синовиальной жидкости. Окончательный диагноз подагры ставят на основании обнаружения кристаллов однозамещенного урата натрия в лейкоцитах из синовиальной жидкости пораженного сустава с помощью поляризационной световой микроскопии (рис. 309-3). Кристаллы имеют типичную игольчатую форму и отрицательное двойное лучепреломление. Их удается обнаружить в синовиальной жидкости более чем 95 % больных с острым подагрическим артритом. Невозможность выявить кристаллы урата в синовиальной жидкости при тщательном поиске и соблюдении необходимых условий позволяет исключить диагноз. Внутриклеточные кристаллы имеют диагностическое значение, но не исключают возможности одновременного существования и артропатии другого типа.
Подагре может сопутствовать инфекция или псевдоподагра (отложение дигидрата пирофосфата кальция). Для исключения инфекции следовало бы окрашивать синовиальную жидкость по Граму и попытаться высеять флору. Кристаллы дигидрата пирофосфата кальция отличаются слабоположительным двойным лучепреломлением и более прямоугольны, чем кристаллы однозамещенного урата натрия. При поляризационной световой микроскопии кристаллы этих солей легко различаются. Прокол сустава с отсасыванием синовиальной жидкости не нужно повторять при последующих приступах, если только не возникает подозрения на другой диагноз.
Аспирация синовиальной жидкости сохраняет свою диагностическую ценность и в бессимптомные межкритические периоды. Более чем в 2/3 аспиратов из первых плюсневых суставов пальцевых фаланг у больных с бессимптомной подагрой удается обнаружить внеклеточные кристаллы урата. Они определяются менее чем у 5 % лиц с гиперурикемией без подагры.
Анализ синовиальной жидкости важен и в других отношениях. Общее число лейкоцитов в ней может составлять 1—70•109/л и более. Преобладают полиморфно-ядерные лейкоциты. Как и в других воспалительных жидкостях, в ней обнаруживают сгустки муцина. Концентрация глюкозы и мочевой кислоты соответствует таковой в сыворотке.
У больных, у которых нельзя получить синовиальную жидкость или не удается обнаружить внутриклеточные кристаллы, предположительно диагноз подагры можно с достаточным основанием поставить, если выявлены: 1) гиперурикемия; 2) классический клинический синдром и 3) выраженная реакция на колхицин. При отсутствии кристаллов или этой высокоинформативной триады диагноз подагры становится гипотетическим. Резкое улучшение состояния в ответ на лечение колхицином — это веский довод в пользу диагноза подагрического артрита, но все же не патогномоничный признак.
Рис. 309-3. Кристаллы моногидрата однозамещенного урата натрия в аспирате из сустава.
Острый подагрический артрит следует дифференцировать от моно- и полиартритов другой этиологии. Подагра — это общее начальное проявление, и многие болезни характеризуются болезненностью и отеком I пальца ноги. К ним относятся инфекция мягких тканей, гнойный артрит, воспаление суставной сумки на наружной стороне I пальца, местная травма, ревматоидный артрит, дегенеративный артрит с острым воспалением, острый саркоидоз, псориатический артрит, псевдоподагра, острый кальцинозный тендинит, палиндромный ревматизм, болезнь Рейтера и споротрихоз. Иногда подагру можно спутать с целлюлитом, гонореей, фиброзом подошвенной и пяточной поверхностей, гематомой и подострым бактериальным эндокардитом с эмболизацией или гноетечением. Подагру при вовлечении в процесс других суставов, например коленных, необходимо дифференцировать от острой ревматической лихорадки, сывороточной болезни, гемартроза и вовлечения в процесс периферических суставов при анкилозирующем спондилите или воспалении кишечника.
Хронический подагрический артрит следует отличать от ревматоидного артрита, воспалительного остеоартрита, псориатического артрита, энтеропатического артрита и периферического артрита, сопровождающегося спондилоартропатиями. В пользу хронической подагры свидетельствуют спонтанное купирование моноартрита в анамнезе, подагрические отложения, типичные изменения на рентгенограмме, а также гиперурикемия. Хроническая подагра может напоминать другие воспалительные артропатии. Существующие эффективные средства лечения оправдывают необходимость усилий по подтверждению или исключению диагноза.
Патофизиология гиперурикемии. Классификация. Гиперурикемия относится к биохимическим признакам и служит необходимым условием развития подагры. Концентрация мочевой кислоты в жидких средах организма определяется соотношением скоростей ее продукции и элиминации. Она образуется при окислении пуриновых оснований, которые могут иметь как экзогенное, так и эндогенное происхождение. Примерно 2/3 мочевой кислоты выводится с мочой (300— 600 мг/сут), а около 1/3 — через желудочно-кишечный тракт, в котором она в конечном счете разрушается бактериями. Гиперурикемия может быть обусловлена повышенной скоростью продукции мочевой кислоты, сниженной ее экскрецией почками или и тем и другим.
Гиперурикемию и подагру можно разделить на метаболическую и почечную (табл. 309-1). При метаболической гиперурикемии повышена продукция мочевой кислоты, а при гиперурикемии почечного происхождения снижена ее экскреция почками. Четко разграничить метаболический и почечный тип гиперурикемии не всегда возможно. При тщательном обследовании у большого числа больных подагрой можно обнаружить оба механизма развития гиперурикемии. В этих случаях состояние классифицируют по преобладающему компоненту: почечному или метаболическому. Эта классификация относится прежде всего к тем случаям, когда подагра или гиперурикемия служат основными проявлениями болезни, т. е. когда подагра не вторична по отношению к другому приобретенному заболеванию и не представляет собой подчиненный симптом врожденного дефекта, обусловливающего вначале какое-то другое тяжелое заболевание, а не подагру. Иногда первичная подагра имеет определенную генетическую основу. Вторичной гиперурикемией или вторичной подагрой называют случаи, когда они развиваются как симптомы другого заболевания или вследствие приема некоторых фармакологических средств.
Таблица 309-1. Классификация гиперурикемии и подагры
| Тип | Метаболический дефект | Наследование |
| Метаболический (10 %) | ||
| Первичный | ||
| Молекулярный дефект неизвестен | Не установлен | Полигенное |
| Обусловленный дефектами специфических ферментов | ||
| Варианты ФРПФ-синте-тазы с повышенной активностью | Гиперпродукция ФРПФ и мочевой кислоты | Сцепленное с X-хромосомой |
| Частичная недостаточность гипоксантингуанинфосфорибозил-трансферазы | Гиперпродукция мочевой кислоты, повышенный биосинтез пуринов de novo вследствие избытка ФРПФ | То же |
| Вторичный | ||
| Обусловленный повышением биосинтеза пуринов de novo | ||
| Недостаточность или отсутствие глюкозо-б-фос-фатазы | Гиперпродукция и недостаточная экскреция мочевой кислоты; болезнь накопления гликогена I типа (фон Гирке) | Аутосомное рецессивное |
| Практически полная недостаточность гипоксантингуанинфосфорибозилтрансферазы | Гиперпродукция мочевой кислоты; синдром Леша— Найхана | Сцепленное с Х-хромосомой |
| Обусловленный ускоренным кругооборотом нуклеиновых кислот | Гиперпродукция мочевой кислоты | |
| Почечный (90%) | ||
| Первичный | ||
| Вторичный |
Гиперпродукция мочевой кислоты. Гиперпродукция мочевой кислоты, по определению, означает экскрецию ее в количестве более 600 мг/сут после соблюдения в течение 5 дней диеты с ограничением пуринов. На долю таких случаев приходится, по-видимому, менее 10 % всех случаев болезни. У больного ускорен синтез пуринов de novo или повышен кругооборот этих соединений. Для того чтобы представить себе основные механизмы соответствующих нарушений, следует проанализировать схему пуринового обмена (рис. 309-4).
Пуриновые нуклеотиды — адениловая, инозиновая и гуаниновая кислоты (соответственно АМФ, ИМФ и ГМФ) — представляют собой конечные продукты биосинтеза пуринов. Они могут синтезироваться одним из двух путей: либо непосредственно из пуриновых оснований, т. е. ГМФ из гуанина, ИМФ из гипоксантина и АМФ из аденина, либо de novo, начиная с непуриновых предшественников и проходя ряд стадий до образования ИМФ, который служит общим промежуточным пуриновым нуклеотидом. Инозиновая кислота может превращаться либо в АМФ, либо в ГМФ. После образования пуриновых нуклеотидов они используются для синтеза нуклеиновых кислот, аденозинтрифосфата (АТФ), циклического АМФ, циклического ГМФ и некоторых кофакторов.
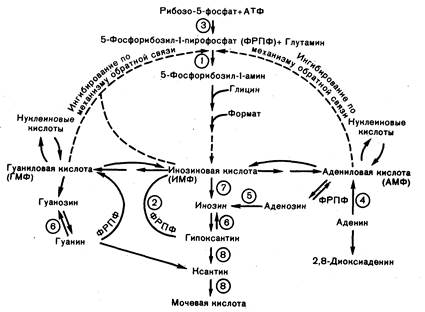
Рис. 309-4. Схема метаболизма пуринов.
1 — амидофосфорибозилтрансфераза, 2 — гипоксантингуанинфосфорибозилтрансфераза, 3 — ФРПФ-синтетаза, 4 — аденинфосфорибозилтрансфераза, 5 — деаминаза аденозина, 6 — пуриннуклеозидфосфорилаза, 7 — 5'-нуклеотидаза, 8 — ксантиноксидаза.
Различные пуриновые соединения распадаются до монофосфатов пуриновых нуклеотидов. Гуаниновая кислота превращается через гуанозин, гуанин иксантин в мочевую кислоту, ИМФ распадается через инозин, гипоксантин и ксантин до той же мочевой кислоты, а АМФ может дезаминироваться в ИМФ и далее катаболизироваться через инозин в мочевую кислоту или превращаться в инозин альтернативным путем с промежуточным образованием аденозина.
Несмотря на то что регуляция пуринового обмена достаточно сложна, основной детерминантой скорости синтеза мочевой кислоты у человека служит, по-видимому, внутриклеточная концентрация 5-фосфорибозил-1-пирофосфата (ФРПФ). Как правило, при повышении уровня ФРПФ в клетке синтез мочевой кислоты усиливается, при снижении его уровня — уменьшается. Несмотря на некоторые исключения, в большинстве случаев дело обстоит именно так.
Избыточная продукция мочевой кислоты у небольшого числа взрослых больных служит первичным или вторичным проявлением врожденного нарушения метаболизма. Гиперурикемия и подагра могут быть первичным проявлением частичной недостаточности гипоксантингуанинфосфорибозилтрансферазы (реакция 2 на рис. 309-4) или повышенной активности ФРПФ-синтетазы (реакция 3 на рис. 309-4). При синдроме Леша—Найхана практически полная недостаточность гипоксантингуанинфосфорибозилтрансферазы обусловливает вторичную гиперурикемию. Эти серьезные врожденные аномалии подробнее обсуждаются далее.
Для упомянутых врожденных нарушений метаболизма (недостаточность гипоксантингуанинфосфорибозилтрансферазы и избыточная активность ФРПФ-синтетазы) определяют менее 15 % всех случаев первичной гиперурикемии, обусловленной повышением продукции мочевой кислоты. Причина повышения ее продукции у большинства больных остается невыясненной.
Вторичная гиперурикемия, связанная с повышенной продукцией мочевой кислоты, может быть связана со многими причинами. У некоторых больных повышенная экскреция мочевой кислоты обусловлена, как и при первичной подагре, ускорением биосинтеза пуринов de novo. У больных с недостаточностью глюкозо-6-фосфатазы (болезнь накопления гликогена I типа) постоянно повышена продукция мочевой кислоты, равно как и ускорен биосинтез пуринов de novo (см. гл. 313). Гиперпродукция мочевой кислоты при этой ферментной аномалии обусловлена рядом механизмов. Ускорение синтеза пуринов de novo отчасти может быть результатом ускоренного синтеза ФРПФ. Кроме того,, повышению экскреции мочевой кислоты способствует ускоренный распад пуриновых нуклеотидов. Оба этих механизма срабатывают из-за дефицита глюкозы в качестве источника энергии, и продукцию мочевой кислоты можно уменьшить постоянной коррекцией гипогликемии, типичной для этого заболевания.
У большинства больных со вторичной гиперурикемией на почве избыточной продукции мочевой кислоты основное нарушение заключается, очевидно, в ускорении кругооборота нуклеиновых кислот. Повышенная активность костного мозга или укорочение жизненного цикла клеток других тканей, сопровождающиеся ускорением кругооборота нуклеиновых кислот, характерны для многих заболеваний, включая миелопролиферативные и лимфопролиферативные, множественную миелому, вторичную полицитемию, пернициозную анемию, некоторые гемоглобинопатии, талассемию, другие гемолитические анемии, инфекционный мононуклеоз и ряд карцином. Ускоренный кругооборот нуклеиновых кислот в свою очередь приводит к гиперурикемии, гиперурикацидурии и компенсаторному повышению скорости биосинтеза пуринов de novo.
Сниженная экскреция. У большого числа больных подагрой эта скорость экскреции мочевой кислоты достигается лишь при уровне урата в плазме на 10—20 мг/л выше нормы (рис. 309-5). Эта патология наиболее отчетлива у больных с нормальной продукцией мочевой кислоты и отсутствует в большинстве случаев ее гиперпродукции.
Экскреция урата зависит от клубочковой фильтрации, канальцевой реабсорбции и секреции. Мочевая кислота, очевидно, полностью фильтруется в клубочках и реабсорбируется в проксимальных канальцах (т. е. подвергается пресекреторной реабсорбции). В нижележащих сегментах проксимальных канальцев она секретируется, а во втором участке реабсорбции — в дистальном отделе проксимального канальца — она еще раз подвергается частичной реабсорбции (постсекреторная реабсорбция). Несмотря на то что какая-то ее доля может реабсорбироваться и в восходящем колене петли Генле, и в собирательном протоке, эти два участка с количественной точки зрения считаются менее важными. Попытки точнее выяснить локализацию и природу этих последних участков и количественно оценить их роль в транспорте мочевой кислоты у здорового или больного, как правило, оказывались безуспешными.
Теоретически нарушенная почечная экскреция мочевой кислоты у большинства больных подагрой могла бы обусловливаться: 1) уменьшением скорости фильтрации; 2) усилением реабсорбции или 3) снижением скорости секреции. Бесспорные данные о роли любого из этих механизмов в качестве основного дефекта отсутствуют; вполне вероятно, что у больных подагрой имеют место все три фактора.
Результатом снижения почечной экскреции мочевой кислоты можно считать и многие случаи вторичной гиперурикемии и подагры. Уменьшение скорости клубочковой фильтрации приводит к снижению фильтрационной нагрузки мочевой кислоты и, тем самым к гиперурикемии; у больных с патологией почек именно поэтому и развивается гиперурикемия. При некоторых болезнях почек (поликистоз и свинцовая нефропатия) постулируется роль и других факторов, таких как сниженная секреция мочевой кислоты. Подагра редко осложняет вторичную гиперурикемию вследствие заболевания почек.
Одной из наиболее важных причин вторичной гиперурикемии служит лечение диуретиками. Вызываемое ими уменьшение объема циркулирующей плазмы приводит к усилению канальцевой реабсорбции мочевой кислоты, равно как и к снижению ее фильтрации. При гиперурикемии, связанной с приемом диуретиков, может иметь значение и уменьшение секреции мочевой кислоты. Ряд других лекарственных средств также вызывает гиперурикемию посредством неустановленных почечных механизмов; к этим средствам относятся ацетилсалициловая кислота (аспирин) в низких дозах, пиразинамид, никотиновая кислота, этамбутол и этанол.
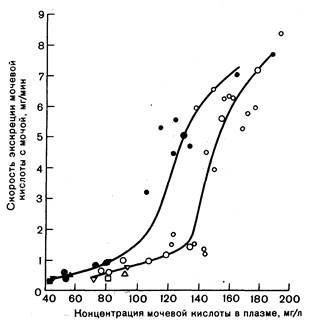
Рис.309-5. Скорость экскреции мочевой кислоты при разных уровнях урата в плазме у лиц, не страдающих подагрой (черные символы), и у больных подагрой (светлые символы).
Крупными символами обозначены средние значения, малыми — индивидуальные данные для нескольких средних значений (степень разброса внутри групп). Исследования проводились в исходных условиях, после приема РНК и после введения урата лития (по: Wyngaarden. Воспроизведено с разрешения Academic Press).
Полагают, что нарушение почечной экскреции мочевой кислоты служит важным механизмом гиперурикемии, сопровождающей ряд патологических состояний. При гиперурикемии, связанной с надпочечниковой недостаточностью и нефрогенным несахарным диабетом, может играть роль уменьшение объема циркулирующей плазмы. При ряде ситуаций гиперурикемию считают результатом конкурентного ингибирования секреции мочевой кислоты избытком органических кислот, которые секретируются, по-видимому, с помощью тех же механизмов почечных канальцев, что и мочевая кислота. Примерами служат голодание (кетоз и свободные жирные кислоты), алкогольный кетоз, диабетический кетоацидоз, болезнь кленового сиропа и лактацидоз любого происхождения. При таких состояниях, как гиперпара- и гипопаратиреоз, псевдогипопаратиреоз и гипотиреоз, гиперурикемия также может иметь почечную основу, но механизм возникновения этого симптома неясен.
Патогенез острого подагрического артрита. Причины, вызывающие начальную кристаллизацию однозамещенного урата натрия в суставе после периода бессимптомной гиперурикемии примерно в течение 30 лет, изучены неполностью. Постоянная гиперурикемия в конце концов приводит к формированию микроотложений в плоских клетках синовиальной оболочки и, вероятно, к накоплению однозамещенного урата натрия в хряще на протеогликанах, обладающих высоким сродством к нему. По тем или иным причинам, включающим, по-видимому, травму с разрушением микроотложений и ускорением кругооборота протеогликанов хряща, в синовиальную жидкость эпизодически высвобождаются кристаллы урата. Ускорять его осаждение могут и другие факторы, такие как низкая температура в суставе или неадекватная реабсорбция воды и урата из синовиальной жидкости.
При образовании в полости сустава достаточного количества кристаллов острый приступ провоцируется рядом моментов, в том числе: 1) фагоцитозом кристаллов лейкоцитами с быстрым высвобождением белка хемотаксиса из этих клеток; 2) активацией калликреиновой системы; 3) активацией комплемента с последующим образованием хемотаксических его компонентов: 4) конечным этапом разрыва кристаллами урата лизосом лейкоцитов, что сопровождается нарушением целостности этих клеток и высвобождением лизосомных продуктов в синовиальную жидкость. Если в понимании патогенеза острого подагрического артрита достигнут определенный прогресс, то вопросы, касающиеся факторов, определяющих спонтанное прекращение острого приступа, и эффекта колхицина, еще ждут ответа.
Лечение. Лечение при подагре предусматривает: 1) по возможности быстрое и осторожное купирование острого приступа; 2) профилактику рецидива острого подагрического артрита; 3) профилактику или регресс осложнений болезни, вызванной отложением кристаллов однозамещенного урата натрия в суставах, почках и других тканях; 4) профилактику или регресс сопутствующих симптомов, таких как ожирение, гипертриглицеридемия или гипертензия; 5) профилактику образования мочекислых почечных камней.
Лечение при остром приступе подагры. При остром подагрическом артрите проводят противовоспалительное лечение. Чаще всего используют колхицин. Его назначают для приема внутрь обычно в дозе 0,5 мг каждый час или 1 мг каждые 2 ч, и лечение продолжают до тех пор, пока: 1) не наступит облегчение состояния больного; 2) не появятся побочные реакции со стороны желудочно-кишечного тракта или 3) общая доза препарата не достигнет б мг на фоне отсутствия эффекта. Колхицин наиболее эффективен, если лечение начинают вскоре после появления симптомов. В первые 12ч лечения состояние существенно улучшается более чем у 75 % больных. Однако у 80 % больных препарат вызывает побочные реакции со стороны желудочно-кишечного тракта, которые могут проявляться раньше клинического улучшения состояния или одновременно с ним. При приеме внутрь максимальный уровень колхицина в плазме достигается примерно через 2 ч. Следовательно, можно предположить, что его прием по 1,0 мг каждые 2 ч с меньшей вероятностью обусловит накопление токсичной дозы до проявления терапевтического эффекта. Поскольку, однако, терапевтическое действие связано с уровнем колхицина в лейкоцитах, а не в плазме, эффективность режима лечения требует дальнейшей оценки.
При внутривенном введении колхицина побочные эффекты со стороны желудочно-кишечного тракта не наступают, а состояние больного улучшается быстрее. После однократного введения уровень препарата в лейкоцитах повышается, оставаясь постоянным в течение 24 ч, и поддается определению даже спустя 10 сут. В качестве начальной дозы внутривенно следует вводить 2 мг, а затем, если необходимо, двукратно повторить введение по 1 мг с интервалом в 6 ч. При внутривенном введении колхицина следует соблюдать специальные предосторожности. Он оказывает раздражающее действие и при попадании в окружающие сосуд ткани может вызвать резкую боль и некроз. Важно помнить, что внутривенный путь введения требует аккуратности и что препарат следует разводить в 5—10 объемах обычного солевого раствора, а вливание продолжать не менее 5 мин. Как при пероральном, так и при парентеральном введении колхицин может угнетать функцию костного мозга и вызывать алопецию, недостаточность печеночных клеток, психическую депрессию, судороги, восходящий паралич, угнетение дыхания и смерть. Токсические эффекты более вероятны у больных с патологией печени, костного мозга или почек, а также у получающих поддерживающие дозы колхицина. Во всех случаях дозу препарата необходимо уменьшить. Его не следует назначать больным с нейтропенией.
При остром подагрическом артрите эффективны и другие противовоспалительные средства, в том числе индометацин, фенилбутазон, напроксен и фенопрофен.
Индометацин можно назначать для приема внутрь в дозе 75 мг, после которой через каждые 6 ч больной должен получать по 50 мг; лечение этими дозами продолжается и на следующие сутки после исчезновения симптомов, затем дозу уменьшают до 50 мг каждые 8 ч (трижды) и до 25 мг каждые 8 ч (тоже трижды). К побочным эффектам индометацина относятся желудочно-кишечные расстройства, задержка натрия в организме и симптомы со стороны центральной нервной системы. Несмотря на то что указанные дозы могут вызывать побочные эффекты почти у 60 % больных, индометацин переносится обычно легче, чем колхицин, и служит, вероятно, средством выбора при остром подагрическом артрите. Для повышения эффективности лечения и уменьшения проявлений патологии больного следует предупредить о том, что прием противовоспалительных средств следует начинать при первых же ощущениях боли. Препараты, стимулирующие экскрецию мочевой кислоты, и аллопуринол при остром приступе подагры неэффективны.
При острой подагре, особенно при противопоказаниях или неэффективности колхицина и нестероидных противовоспалительных средств, пользу приносит системное или местное (т. е. внутрисуставное) введение глюкокортикоидов. Для системного введения, будь то пероральное или внутривенное, следует назначать умеренные дозы в течение нескольких дней, так как концентрация глюкокортикоидов быстро уменьшается и их действие прекращается. Внутрисуставное введение длительно действующего стероидного препарата (например, гексацетонид триамсинолона в дозе 15—30 мг) может купировать приступ моноартрита или бурсита в течение 24—36 ч. Это лечение особенно целесообразно при невозможности использовать стандартную лекарственную схему.
Профилактика. После купирования острого приступа применяют ряд мер, уменьшающих вероятность рецидива. К ним относятся: 1) ежедневный профилактический прием колхицина или индометацина; 2) контролируемое уменьшение массы тела у больных с ожирением; 3) устранение известных провоцирующих факторов, например больших количеств алкоголя или продуктов, богатых пуринами; 4) применение антигиперурикемических препаратов.
Ежедневный прием малых доз колхицина эффективно предупреждает развитие последующих острых приступов. Колхицин в суточной дозе 1—2мг эффективен почти у 1/4 больных подагрой и неэффективен примерно у 5 % больных. Кроме того, эта программа лечения безопасна и практически не сопряжена с побочными эффектами. Однако если не поддерживать концентрацию урата в сыворотке в пределах нормы, то больной будет избавлен только от острого артрита, а не от других проявлений подагры. Поддерживающее лечение колхицином особенно показано в течение первых 2 лет после начала приема антигиперурикемических средств.
Профилактика или стимуляция обратного развития подагрических отложений однозамещенного урата натрия в тканях. Антигиперурикемические средства достаточно эффективно снижают концентрацию урата в сыворотке, поэтому их следует применять у больных с: 1) одним приступом острого подагрического артрита или более; 2) одним подагрическим отложением или более; 3) мочекислым нефролитиазом. Цель их применения заключается в поддержании уровня урата в сыворотке ниже 70 мг/л,; т. е. в той минимальной концентрации, при которой урат насыщает внеклеточную жидкость. Этот уровень может быть достигнут с помощью лекарственных средств, увеличивающих почечную экскрецию мочевой кислоты, или путем уменьшения продукции этой кислоты. Антигиперурикемические средства обычно не оказывают противовоспалительного действия. Урикозурические препараты снижают уровень урата в сыворотке за счет повышения его почечной экскреции. Несмотря на то что этим свойством обладает большое число веществ, наиболее эффективными, используемыми в США, оказываются пробенецид и сульфинпиразон. Пробенецид обычно назначают в начальной дозе 250 мг дважды в сутки. За несколько недель ее увеличивают до обеспечивающей существенное снижение концентрации урата в сыворотке. У половины больных этого удается достичь при общей дозе 1 г/сут; максимальная доза не должна превышать 3,0 г/сут. Поскольку период полужизни пробенецида .составляет 6—12 ч, его следует принимать равными дозами 2—4 раза в сутки. К основным побочным эффектам относятся гиперчувствительность, кожная сыпь и симптомы со стороны желудочно-кишечного тракта. Несмотря на редкие случаи токсического действия, эти побочные реакции вынуждают почти 1/3 больных прекратить лечение.
Сульфинпиразон представляет собой метаболит фенилбутазона, лишенный противовоспалительного действия. Лечение им начинают в дозе 50 мг дважды в сутки, постепенно увеличивая дозу до поддерживающего уровня 300—400 мг/сут за 3—4 раза. Максимально эффективная суточная доза составляет 800 мг. Побочные эффекты сходны с таковыми пробенецида, хотя частота токсического действия на костный мозг может быть выше. Примерно 25 % больных прекращают прием препарата по той или иной причине.
Пробенецид и сульфинпиразон эффективны в большинстве случаев при гиперурикемии и подагре. Помимо непереносимости препаратов, неэффективность лечения может быть связана с нарушением схемы их приема, одновременным приемом салицилатов или нарушенной функцией почек. Ацетилсалициловая кислота (аспирин) в любой дозе блокирует урикозурический эффект пробенецида и сульфинпиразона. Они становятся менее эффективными при клиренсе креатинина ниже 80 мл/мин и прекращают действие при клиренсе 30 мл/мин.
При отрицательном балансе урата, обусловленном лечением урикозурическими препаратами, концентрация урата в сыворотке уменьшается, а экскреция мочевой кислоты с мочой превышает исходный уровень. Продолжение лечения вызывает мобилизацию и выделение избытка урата, его количество в сыворотке уменьшается, а экскреция мочевой кислоты с мочой почти достигает исходных величин. Преходящее усиление ее экскреции, продолжающееся обычно в течение всего нескольких дней, может обусловить образование почечных камней у 1/10 части больных. Для того чтобы избежать этого осложнения, прием урикозурических средств следует начинать с малых доз, постепенно увеличивая их. Поддержание усиленного мочеотделения с адекватной гидратацией и подщелачиванием мочи путем перорального приема гидрокарбоната натрия порознь или вместе с ацетазоламидом уменьшает вероятность камнеобразования. Идеальный кандидат на лечение урикозурическими средствами — это больной в возрасте до 60 лет, соблюдающий обычную диету, с нормальной функцией почек и экскрецией мочевой кислоты менее 700 мг/сут, у которого в анамнезе отсутствуют указания на почечные камни.
Гиперурикемию можно корригировать также с помощью аллопуринола, уменьшающего синтез мочевой кислоты. Он ингибирует ксантиноксидазу (см. реакцию 8 на рис. 309-4), которая катализирует окисление гипоксантина в ксантин и ксантина в мочевую кислоту. Несмотря на то что период полужизни аллопуринола в организме составляет всего 2—3 ч, он превращается главным образом в оксипуринол, который представляет собой столь же эффективный ингибитор ксантиноксидазы, но с периодом полужизни 18—30ч. У большинства больных эффективной бывает доза 300 мг/сут. Из-за длительного периода полужизни главного метаболита аллопуринола его можно вводить один раз в день. Поскольку оксипуринол экскретируется в основном с мочой, его период полужизни при почечной недостаточности удлиняется. В связи с этим при выраженном нарушении функции почек доза аллопуринола должна быть уменьшена вдвое.
Серьезные побочные эффекты аллопуринола заключаются в нарушении функции желудочно-кишечного тракта, кожных высыпаниях, лихорадочном состоянии, токсическом эпидермальном некролизе, алопеции, угнетении функции костного мозга, гепатите, желтухе и васкулите. Общая частота побочных эффектов достигает 20 %; они чаще развиваются при почечной недостаточности. Лишь у 5 % больных их выраженность заставляет прекратить лечение аллопуринолом. При его назначении следует учитывать межлекарственные взаимодействия, так как он увеличивает периоды полужизни меркаптопурина и азатиоприна и усиливает токсичность циклофосфамида.
Аллопуринол предпочитают урикозурическим средствам при: 1) повышенной (более 700 мг/сут при соблюдении общей диеты) экскреции мочевой кислоты с мочой; 2) нарушенной функции почек с клиренсом креатинина менее 80 мл/мин; 3) подагрических отложениях в суставах независимо от функции почек; 4) мочекислом нефролитиазе; 6) подагре, не поддающейся воздействию урикозурических средств из-за их неэффективности или непереносимости. В редких случаях неэффективности каждого препарата, применяемого в отдельности, аллопуринол можно использовать одновременно с каким-либо урикозурическим средством. Это не требует изменения дозы препаратов и обычно сопровождается снижением уровня урата в сыворотке.
Сколь бы быстрым и выраженным ни было снижение уровня урата в сыворотке, на фоне лечения может развиться острый подагрический артрит. Другими словами, начало лечения любым антигиперурикемическим препаратом может спровоцировать острый приступ. Кроме того, при крупных подагрических отложениях даже на фоне уменьшения выраженности гиперурикемии в течение года и более могут возникать рецидивы приступов. В связи с этим перед началом приема антигиперурикемических средств целесообразно начать профилактический прием колхицина и продолжать его до тех пор, пока уровень урата в сыворотке будет находиться в пределах нормы не менее года или пока не растворятся все подагрические отложения. Больные должны знать о возможности обострений в ранний период лечения. Большинству больных при больших отложениях в суставах и/или почечной недостаточности следует резко ограничить потребление пуринов с пищей.
Профилактика острой мочекислой нефропатии и лечение больных. При острой мочекислой нефропатии необходимо немедленно начинать интенсивное лечение. Вначале следует увеличить мочеотделение с помощью больших водных нагрузок и диуретиков, например фуросемида. Мочу ощелачивают, чтобы мочевая кислота превращалась в более растворимый однозамещенный урат натрия. Ощелачивания достигают с помощью гидрокарбоната натрия — порознь или в комбинации с ацетазоламидом. Следует вводить и аллопуринол, чтобы уменьшить образование мочевой кислоты. Его начальная доза в этих случаях составляет 8 мг/кг в день однократно. Через 3—4 дня, если почечная недостаточность сохраняется, дозу уменьшают до 100—200 мг/сут. При мочекислых камнях почек лечение то же, что и при мочекислой нефропатии. В большинстве случаев достаточно сочетать аллопуринол только с потреблением больших количеств жидкости.
Ведение больных с гиперурикемией. Обследование больных с гиперурикемией направлено на: 1) выяснение ее причины, которая может указывать и на другое серьезное заболевание; 2) оценку повреждения тканей и органов и его степень; 3) выявление сопутствующих нарушений. На практике все эти задачи решаются одновременно, поскольку решение относительно значения гиперурикемии и лечения зависит от ответа на все эти вопросы.
Наиболее важны при гиперурикемии результаты анализа мочи на мочевую кислоту. При указаниях в анамнезе на мочекаменную болезнь показан обзорный снимок брюшной полости и внутривенная пиелография. При обнаружении камней в почках могут оказаться полезными анализ на мочевую кислоту и другие компоненты. При патологии суставов целесообразно исследовать синовиальную жидкость и произвести рентгенографию суставов. Если в анамнезе есть указания на контакт со свинцом, может потребоваться определение его экскреции с мочой после вливания кальций-ЭДТА, чтобы диагностировать подагру, связанную со свинцовым отравлением. Если предполагается повышенная продукция мочевой кислоты, может быть показано определение активности гипоксантингуанинфосфорибозилтрансферазы и ФРПФ-синтетазы в эритроцитах.
Ведение больных с бессимптомной гиперурикемией. Вопрос о необходимости лечения больных с бессимптомной гиперурикемией не имеет однозначного ответа. Как правило, лечения не требуется, если только: 1) больной не предъявляет жалоб; 2) отсутствует семейный анамнез подагры, нефролитиаза или почечной недостаточности или 3) экскреция мочевой кислоты не слишком велика (более 1100 мг/сут).
Другие нарушения пуринового обмена, сопровождающиеся гиперурикемией и подагрой. Недостаточность гипоксантингуанинфосфорибозилтрансферазы. Гипоксантингуанинфосфорибозилтрансфераза катализирует превращение гипоксантина в инозиновую кислоту и гуанина в гуанозин (см. реакцию 2 на рис. 309-4). Донором фосфорибозила служит ФРПФ. Недостаточность гипоксантингуанилфосфорибозилтрансферазы приводит к уменьшению расходования ФРПФ, который накапливается в больших, чем в норме, концентрациях. Избыток ФРПФ ускоряет биосинтез пуринов de novo и, следовательно, повышает продукцию мочевой кислоты.
Синдром Леша—Найхана — это заболевание, сцепленное с Х-хромосомой. Характерное биохимическое нарушение при нем заключается в резко выраженной недостаточности гипоксантингуанинфосфорибозилтрансферазы (см. реакцию 2 на рис. 309-4). У больных отмечаются гиперурикемия и чрезмерная гиперпродукция мочевой кислоты. Кроме того, у них развиваются своеобразные неврологические нарушения, характеризующиеся самоувечьями, хореоатетозом, спастическим состоянием мышц, а также задержкой роста и психического развития. Частоту этого заболевания оценивают как 1:100000 новорожденных.
Примерно у 0,5—1,0 % взрослых больных подагрой с избыточной продукцией мочевой кислоты выявляют частичную недостаточность гипоксантингуанинфосфорибозилтрансферазы. Обычно у них подагрический артрит проявляется в молодом возрасте (15—30 лет), высока частота мочекислого нефролитиаза (75%), иногда присоединяется некоторая неврологическая симптоматика, в том числе дизартрия, гиперрефлексия, нарушение координации и/или отставание психического развития. Заболевание наследуется как признак, сцепленный с Х-хромосомой, так что передается мужчинам от женщин-носительниц.
Фермент, недостаточность которого обусловливает это заболевание (гипоксантингуанинфосфорибозилтрансфераза), представляет существенный интерес для генетиков. За возможным исключением семейства генов глобина, локус гипоксантингуанинфосфорибозилтрансферазы — наиболее изученный одиночный ген человека.
Гипоксантингуанинфосфорибозилтрансфераза человека очищена до гомогенного состояния, и определена ее аминокислотная последовательность. В норме ее относительная молекулярная масса составляет 2470, а субъединица состоит из 217 аминокислотных остатков. Фермент представляет собой тетрамер, состоящий из четырех одинаковых субъединиц. Различают и четыре вариантные формы гипоксантингуанинфосфорибозилтрансферазы (табл. 309-2). В каждой из них замена одной аминокислоты приводит либо к утрате каталитических свойств белка, либо к уменьшению постоянной концентрации фермента из-за снижения синтеза или ускорения распада мутантного белка.
Последовательность ДНК, комплементарная информационной РНК (мРНК), которая кодирует гилоксантингуанинфосфорибозилтрансферазу, клонирована и расшифрована. В качестве молекулярного зонда эта последовательность использована для идентификации состояния носительства у женщин из группы риска, у которых обычными способами носительство выявить не удавалось. Ген человека был перенесен в организм мыши с помощью трансплантации костного мозга, зараженного векторным ретровирусом. С определенностью была установлена экспрессия гипоксантингуанинфосфорибозилтрансферазы человека у обработанной таким образом мыши.. Недавно была получена также трансгённая линия мышей, у которых человеческий фермент экспрессируется в тех же тканях, что и у человека.
Сопутствующие биохимические аномалии, обусловливающие выраженные неврологические проявления синдрома Леша—Найхана, расшифрованы недостаточно. При посмертном исследовании головного мозга больных получены признаки специфического дефекта центральных дофаминергических путей, особенно в базальных ганглиях и nucleus accumbens. Соответствующие данные in vivo получены с помощью позитронэмиссионной томографии (ПЭТ), проводившейся у больных с недостаточностью гипоксантингуанинфосфорибозилтрансферазы. У большинства больных, обследованных этим методом, было выявлено нарушение обмена 2'-фтор-дезоксиглюкозы в хвостатом ядре. Связь между патологией дофаминергической нервной системы и нарушением пуринового обмена остается неясной.
Гиперурикемия, обусловленная частичной или полной недостаточностью гипоксантингуанинфосфорибозилтрансферазы, успешно поддается воздействию аллопуринола—ингибитора ксантиноксидазы. При этом у небольшого числа больных образуются ксантиновые камни, но большинство из них с почечными камнями и подагрой излечиваются. Специфических средств лечения при неврологических нарушениях при синдроме Леша—Найхана не существует.
Варианты ФРПФ-синтетазы. Выявлено несколько семей, у членов которых была повышена активность фермента ФРПФ-синтетазы (см. реакцию 3 на рис. 309-4). Все три известных типа мутантного фермента обладают повышенной активностью, что приводит к увеличению внутриклеточной концентрации ФРПФ, ускорению биосинтеза пуринов и усилению экскреции мочевой кислоты. Эта болезнь также наследуется как признак, сцепленный с Х-хромосомой. Как и при частичной недостаточности гипоксантингуанинфосфорибозилтрансферазы, при этой патологии на втором—третьем 10-летии жизни обычно развивается подагра и часто образуются мочекислые камни. У нескольких детей повышенная активность ФРПФ-синтетазы сочеталась с нервной глухотой.
Другие нарушения пуринового обмена. Недостаточность аденинфосфорибозилтрансферазы. Аденинфосфорибозилтрансфераза катализирует превращение аденина в АМФ (см. реакцию 4 на рис. 309-4). Первый человек, у которого была обнаружена недостаточность этого фермента, был гетерозиготным по этому дефекту, клиническая симптоматика у него отсутствовала. Затем было выяснено, что гетерозиготность по этому признаку распространена достаточно широко, вероятно, с частотой 1:100. В настоящее время выявлены 11 гомозигот по недостаточности этого фермента, у которых почечные камни состояли из 2,8-диоксиаденина. Из-за химического сходства 2,8-диоксиаденин легко спутать с мочевой кислотой, поэтому этим больным вначале был ошибочно поставлен диагноз мочекислого нефролитиаза.
Таблица 309-2. Структурные и функциональные нарушения при мутантных формах гипоксантингуанинфосфорибозилтрансферазы человека
| Мутантный фермент | Клинические проявления | Мутация | Функциональные нарушения | ||||
| замена аминокислоты | положение | внутриклеточная концентрация | максимальная скорость | константа Михаэлиса | |||
| гипоксантин | ФРПФ | ||||||
| ГФРТТоронто | Подагра | Arg-Gly | Уменьшена | В пределах нормы | В пределах нормы | В пределах нормы | |
| ГФРТЛондон | » | SerLeu | » | То же | Повышена в 5 раз | То же | |
| ГФРТЭнн-Арбор | Нефролитиаз | Неизвестна | Н | » | » » | В пределах нормы | » » |
| ГФРТМюних | Подагра | SerArg | В пределах нормы | Снижена в 20 раз | Повышена в 100 раз | » » | |
| ГФРТКинстон | Синдром Леша—Найхана | AspAsn | То же | В пределах нормы | Повышена в 200 раз | Повышена в 200 раз |
Примечание. ФРПФ означает 5-фосфорибозил-1-пирофосфат, Arg — аргинин, Gly — глицин, Ser — серин. Leu — лейцин, Asn — аспарагин. Asp— аспарагиновая кислота, — заменена (по Wilson et al.).
Недостаточность дезаминазы аденозина и недостаточность пуриннуклеозидфосфорилазы см. в гл. 256.
Недостаточность ксантиноксидазы. Ксантиноксидаза катализирует окисление гипоксантина в ксантин, ксантина в мочевую кислоту и аденина в 2,8-диоксиаденин (см. реакцию 8 на рис. 309-4). Ксантинурия, первое врожденное нарушение пуринового обмена, расшифрованное на ферментном уровне, обусловлена недостаточностью ксантиноксидазы. В результате у больных с ксантинурией выявляют гипоурикемию и гипоурикацидурию, равно как и усиленную экскрецию с мочой оксипуринов—гипоксантина и ксантина. Половина больных не предъявляют жалоб, а у 1/3 в мочевых путях образуются ксантиновые камни. У нескольких больных развилась миопатия, у трех — полиартрит, который мог быть проявлением вызванного кристаллами синовита. В развитии каждого из симптомов большое значение придают выпадению ксантина в осадок.
У четырех больных врожденная недостаточность ксантиноксидазы сочеталась с врожденной недостаточностью сульфатоксидазы. В клинической картине у новорожденных доминировала выраженная неврологическая патология, что характерно для изолированной недостаточности сульфатоксидазы. Несмотря на то что в качестве основного дефекта постулирована недостаточность молибдатного кофактора, необходимого для функционирования того и другого фермента, лечение молибдатом аммония было малоэффективным. У больного, находившегося полностью на парентеральном питании, развилось заболевание, симулирующее сочетанную недостаточность ксантиноксидазы и сульфатоксидазы. После проведенного лечения молибдатом аммония полностью нормализовалась функция ферментов, что привело к клиническому выздоровлению.
Недостаточность миоаденилатдезаминазы. Миоаденилат-дезаминаза, изофермент аденилатдезаминазы, обнаруживают только в скелетных мышцах. Фермент катализирует превращение аденилата (АМФ) в инозиновую кислоту (ИМФ). Эта реакция представляет собой составную часть пуринонуклеотидного цикла и, по-видимому, важна для поддержания процессов продукции и утилизации энергии в скелетной мышце.
Недостаточность этого фермента определяется только в скелетной мышце. У большинства больных при физической нагрузке появляются миалгии, мышечные спазмы и чувство утомления. Примерно 1/3 больных жалуются на мышечную слабость даже при отсутствии нагрузки. Некоторые больные жалоб не предъявляют.
Заболевание обычно проявляется в детском и подростковом возрасте. Клинические симптомы при нем те же, что и при метаболической миопатии. Уровень креатининкиназы повышен менее чем в половине случаев. Электромиографические исследования и обычная гистология мышечных биоптатов позволяют выявить неспецифические изменения. Предположительно недостаточность аденилатдезаминазы можно диагностировать на основании результатов теста на работоспособность ишемизированного предплечья. У больных с недостаточностью этого фермента продукция аммиака снижена, поскольку заблокировано дезаминирование АМФ. Диагноз следует подтверждать путем прямого определения АМФ-дезаминазной активности в биоптате скелетной мышцы, так как. сниженная продукция аммиака при работе характерна и для других миопатий. Заболевание прогрессирует медленно и в большинстве случаев приводит к некоторому снижению работоспособности. Эффективной специфической терапии не существует.
Недостаточность аденилсукциназы. Больные с недостаточностью аденилсукциназы отстают в психическом развитии и часто страдают аутизмом. Кроме того, они страдают судорожными припадками, у них задержано психомоторное развитие, отмечается и ряд двигательных расстройств. Экскреция с мочой сукциниламиноимидазолкарбоксамидрибозида и сукциниладенозина усилена. Диагноз устанавливают при обнаружении частичного или полного отсутствия активности фермента в печени, почках или скелетных мышцах. В лимфоцитах и фибробластах определяется его частичная недостаточность. Прогноз неизвестен, и специфического лечения не разработано.
Дата добавления: 2015-03-17; просмотров: 1168;
