Медицина ВНУТРЕННИЕ БОЛЕЗНИ
Рак предстательной железы по частоте встречаемости занимает 2-е место среди всех злокачественных опухолей и 3-е место среди причин смерти мужчин в возрасте старше 55 лет (после рака легких и толстой кишки). В 1980 г. в США было зарегистрировано 66 000 новых случаев заболевания и 21 500 случаев смерти от него. Из всех больных, у которых карцинома была идентифицирована после смерти, только у '/з она проявлялась клинически. Мужчины в возрасте до 50 лет заболевают редко, частота рака предстательной железы увеличивается с возрастом.
В различных регионах мира частота встречаемости карциномы значительно варьирует. В соответствующих возрастных группах в США на каждые 100 000 мужчин от рака предстательной железы ежегодно умирают 14 человек, в Швеции — 22, а в Японии — только 2. Однако среди жителей Японии, эмигрировавших в США, частота заболеваемости сходна с таковой среди жителей США. Это обстоятельство позволяет думать о том, что к решающим факторам популяционных различий относятся факторы внешней среды и социальные, а не генетические различия. В то же время лица негроидной популяции в США чаще заболевают раком предстательной железы по сравнению с представителями европеоидной популяции; причины этого в настоящее время еще не выяснены.
Классификация. Некоторые карциномы предстательной железы растут медленно и могут в течение продолжительного периода не проявляться клинически, тогда как другие опухоли отличаются агрессивностью. Правда, еще не известно, могут ли опухоли со временем стать более злокачественными. Тем не менее точная гистопатологическая характеристика первичного очага и объективная оценка состояния лимфатических узлов полости малого таза способствуют правильному пониманию естественного развития опухоли у конкретного больного.
Гистологическая характеристика. Более чем в 95 % случаев рак предстательной железы бывает представлен аденокарциномой, развивающейся из долек железы. Аденокарцинома может развиться в любом отделе железы, но чаще всего развивается в периферических отделах. Опухоль, как правило, бывает многоочаговой. Клетки ее отличаются вариабельностью размеров и формы ядер и ядрышек, степени дифференцирования железистых клеток и содержания в них кислой фосфатазы и муцина. Вся эта полиморфность может быть обнаружена в одной и той же опухоли, однако степень ее биологической агрессивности всегда определяется наименее дифференцированными клеточными элементами. По классификационной схеме, предложенной Gleason, доминирующий признак и любые другие гистологические изменения в ткани опухоли в соответствии со степенью дифференцирования (от наиболее дифференцированных к менее дифференцированным признакам) обозначаются условно цифрами от 1 до 5. Для общей оценки злокачественности опухоли эти цифры суммируются, и, таким образом, сумма для каждой конкретной аденокарциномы должна составлять 2—10. Эта градация отражает и особенности течения болезни, и уровень выживаемости больных.
В других случаях рак предстательной железы бывает представлен чешуйчато-клеточными и переходно-клеточными карциномами, развивающимися в выводных протоках трубчато-альвеолярных железок, карциномой предстательной маточки (остатки мюллеровых протоков), карциносаркомой, развивающейся из мезенхимальных элементов железы, и иногда метастатическими опухолями (как правило, карцинома легкого, меланома, лимфома). Далее по тексту эти опухоли не обсуждаются.
Стадии болезни. Аденокарцинома предстательной железы может распространяться тремя путями: непосредственным прорастанием в окружающие ткани, лимфогенным и гематогенным путями. Капсула железы представляет собой естественное препятствие прорастанию опухоли в окружающие ткани, однако она все же прорастает в расположенные выше структуры (семенные пузырьки и дно мочевого пузыря). При лимфогенном распространении аденокарциномы легче определить границы и объем предстоящего хирургического вмешательства, однако необходимость оперативного лечения во многом зависит от размеров опухоли и ее патогистологической структуры. Только в 1/10 случаев при опухолях, оцениваемых до 5 по Gleason, в процесс вовлекаются лимфатические узлы, тогда как более 70 % опухолей, оцениваемых как 9—10, на момент постановки диагноза распространяется на лимфатические узлы. При лимфогенном пути распространения опухоли в процесс в первую очередь вовлекаются запирательные лимфатические узлы, а затем (в порядке убывания) внутренние подвздошные, подвздошные предкрестцовые и, наконец, околоаортальные узлы. При гематогенном пути распространения опухоль метастазирует чаще всего в кости малого таза, в поясничные позвонки, затем грудные и, наконец, ребра. Реже метастазы появляются во внутренних органах, в первую очередь в легких, затем в печени и надпочечниках. Диффузный метастатический процесс в легких при аденокарциноме предстательной железы встречается редко.
Стандартной схемой для классификации аденокарциномы служит схема, предложенная Whitmore. Согласно ей, в стадии А опухоль при пальпаторном ректальном обследовании не определяется, но может быть выявлена в ткани железы, удаленной по поводу ее гиперплазии или же при аутопсии. Стадия А в свою очередь подразделяется на стадию Ai, при которой высокодифференцированная опухоль определяется лишь в нескольких трансуретральных срезах одной доли железы, и стадию А2, при которой процесс более диффузный. В стадии В опухоль пальпируется, но ограничена предстательной железой. В стадииб1 опухоль бывает представлена одним узлом в одной из долей железы, окруженным здоровой на ощупь тканью. В стадии Б2 железа вовлекается в опухолевый процесс более диффузно. На стадии В при пальпации определяется опухоль, распространяющаяся за пределы предстательной железы, однако отдаленные метастазы отсутствуют. Стадия Г характеризуется метастазами, причем на стадии Г1 они локализуются только в лимфатических узлах полости малого таза, в то время как на стадии Г2 появляются отдаленные метастазы. Любая ранняя стадия (А, Б и В), минуя промежуточные, может перейти непосредственно в стадию Г. Недооценка этой возможности с быстрым метастазированием в регионарные лимфатические узлы и несвоевременно проведенное хирургическое иссечение и гистологическое исследование лимфатических узлов полости малого таза могут стать причиной ошибочного определения стадии болезни. Например, примерно в 1/5 случаев аденокарцинома, классифицируемая как относящаяся к стадии А2 на основании только клинических признаков, в действительности находилась в стадии Г, при которой требуется немедленная операция. Частота невыявленных ранних метастазов гематогенного происхождения и связанные с этим ошибочные определения стадии болезни, к сожалению, неизвестны.
Диагностика. Симптомы и признаки. К моменту постановки диагноза как на ранней, так и на поздней стадии карцинома предстательной железы может не проявляться клинически. Не случайно поэтому, что более чем у 80 % больных диагноз ставят тогда, когда опухоль находится уже в стадии В или Г. К наиболее распространенным клиническим проявлениям заболевания (в уменьшающейся по частоте последовательности) относятся дизурия, затрудненное или учащенное мочеиспускание, полная задержка мочи, боли в спине и боку и гематурия. Наибольшую настороженность в отношении рака предстательной железы у всех мужчин в возрасте старше 40 лет вызывают появление дизурии, учащенного или же затрудненного мочеиспускания при отсутствии признаков механической закупорки мочеиспускательного канала.
Пальпация предстательной железы представляет собой наиболее адекватный предварительный диагностический метод обследования больных на всех стадиях карциномы, за исключением стадии А. Ценность этого метода заключается и в том, что он может проводиться при рутинных клинических обследованиях мужчин. .Задние поверхности боковых долей железы, в которых чаще всего локализуется карцинома, легко пальпируются при ректальном исследовании. Карцинома отличается плотной консистенцией, узловатостью и несимметричностью. Однако следует отметить, что уплотнение предстательной железы может быть обусловлено фиброзными участками при ее доброкачественной гиперплазии, очаговыми инфарктами или образовавшимися в железе камнями. Как при доброкачественных, так и злокачественных опухолях срединная борозда между латеральными долями железы может быть сглажена. При ректальном пальпаторном исследовании может быть выявлено также распространение опухоли за пределы железы и прорастание ею семенных пузырьков. О прогрессировании опухоли свидетельствуют вторичная лимфедема мошонки и/или нижних конечностей и инфильтрирование лимфатических узлов полости малого таза.
При трансректальном зондировании с целью проведения ультразвукового исследования органов и тканей малого таза аденокарциному определяют по асимметричному уплотнению ее ткани. Несмотря на то что этот метод недостаточно чувствителен для постановки окончательного диагноза, однако он может помочь в уточнении степени распространения опухоли на мочевой пузырь и семенные пузырьки. Компьютерная томография позволяет определить границы опухоли и локализацию узлов с целью их дальнейшего аспирационного биопсийного исследования.
Биопсийное исследование. Биопсия предстательной железы необходима для уточнения диагноза. Она показана при обнаружении пальпируемых опухолевидных образований или в тех случаях, когда у мужчины появляются симптомы нарушения мочеиспускания, которые невозможно объяснить. Пункционная биопсия может быть как чреспромежностной, так и трансректальной, причем в первом случае риск бактериального загрязнения меньше, однако трансректальная биопсия позволяет точнее получить материал. Аспирационная биопсия позволяет осуществить цитологическую экспресс-диагностику; кроме того, она более щадящая и менее болезненна для обследуемого. К помощи открытой промежностной биопсии прибегают реже, поскольку она связана с риском по крайней мере временной импотенции; помимо этого, она более травматична. Редко производят и трансуретральную биопсию, поскольку на ранней стадии опухоль локализуется в периферических отделах железы.
Биохимические маркеры. Некоторые биохимические маркеры играют роль в диагностике карциномы предстательной железы. Уровень сывороточной кислой фосфатазы повышается при очаговом злокачественном процессе, чаще всего это происходит при метастазах в костях. Однако не существует достаточно специфичного или чувствительного метода исследования фермента (в том числе встречный иммуноэлектрофорез и радиоиммунный метод). Точно так же ни один из таких биохимических маркеров, как кислая фосфатаза костного мозга, гидроксипролин, холестерин, изолейцин, глицин, аспарагиновая и глутаминовая кислоты, метионин и спермидин, недостаточно специфичны или чувствительны при рутинном скрининге.
Оценка степени метастазирования. Костные метастазы карциномы предстательной железы состоят обычно из остеобластических и остеолитических компонентов. Чаще всего карцинома метастазирует в кости таза и поясничные позвонки, а также в грудные позвонки, ребра, кости черепа и длинные трубчатые кости. Рентгенологическое обследование костей — метод невысокой чувствительности, так как с помощью обычной рентгеноскопии может быть замечен лишь большой участок разрушенной кости. Радиоизотопное сканирование кости с использованием, например, технеция 99, относится к более чувствительным, но недостаточно специфичным методам, поскольку положительные результаты при нем могут быть получены в любом метаболически активном участке кости, в том числе в очагах воспаления, в области заживающего перелома, при остеоартритах и болезни Педжета. Таким образом, при положительных результатах радиоизотопного сканирования костей, когда предполагаются раковые метастазы, необходимо произвести рентгеноскопию с целью исключения других причин накопления радионуклида. Радиоизотопное сканирование костной ткани позволяет осуществлять контроль и за течением болезни, и эффективностью лечения.
К обычным методам диагностики относится исследование иссеченного, вовлеченного в процесс лимфатического узла. На основании результатов этого исследования планируют лечение больного. Как правило, иссекают цепочки наружных и внутренних подвздошных и запирательных лимфатических узлов. Операционное вмешательство может быть этим ограничено или же узлы иссекают одновременно во время операции на предстательной железе или имплантацией радиоактивных бусин. В некоторых лечебных центрах вначале проводят лимфоангиографию или же компьютерное томографическое исследование органов малого таза. При выявлении заинтересованных лимфатических узлов производят их аспирационную биопсию. Оперативную оценку лимфатических узлов необходимо проводить и при отрицательных результатах лимфоангиографии и компьютерной томографии.
Методы лечения. Оперативные методы. Традиционным методом лечения при карциноме предстательной железы служит удаление ее семенных пузырьков. При радикальной промежностной простатэктомии легко создается везикоуретральный анастомоз на фоне незначительного кровотечения, в то время как при заднелобковой простатэктомии создается возможность подхода к лимфатическим узлам полости малого таза. При проведении той и другой операции опытным специалистом риск недержания мочи невелик (примерно 1 % при радикальной промежностной и 1—4 % при радикальной заднелобковой простатэктомии). Ранее у большинства больных после операции наступала импотенция. По мере усовершенствования операционной техники заднелобковой простатэктомии стало возможным сохранение нейроваскулярного снабжения пещеристого тела полового члена, в связи с чем у большинства прооперированных больных половая потенция сохраняется.
Радикальная простатэктомия не показана больным в стадии A1 карциномы, поскольку они излечиваются с помощью резекции только пораженной части предстательной железы. Роль радикальной простатэктомии в стадии А2 не определена. Однако при истинной А2 стадии заболевания, когда отсутствуют признаки метастазов в лимфатических узлах полости малого таза, карцинома может проявлять особую агрессивность, и радикальная операция может стать единственным методом лечения, особенно при анапластической опухоли. И действительно, уровень выживаемости больных после этой операции в течение 3 и 10 лет соответствовал таковому среди мужчин того же возраста из контрольной группы.
Стадия болезни служит прямым показанием радикальной простатэктомии. На этой стадии болезни лишь у 5 % больных раковые узлы размером 1—2 см локализуются в одной доле железы, и почти все больные после операции излечиваются. Больные с истинной стадией Б а могут также стать кандидатами на радикальную простатэктомию.
Эффективность радикальной простатэктомии в стадии В невысока. Правда, после ее проведения у больных могут уменьшаться клинические проявления, обусловленные локальной тазовой симптоматикой, гематурия, обструкция шейки мочевого пузыря и мочеиспускательного канала. Однако в настоящее время еще недостаточен фактический материал, позволяющий судить о преимуществах или недостатках радикальной простатэктомии по сравнению с другими видами лечения на этой стадии болезни. В стадии Г ни радикальная простатэктомия, ни иссечение пораженных лимфатических узлов неэффективны, поэтому следует попытаться лечить больных другими методами.
Лучевая терапия. В настоящее время этот метод занимает основное место в лечении больных с карциномой предстательной железы. Это связано не только с совершенствованием ее техники, но и с тем, что после радикальной простатэктомии развивается импотенция, а в некоторых случаях и недержание мочи. В большинстве случаев облучение проводят по следующей схеме: суммарная доза составляет примерно 60—70 Гр (6000—7000 рад) на область предстательной железы. Курс не превышает б нед, а разовая доза может варьировать. Облучение лимфатических узлов полости малого таза необязательно. К обычным побочным эффектам облучения относятся острый проктит и уретрит, однако они могут быть купированы с помощью местного лечения и исчезают по окончании курса облучения. После полного курса облучения могут развиться и хронические осложнения, например импотенция примерно у 30—60 % больных и проктит у 10—15 % больных, реже — стриктура или фистула прямой кишки или кровотечение из нее. Еще неясно, искореняется ли опухоль после облучения, поскольку у многих больных с замедлившимся или полностью остановившимся ее ростом при повторном биопсийном исследовании обнаруживают раковые клетки. Биологическая агрессивность и степень злокачественности резистентной к облучению опухоли также остается неизвестной.
За большой группой облученных больных наблюдал Bagshaw. Он использовал различную технику и дозы облучения при лечении 1300 больных, ранее лечившихся гормонами. Результаты его наблюдений свидетельствуют о том, что в течение 10 лет выживали примерно половина больных с карциномой в стадии А или Б и примерно '30 % больных в стадии В. Среди больных в стадии Г, подвергшихся облучению, 58 % выживали в течение 5 лет. При проведении других, менее обширных исследований были получены аналогичные результаты. Наиболее эффективно облучение было у больных с опухолью не более 2 см в диаметре. Однако тесной корреляции между размером раковой опухоли и ее чувствительностью к лучевой терапии, по-видимому, не существует.
Фокусное дистанционное облучение может быть использовано в качестве паллиативного средства для купирования болей в костях при метастазах в них, причем продолжительность эффекта может быть разной. Облучение менее эффективно при обструкции мочеиспускательного канала, обусловленной метастазами, поскольку реакция на него может наступить только через 6—8 нед.
Для внутритканевой лучевой терапии осуществляют заднелобковую имплантацию гранул радиоактивного йода (125I), позволяющую целенаправленно облучать ткани-мишени. Внутритканевое имплантационное облучение сопровождается эффектом только при равномерном распределении гранул 125I в тканях предстательной железы, если первичный очаг четко очерчен и его диаметр не превышает 5 см, а -объем опухоли составляет менее 30—40 мл. По предварительным данным, уровень выживаемости в течение 5 лет после иссечения лимфатических узлов полости малого таза и ретролобковой имплантации гранул 125I сопоставим с таковым при других формах лечения. Однако частота дальнейшего прогрессирования опухоли была выше у больных первой группы. При внутритканевом имплантационном облучении половая потенция сохраняется у 90 % больных, а ранние побочные реакции развиваются реже, и они значительно менее выражены по сравнению с таковыми при дистанционной лучевой терапии.
Таким образом, после облучения серьезные осложнения, за исключением импотенции при дистанционном облучении, развиваются редко. Внутритканевая имплан-тационная лучевая терапия наиболее результативна при лечении больных в стадии б1. Вопрос о сравнительной оценке отдаленных результатов после облучения и радикальной простатэктомии при локализованных формах карциномы (стадии А2, б1 и Б2) еще недостаточно изучен, однако проводимые в настоящее время исследования свидетельствуют о том, что лучевая терапия на этих стадиях, по-видимому, менее эффективна, чем радикальная простатэктомия.
Подавление активности андрогенов. Поскольку в норме рост предстательной железы зависит от активности андрогенов яичек (см. гл. 330), вполне логично было ее подавлять при лечении больных с карциномой предстательной железы. Затормозить активность андрогенов можно путем: 1) экстирпации андрогенсинтезирующих тканей (удаление яичек и адреналэктомия); 2) ингибирования продукции гипофизарного гонадотропина и/или адренокортикотропного гормона (АКТГ) с помощью эстрогенотерапии, гипофизэктомии или аналогов гормонов, высвобождающих лютеинизирующий гормон, например лейпролида или бусерелина; 3) подавления синтеза андрогенов в яичках и коре надпочечников с помощью аминоглутетимида; 4) торможения связывания андрогенов с рецепторными протеинами с помощью ципротерона или флутамида.
К наиболее распространенным методам подавления активности андрогенов относятся кастрация и эстрогенотерапия. Поскольку яички ответственны за продукцию более чем 95 % общего количества тестостерона, после двусторонней орхиэктомии в плазме уровень тестостерона снижается с 5 нг/мл до 0,3—0,5 нг/мл. Эстрогены, такие как диэтилстильбэстрол, представляют собой потенциальные ингибиторы высвобождения из гипофиза лютеинизирующего гормона, гонадотропина, регулирующего продукцию тестостерона, поэтому введение эстрогенов может стать причиной снижения уровня тестостерона в плазме до того, который регистрируется после удаления яичек. Максимально уровень тестостерона в плазме снижается после приема 3 мг/сут диэтилстильбэстрола. Другие эстрогены (пролонгированные эстрогены, этинилэстрадиол и фосфат диэтилстильбэстрола) не более эффективны, чем диэтилстильбэстрол. Аналоги гормонов, ответственных за выделение лютеинизирующего гормона, также ингибируют его секрецию, снижая тем самым уровень тестостерона в плазме.
Уровень андрогенов в плазме снижается не только после удаления яичек, введения эстрогенов или аналогов АКТГ, но и после адреналэктомии. Поскольку продукция андрогенов корой надпочечников находится под контролем АКТГ, этот источник андрогенов может быть устранен с помощью гипофизэктомии. Альтернативой хирургической адреналэктомии служит лекарственная и/или удаление яичек с использованием препаратов, подавляющих синтез и/или связывание андрогенов со своими цитоплазматическими протеиновыми рецепторами. Несмотря на то что все эти вспомогательные хирургические и лекарственные методы лечения теоретически должны способствовать снижению уровня андрогенов в плазме, целесообразность их применения при карциноме предстательной железы все же остается дискуссионной.
В течение многих лет стандартным методом лечения при карциноме предстательной железы служил метод подавления активности андрогенов, в том числе с помощью двусторонней орхиэктомии, диэтилстильбэстрола или же комбинации двух этих методов. Это основывалось на тщательном сравнительном изучении клинической симптоматики в разных группах больных, как леченых, так и нелеченых. Эффективность каждого из этих методов была оценена специалистами Объединенной исследовательской группы Управления делами ветеранов. Однако сравнительное изучение уровня выживаемости соответствующих групп больных не позволило установить, какой из методов (большие дозы диэтилстильбэстрола, орхиэктомия или их комбинация) наиболее эффективен при раке предстательной железы (диэтилстильбэстрол по 1 мг/сут может обусловить снижение уровня смертности, поскольку в этой дозе он не только непосредственно снижает уровень тестостерона, но опосредованно ингибирует синтез андрогена).
Предполагается, что при метастазировании карциномы предстательной железы диэтилстильбэстрол в дозе 3 мг/сут на раковую опухоль влияет примерно так же, как и аналоги гормонов, высвобождающие лютеинизирующий гормон. При этом срок жизни больных той и другой группы составляет один год. Осложнения со стороны сердечно-сосудистой системы у больных, получавших эстрогены, развиваются чаще, чем у больных сравниваемой группы. Пока неизвестно, эквивалентна ли продолжительность ремиссии у больных после приема аналогов гормонов, высвобождающих лютеинизирующий гормон, таковой у больных после орхиэктомии или эстрогенотерапии.
Снижение уровня андрогенов в плазме значительно не влияет на продолжительность жизни больного, но при этом боли в костях снимаются у 2/3 больных в стадии Г. Оказывает ли помощь этот вид лечения больным на ранних (бессимптомный период) или же на поздних (период появления симптомов) стадиях Г, неизвестно.
Химиотерапия. Больные, в силу возраста составляющие группу риска по карциноме предстательной железы, труднее поддаются химиотерапии. Эта особенность в сочетании со значительной вариабельностью течения болезни создает значительные трудности для определения эффективности этого лечения. Однако были предприняты попытки оценить ее у больных в стадии Г, которым после рецидива проводили курс гормонотерапии, продолжительность жизни которых составляла не более 7—8 мес. Из химиопрепаратов, используемых для лечения, наиболее изучены фосфат эстрамустина, преднимустин и цисплатина, несколько менее изучено действие 5-фторурацила, мелфалана и гидроксимочевины. После проведения курса лечения полная ремиссия наступает очень редко, и лишь у 1/10 больных в стадии Г наступает частичная ремиссия. Из других сочетаний химиопрепаратов в стадии Г карциномы чаще всего использовались фосфат эстрамустина и преднимустин, а также циклофосфамид с каким-либо другим химиопрепаратом. После лечения ими полная ремиссия наступала крайне редко, и лишь у 1/4 больных и менее состояние незначительно улучшалось. При прогрессировании болезни при появлении симптомов в первую очередь следует провести лечение, направленное на подавление активности андрогенов, однако в некоторых случаях при рецидивах болезни с определенным успехом могут быть использованы сочетания химиопрепаратов.
[1] Кожная лейшманиновая реакция (тест Монтенегро), которая выполняется посредством внутрикожного введения антигенов промастигот, нестандартизована и, как правило, недоступна для широкого применения.
[2] Для описания этих изменений в малых отростках часто используют термин «слияние», хотя истинного слияния клеточных оболочек не происходит.
Медицина ВНУТРЕННИЕ БОЛЕЗНИ
Процесс клинического мышления трудно объяснить. Он основывается на таких факторах, как опыт и обучение, индуктивное и дедуктивное мышление, интерпретация фактов, воспроизводимость и ценность которых непостоянны, и интуиция, которую бывает трудно определить. Для оптимизации клинического мышления был предпринят ряд попыток с целью проведения количественного анализа многих превходящих факторов, включая определение познавательных подходов, используемых врачом при решении трудных проблем, разработку компьютерных систем поддержки принятия решения, которые призваны выделить наиболее важный элемент в этом процессе, и применение теории принятия решения для понимания того, как оно формируется. Каждый из этих подходов внес свой вклад в понимание сути диагностического процесса, тем не менее все они сопряжены с. практическими или теоретическими трудностями, что ограничивает их непосредственное применение у конкретного пациента.
Тем не менее эти предварительные попытки использовать строгость и логику, заложенные в количественном методе, обеспечили существенное понимание процесса клинического мышления, выявили пути его совершенствования и позволили свести к минимуму элементы, снижающие его эффективность. Таким образом, хотя клиническое мышление не может уменьшить сложность или число возникающих проблем, попытки провести количественный анализ этого процесса могут оптимизировать пути их понимания и решения у каждого отдельного больного.
В упрощенном варианте количественное мышление включает пять этапов. Оно начинается с изучения основных жалоб, для чего существуют ключевые вопросы, которые включают в историю настоящего заболевания. Эти вопросы необходимо дополнить данными анамнеза о заболеваниях, перенесенных в недавнем прошлом, данными физикального осмотра, при котором особое внимание уделяют предположительно пораженным органам. На втором этапе врач может выбрать серию диагностических тестов, каждый из которых в силу своей точности и информативности помогает исследовать возможные гипотезы, возникающие в ходе дифференциальной диагностики. Поскольку проведение каждого из тестов требует определенных материальных затрат, сопровождается в той или иной степени риском осложнений и вызывает иногда дискомфорт, перед их назначением врач должен проанализировать достаточность диагностической информации, полученной при сборе анамнеза и физикальном обследовании. Далее, клинические данные должны быть сопоставлены с результатами лабораторных исследований, чтобы определить те патологические состояния, между которыми следует проводить дифференциальную диагностику. На четвертом этапе для того, чтобы выработать рекомендации для пациента, необходимо взвесить относительный риск и преимущества дальнейших диагностических и терапевтических мероприятий. В заключение с выработанными рекомендациями знакомят пациента и после соответствующего обсуждения начинают осуществлять намеченный план лечения. Каждый этап этой упрощенной модели процесса клинического мышления целесообразно проанализировать по отдельности, Ниже приводятся этапы клиничеокого мышления и принятия решения:
1. Изучение жалоб путем клинического исследования (сбор анамнеза и физикальное обследование).
2. Назначение диагностических тестов, каждый из которых обладает определенной точностью и информативностью.
3. Обобщение клинических находок и результатов лабораторных исследований для разработки возможных вариантов диагноза.
4. Сравнительная оценка риска и преимущества альтернативных вариантов дальнейших исследований.
5. Сопоставление плана лечения с учетом пожеланий больного.
Сбор анамнеза и физикальное обследование. Выше уже говорилось о том, что врачи начинают изучение основных жалоб больного с исчерпывающего сбора анамнеза, который включает многие, если не большинство, вопросы, позволяющие получить полное представление о всех системах органов, и путем проведения всеобъемлющего физикального обследования. Однако опытные клиницисты начинают строить гипотезу, основываясь уже на основных жалобах и первых ответах на вопросы, задавая последующие вопросы в таком порядке, который позволяет им оценить первичную гипотезу и при необходимости сократить или внести поправки в перечень возможных диагнозов. Одновременно может разрабатываться только ограниченное число диагностических гипотез, и для подтверждения или отрицания их часто используется одна и та же информация. Подобным же образом из практически неограниченного числа вопросов, которые могут быть заданы, выбирают первоочередные, специфические вопросы, и именно на их основании формируют историю настоящего заболевания. Как правило, из всех ответов выбирают ключевой, например указание на наличие мелены, затем пытаются найти основные возможные объяснения этому явлению, которые после получения ответов на более детальные вопросы систематизируют таким образом, чтобы можно было выбрать и затем проверить основной диагноз. Этот процесс, который носит название «повторная проверка гипотезы», служит эффективным подходом к диагнозу и ему следует отдавать предпочтение среди других методов, с помощью которых можно пытаться получить всю доступную информацию, прежде чем формулировать дифференциальный диагноз.
Пропаганда метода повторной проверки гипотезы не исключает необходимости системного, тщательного сбора полного анамнеза настоящего заболевания, исследования всех систем организма, изучения семейного, социального анамнеза и проведения .физикального обследования пациента. Например, если больной поступает с жалобами на боли в животе, врач может собрать информацию, касающуюся их локализации и характера, а также выяснить, какие факторы провоцируют или облегчают боли. На основании ответов на первичные вопросы у врача возникает подозрение на какое-либо заболевание и он начинает задавать вопросы Ь соответствии с предполагаемым диагнозом. Если характеристики боли позволяют думать о панкреатите, то клиницист может поинтересоваться привычками в отношении потребления алкоголя, приемом диуретиков из группы бензотиодиазида или глюкокортикоидных гормонов. Следует обратить внимание на симптомы, свидетельствующие об одновременном заболевании желчного пузыря, на наличие панкреатита у членов семьи, задать вопросы, направленные на выявление возможной пенетрирующей язвы. Напротив, если жалобы более типичны для эзофагеального рефлюкса, то порядок вопросов должен быть другим. Использование метода повторной проверки гипотезы позволяет врачу получить подробную информацию о том органе, который вероятнее всего поражен, не прибегая к системному и тщательному обследованию всего организма. Данные анамнеза и физикального обследования должны дополнять друг друга. Анамнез нацеливает проведение физикального обследования на определенные органы, в свою очередь результаты физикального обследования должны стимулировать более тщательное изучение конкретных систем и органов.
По мере того, как врач осуществляет на практике процесс клинического мышления, используя данные анамнеза и физикального обследования, может возникнуть целый ряд спорных моментов, которые влияют на правильность процесса принятия решения. Прежде всего данные анамнеза могут быть плохо воспроизводимы. Это связано с тем, что больной меняет свои ответы, или с тем, что разные врачи по-разному формулируют вопросы и интерпретируют ответы. Например, в одном из исследований оценки функционального класса кардиологических больных двумя врачами совпадали приблизительно в половине случаев. При использовании тщательно разработанных стандартизированных вопросников воспроизводимость, так же как и информативность ответов, достоверно возрастает, хотя некоторые пациенты и в этом случае продолжают давать искренние, но противоречивые ответы на вопросы, которые в один и тот же день задают разные опрашивающие. Задавая понятные и по мере возможности конкретные вопросы, можно повысить воспроизводимость и информативность данных анамнеза, но нельзя тем не менее полностью избежать разночтении.
Оценивая воспроизводимость данных при физикальном обследовании, двое исследователей, как правило, приходят к соглашению, если отсутствует какой-либо нечасто встречающийся признак, например увеличение селезенки, но часто расходятся во мнениях, если одному из них кажется, что этот признак присутствует у пациента, у которого его быть не должно. Этот принцип нагляднее всего проявляется, если допустить, что любое соглашение всегда возникает случайно, а вероятность случайного соглашения выше, если признак встречается либо очень часто, либо очень редко. Например, если каждый из двух врачей считает, что 90% пациентов имеют какую-либо патологию, например систолический шум в сердце, то их мнения совпадут в 81% случаев, и это совпадение будет только случайным. В некоторых исследованиях воспроизводимости обычных признаков и симптомов, таких как гепатомегалия, частота истинного соглашения не была намного выше, чем частота случайного совпадения мнений. Частота несовпадения мнений может быть уменьшена путем повышения навыков физикального обследования с помощью постоянных тренировок, путем поиска других коррелирующих физикальных признаков, путем изучения того, как физикальные данные коррелируют с результатами диагностических тестов. В связи с этим, когда врач вдруг обнаруживает какой-либо субъективный клинический признак, по поводу которого могут возникнуть разногласия, например, непредвиденную спленомегалию, он должен, попытаться найти другие изменения, которые могли бы подтвердить ее вероятность, например такие, как гепатомегалия или лимфаденопатия. В некоторых случаях следует рассматривать возможность проведения диагностических исследований, таких как сканирование печени и селезенки, что позволяет объективизировать клинические находки.
Эти замечания по поводу факторов, снижающих воспроизводимость и информативность данных анамнеза и физикального обследования, ни в коем случае не принижают их чрезвычайную важность для клинического мышления. Более того, они подчеркивают необходимость внимательного и тщательного их проведения.
Когда врач на основании данных анамнеза и физикального обследования выносит суждение о диагнозе, он редко бывает в нем полностью уверен. В связи с этим более целесообразно говорить о диагнозе с точки зрения его вероятности. Все еще очень часто эта вероятность выражается не в форме процентов, а с помощью таких выражений, как «почти всегда», «обычно», «иногда», «редко». Поскольку разные люди вкладывают различную степень вероятности в одни и те же термины, это ведет к возникновению недопонимания между врачами или между врачом и пациентом. Врачам следует как можно более точно и при возможности используя цифры давать свои заключения и, если это осуществимо, использовать для выражения вероятности количественные методы. Например, вместо того чтобы говорить, что вероятность обнаружения карциномы толстой кишки рентгенологическими методами мала, лучше, если это возможно, представить точные данные о диагностике новообразования по данным рентгенографии. Вероятность обнаружения карциномы в 10—15% случаев может быть интерпретирована как «небольшая», однако с клинических позиций в этом-случае требуется дальнейшее уточнение диагноза, поскольку последствия гиподиагностики потенциально операбельной опухоли могут быть самыми серьезными.
Хотя наличие таких количественных показателей было бы очень желательно, они обычно отсутствуют в клинической практике. Даже опытные клиницисты часто не в состоянии точно определить вероятность развития тех или иных изменений. Имеется тенденция к гипердиагностике относительно редких заболеваний. Особенно трудно бывает количественно оценить вероятность, которая может быть очень высокой или очень низкой. Например, врач может не знать, какова точная вероятность наличия бактериального менингита или другого заболевания, которое может быть диагностировано с помощью люмбальной пункции у пациента с сильной головной болью: 1 случай из 20 или 1 случай из 200. В обоих случаях вероятность низка, но тем не менее от нее зависит принятие решения о том, делать или нет люмбальную пункцию.
Поскольку установление достоверных диагностических критериев является краеугольным камнем клинического мышления, для разработки статистических подходов к улучшению диагностического предвидения используется накопленный клинический опыт, который часто бывает представлен в форме компьютерных банков данных. В подобных исследованиях обычно идентифицируют факторы, находящиеся в унивариантной корреляции с тем или иным диагнозом. Затем эти унивариантные корреляты могут быть включены в многофакторный анализ, что позволяет определить, какие из них являются достоверными независимыми предикторами диагноза. Некоторые виды анализа позволяют идентифицировать важные факторы предсказания диагноза и затем определить их «вес», который может быть при дальнейшем математическом расчете трансформирован в вероятность. С другой стороны, анализ позволяет выделить ограниченное число категорий пациентов, каждая из которых имеет собственную вероятность наличия того или иного диагноза.
Эти количественные подходы к постановке диагноза, которые часто называют «правилами предсказания», особенно полезны, если они представлены в удобном для использования виде и если их ценность была широко изучена на достаточном числе и спектре пациентов. Например, на основании тщательного отбора ключевых вопросов, используемых при сборе анамнеза, и данных, получаемых при физикальном обследовании, которые позволяют предсказать причины наиболее частых жалоб, предъявляемых амбулаторными больными, были разработаны алгоритмы диагностических исследований, которые могут осуществляться не врачом и требуют вмешательства врача лишь при необходимости. Используя эти алгоритмы, не имеющий врачебного образования персонал под общим руководством врачей может с меньшими затратами, но не менее эффективно осуществлять ту же работу, что и врач, у которого нет такого помощника.
Для того чтобы такие правила предсказания могли оказать реальную помощь клиницистам, они должны быть разработаны на представительных группах больных с использованием доступных воспроизводимых тестов с тем, чтобы полученные результаты могли быть применены в медицинской практике повсеместно. Поскольку только меньшая часть из опубликованных правил предсказания придерживалась строгих критериев, таких как число и спектр обследованных, а также проспективное подтверждение результате», большинство из них пока непригодно для повседневного клинического использования. Более того, многие правила предсказания не могут оценить вероятность каждого диагноза или исхода, с которыми сталкивается клиницист.
Как подчеркивалось в гл. 1, сбор анамнеза и физикальное обследование служат и другим важным целям. Они позволяют врачу оценить эмоциональный статус пациента, понять, как нарушения здоровья сочетаются с условиями общественной и семейной жизни больного, они способствуют возникновению у пациента доверия к врачу, которое так необходимо для достижения согласованности в предстоящих действиях.
Диагностические исследования: показания, точность и ценность. Для назначения диагностических исследований должны быть специфические показания. Чтобы соответствовать этим показаниям, исследования должны быть достаточно точными. Кроме того, они должны быть как можно менее дорогостоящими и (или) наименее опасными из всех возможных в данном случае тестов. Нет абсолютно точных диагностических методов, и врачам часто бывает трудно интерпретировать их результаты. В связи с этим чрезвычайно важно знать несколько наиболее часто используемых при анализе результатов исследований и в эпидемиологии терминов, включая распространенность, чувствительность, специфичность, положительную предсказательную ценность и отрицательную предсказательную ценность (табл. 2.1).
Хотя в сообщениях о точности диагностических тестов обычно используют термины положительная и отрицательная предсказательная ценность, эти расчетные величины зависят от распространенности заболевания в изучаемой популяции (табл. 2.2). Тест, обладающий определенной чувствительностью и специфичностью, имеет различную положительную и отрицательную предсказательную ценность, если применяется в группах с различной распространенностью заболевания. Например, умеренные изменения уровня щелочной фосфатазы у молодого человека с подтвержденной лимфомой свидетельствуют о нарушении функции печени вследствие наличия опухоли, т. е. этот тест скорее всего является истинно положительным, в то время как выявление таких же уровней щелочной фосфатазы при выполнении рутинных профилактических анализов крови у человека того же возраста без клинических симптомов какого-либо заболевания маловероятно указывает на наличие опухоли, т. е. в этом случае результат скорее всего ложно-положительный.
Таблица 2.1. Систематические термины, наиболее часто используемые в эпидемиологических и диагностических исследованиях
| Результаты теста | Патологическое состояние | |
| Имеется | отсутствует | |
| Положительные | а (истинно положительные) | б (ложноположительные) |
| Отрицательные | в (ложноотрица-тельные) | г (истинно отрицательные) |
| Распространение (априорная вероятность) | =(а+в)/(а+б++В+Г) | == число больных/общее число обследованных |
| Чувствительность | =а/(а+в) | == число истинно положительных результатов/ общее число больных |
| Специфичность | ==г/(б+г) | == число истинно отрицательных результатов/число пациентов без данного заболевания |
| Частота ложноотрицательных результатов | =в/(а+в) | = число ложноотрицательных результатов/общее число больных |
| Частота ложноположительных результатов | =б/(б+г) | = число ложноположительных результатов/число пациентов без данного заболевания |
| Положительная предсказательная ценность | =а/(а+б) | == число истинно положительных результатов/число всех положительных результатов |
| Результаты теста | Патологическое состояние | |
| имеется | отсутствует | |
| Отрицательная предсказательная ценность Общая точность | =г/(в+г) =(а+г)/(а+б+ +в+г) | =число истинно отрицательных результатов/ число всех отрицательных результатов == число истинно положительных и истинно отрицательных результатов/ число всех результатов |
Хотя чувствительность и специфичность какого-либо теста не зависят от распространенности заболевания (или процента больных, у которых имеется заболевание, из всех обследованных пациентов), они зависят от состава группы пациентов, у которых этот тест был использован. Например, чувствительность и специфичность метода сцинтиграфии миокарда с пирофосфатом технеция с целью выявления инфаркта (гл. 179) будут практически идеальны, если одну популяцию составляют лица с типичным инфарктом миокарда, имеющие электрокардиографические изменения, характерные для трансмурального инфаркта миокарда, ярко выраженный подъем миокардиального изофермента креатинкиназы (КФК), а другую — здоровые студенты-медики. Если, однако, не изменяя распространенности заболевания в исследуемой популяции, состав обследованных с заболеванием и без заболевания изменить, включив пациентов с другими показателями, например, если популяция больных с инфарктом миокарда состояла бы главным образом из пациентов, у которых инфаркт миокарда не сопровождался изменением зубца Q и умеренным или пограничным подъемом КФК-МБ, а популяция без острого .инфаркта миокарда включала бы пациентов со старым инфарктом и нестабильной стенокардией, чувствительность и специфичность метода могли бы измениться очень заметно. В этой ситуации чувствительность и специфичность сцинтиграфии миокарда с пирофосфатом технеция не только ниже, чем в первом случае, из-за того, что изменился состав пациентов с и без заболевания, но, что значительно более существенно, эти показатели становятся настолько низкими, что тест теряет клиническое значение. Этот пример иллюстрирует также методологические проблемы, которые могут возникнуть, если использовать данные одного исследования в разных группах пациентов или если объединять данные разных исследований, в которых участвовали разнородные группы больных.
Таблица 2.2. Изменение положительной и отрицательной предсказательной ценности одного и того же теста в зависимости от исходной вероятности наличия заболевания

В некоторых ситуациях неточное знание чувствительности и специфичности теста в изучаемой группе пациентов может ограничить его клиническую ценность. Поскольку врач редко знает (или может знать) популяцию пациентов, на которой назначаемый им тест был стандартизован, получаемые результаты обладают информацией, намного менее достоверной, чем принято думать. Более того, для любого диагностического теста увеличение чувствительности будет сопровождаться снижением специфичности. Чем ближе кривая подходит к верхнему левому углу, тем выше динамическая ценность теста; чем ближе к пунктирной линии — тем ниже. При решении вопроса о том, что является нормой, а что болезнью, необходимо определить, какая чувствительность и специфичность наиболее пригодны в данной клинической ситуации.
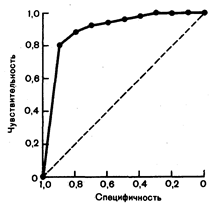
Рис. 2.1. Графическое изображение внутреннего несоответствия чувствительности и специфичности.
Может быть очень трудно отдифференцировать случайную лабораторную ошибку от ложноположительных или ложноотрицательных результатов исследования вследствие наличия у пациента в этот момент еще какого-либо процесса, который может повлиять на получаемые данные, например повышение уровня КК у пациента, который перед обследованием по поводу загрудинных болей выполнил напряженную физическую работу.
Поскольку нельзя ожидать, что какая-либо величина или производный показатель в отдельности могли бы обладать одновременно превосходной чувствительностью и специфичностью, часто бывает необходимо определить, какой показатель является наиболее ценным и необходимым для принятия решения. Графическое изображение (рис. 2.1) кривой, связывающей обсуждаемые характеристики теста, которое показывает неизбежность выбора между стремлением к высокой чувствительности, как, например, при оценке электрокардиограммы, зарегистрированной во время физической нагрузки, как патологической, если на ней имеется депрессия сегмента ST .не менее 0,5 мм, или высокой специфичности, как, например, при определении электрокардиограммы, зарегистрированной во время физической нагрузки, как патологической только в том случае, если депрессия сегмента ST составляет не менее 2,0 мм, может помочь клиницисту понять смысл различных определений «положительных» результатов теста. Подобное графическое изображение свидетельствует о том, что результаты тестов могут быть определены как нормальные или патологические в зависимости от того, учитывается заболевание, если тест обладает высокой специфичностью, или исключается, если тест обладает высокой чувствительностью. Разные тесты могут обладать различной чувствительностью и специфичностью. Чувствительность и специфичность более достоверных тестов выше, чем недостоверность тестов.
Одним из примеров чувствительных тестов служит М-вариант эхокардиографии, который используют для исключения тяжелого аортального стеноза у взрослых: чувствительность этого теста для аортального стеноза приближается к 100%, при этом неизмененная эхограмма аортального клапана фактически исключает диагноз аортального стеноза у взрослых. К сожалению, этот чувствительный тест не очень специфичен. В связи с этим многим больным, у которых при эхокардиографии выявлены изменения аортальных клапанов, требуется проведение дальнейших исследований (например, доплеровская эхокардиография, а возможно, и катетеризация полостей сердца) для установления диагноза (гл. 187). Наиболее распространенным примером умеренно специфичного теста является использование электрокардиограммы для диагностики острого инфаркта миокарда. Поскольку высокая специфичность зависит от характеристики группы исследуемых больных, появление в двух или более соседних отведениях новых подъемов сегмента ST, превышающих 1,0 мм, у пациента, который поступил в срочном порядке с длительными загрудинными болями, напоминающими боли при ишемии миокарда, достаточно специфично, т. е. маловероятно, что эти данные являются ложноположительными. В этих случаях госпитализация больных в отделение интенсивной терапии фактически всегда целесообразна. Однако этот показатель не является чувствительным, поэтому, если бы в отделение интенсивной терапии госпитализировали больных только с подобными электрокардиографическими изменениями, почти половине больных, поступающих в срочном порядке в стационары, необходимая медицинская помощь не была бы оказана.
Для того чтобы оптимизировать клиническую ценность диагностических тестов, полезно накопить собственный опыт работы с ними. Часто получаемые при этом результаты будут значительно отличаться от публикуемых в литературе. Сообщения об эффективности какого-либо теста должны подчеркивать его точность по сравнению с независимым стандартом. Этот тест должен быть использован у целого ряда больных с различной тяжестью изучаемого заболевания, а также у больных, у которых имеются нарушения, являющиеся составной частью дифференциального диагноза. Следует знать воспроизводимость теста, а также обозначить «нормальные пределы» получаемых при использовании этого теста значений. В некоторых случаях проведение исследования или манипуляций, необходимых для установления диагностической ценности данного теста, настолько рискованно, что только узкий круг пациентов может быть включен в исследование, как, например, при оценке информативности абдоминальной компьютерной томографии у больных с подозрением на карциному поджелудочной железы. Если больным с «отрицательными» результатами компьютерной томографии не будет затем выполнена лапаротомия или патологоанатомическое исследование, то ни чувствительность, ни специфичность использования компьютерной томографии с целью выявления Карциномы поджелудочной железы не сможет быть установлена. В подобных ситуациях установленная ценность диагностического теста нельзя считать точн ой, поскольку она не была подтверждена другим методом.
Объединение клинических данных и результатов лабораторных исследований.Хотя, как было показано выше, ни клинические данные, ни результаты лабораторных исследований не могут претендовать на абсолютную точность, их объединение может скорее привести к правильному диагнозу, чем их использование по отдельности. Зная до выполнения исследования вероятность наличия у пациента того или иного заболевания (априорная вероятность) и зная чувствительность и специфичность проводимого исследования, можно рассчитать вероятность, которая будет получена после выполнения исследования,—апостериорная вероятность. Обычным математическим методом объединения клинических данных и результатов лабораторных исследований является байисьяновский анализ, который может быть представлен в виде соотношение (счет) —вероятность (табл. 2.3). Априорная вероятность может быть выражена в виде счета (как, например, на бегах) и умножена на вероятное отношение (которое представляет из себя чувствительность теста, разделенную на разность между 1 и специфичностью теста), что позволяет получить апостериорное соотношение (счет), которое в свою очередь может быть переведено в апостериорную вероятность. Этот подход может быть использован в любой ситуации, когда врач имеет клинические данные, чтобы определить априорную вероятность диагноза и объединить их с результатами, а значит, и с чувствительностью и специфичностью диагностического теста. Многие клинические ситуации могут быть настолько сложными, что определение исходной вероятности какого бы то ни было диагноза или чувствительности и специфичности каждого теста, который может быть выполнен в отдельности, или последовательно выполняемых тестов нецелесообразно. Тем не менее предпринимаемые в этом направлении попытки будут стимулировать критическое мышление, выявлять противоречия, способствовать возникновению новых замыслов оригинальных исследований или же требовать пересмотра прошлого опыта, чтобы в последующем облегчить использование байисьяновского анализа для объединения клинических данных и результатов лабораторных исследований.
Результаты байисьяновского анализа часто могут быть выражены графически, как, например, значение электрокардиограммы, зарегистрированной во время физической нагрузки, для выявления ишемической болезни сердца (рис. 2.2; см. также гл. 189). Эта серия кривых показывает также, как следует рассматривать результаты теста, которые могут попасть в «серую зону», не будучи явно положительными или явно отрицательными.
Таблица 2.3. Пример использования байисьяновского анализа для объединения вероятности с результатами исследования для расчета апостериорной вероятности

" Чувствительность = вероятность положительного результата у пациента с заболеванием
0 (1—специфичность) = вероятность положительного результата у пациента без заболевания
" (1—чувствительность) ==вероятность отрицательного результата у пациента с заболеванием г Специфичность = вероятность отрицательного результата у пациента без заболевания
Одним из ключевых допущений, свойственных большинству подобных анализов, является то, что корреляция между априорной вероятностью и результатами
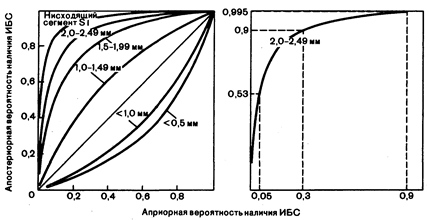
Рис. 2.2. Влияние переносимости теста с физической нагрузкой на вероятность наличия ИБС.
Априорная вероятность наличия ИБС будет уточнена результатами электрокардиограммы, зарегистрированной во время физической нагрузки, на основании чего будет получена апостериорная вероятность наличия ИБС. Обратите внимание на то, что обнаружение депрессии сегмента ST менее 1 мм уменьшает вероятность наличия ИБС, в то время как депрессия сегмента ST не менее 1 мм повышает вероятность. Например, если у пациента, исходная вероятность наличия ИБС у которого составляла 90%, что приблизительно соответствует вероятности, наблюдаемой у мужчины среднего возраста с типичными стенокардитическими симптомами, во время теста с физической нагрузкой отмечена депрессия сегмента ST в пределах 2—2,49 мм, то апостериорная вероятность наличия ИБС у него увеличится до 99,5%. Напротив, если подобные изменения во время теста с нагрузкой будут зарегистрированы у пациента, исходная вероятность наличия ИБС у которого составляет 30%, что можно ожидать у пациентов с атипичными загрудинными болями, то величина апостериорной вероятности у него составит около 90%. У пациента без каких-либо клинических симптомов заболевания, у которого априорная вероятность наличия ИБС всего лишь около 5%, аналогичные результаты теста с физической нагрузкой повысят апостериорную вероятность до 53%. Таким образом, один и тот же результат теста в сочетании с различной априорной вероятностью позволяет получить различные величины апостериорной вероятности (с разрешения New England Journal of Medicine, R. D. Rifkin, W. B. Hood: Bayesian analysis of electrocardiographicexercise stress testin.—N. Engl. J. Med., 1977, 297, 684) теста не больше, чем можно ожидать от случайного совпадения. Если диагностический тест просто дублирует информацию, которая была получена при клиническом обследовании, то он может оказать дополнительную помощь в решении вопроса, имеется или отсутствует заболевание. Например, выявление при физикальном обследовании у больного с карциномой толстой кишки желтухи является достоверным индикатором возможных метастазов в печень. Может быть определена и степень гипербилирубинемии, но уровень билирубина у больного с клинически выраженной желтухой не несет существенной самостоятельной информации, дополняющей ту, которая была получена при тщательном физикальном обследовании. При объединении лабораторных и клинических данных результаты диагностических исследований являются полезными только в том случае, если они дополняют результаты анамнеза и физикального обследования новой информацией, причем полученной с минимальными затратами и риском. Если диагностический тест (такой как ретроградная холангиография, выполняемая у больного с гипербилирубинемией) позволяет получить информацию, недоступную при непосредственном обследовании, то маловероятно, что его результаты могут быть связаны с первичной вероятностью в большей степени, чем можно ожидать при случайном совпадении.
Диагностическое исследование только тогда оказывает влияние на ведение конкретного пациента, если оно в такой степени может изменить диагностическую вероятность, что полученная новая вероятность потребует пересмотра плана обследования или лечения, или если это исследование явится частью комплекса исследований, который также превысит этот порог. Например, у больного подозревают развитие эмболии сосудов легких. Вероятность этого диагноза, основанная только на данных клинического обследования, составляет 50%. Определение вентиляционно-перфузионных отношений с помощью сканирования легких, метода, обладающего «низкой вероятностью», может уменьшить вероятность диагноза эмболии сосудов легких. Однако, если стоит задача исключить эмболию с максимально возможной степенью достоверности, то потребуется проведение легочной ангиографии (гл. 211).
Поскольку диагностические исследования часто не позволяют получить важную новую информацию, даже если нх результаты достаточно точны, перед их назначением следует задать себе несколько вопросов. Первое, какова вероятность того, что имеется именно подозреваемое заболевание? Второе, каковы будут клинические последствия, если диагноз будет поставлен неправильно, или если больной будет получать лечение по поводу заболевания, которого у него нет? Третье, какова вероятность того, что результаты диагностических исследований потребуют пересмотра диагноза или лечения? Врач должен учитывать все варианты диагноза, риск развития осложнений, вероятность получения новой информации и затраты, которые для этого потребуются, а также неблагоприятные последствия задержки проведения исследования, так как наблюдение всегда было одним из распространенных методов диагностики.
Сравнение риска и преимущества метода исследования: аналитический подход к принятию решения. Основой концепции о том, что знание вероятности может привести к принятию решения, является допущение, которое заключается в том, что можно достичь разумного результата, зная соотношение риска (или затрат) и преимуществ различных методов и того, при какой вероятности это соотношение меняется в противоположную сторону. Анализ принятия решения является организованным процессом оценки подобных ситуаций, который позволяет идентифицировать ключевые моменты и проблемы.
Одна из проблем использования аналитического подхода к принятию решения в- трудных клинических ситуациях заключается в том, что аналитическое решение не является чем-то принципиально отличным от тех данных, на которых он базируется, В некоторых случаях попытка аналитического подхода к решению сложной клинической проблемы может не дать иной информации, кроме той, что важные данные, которые требуются для проведения анализа, отсутствуют и что дополнительные исследования в этом направлении должны быть выполнены. Кроме того, если клиницисты сомневаются л выборе плана обследования и лечения, то формальный анализ может указать, что различия между разными подходами очень незначительны. В этих случаях формальный анализ может содержать внутреннюю ошибку, которая не зависит от воли врача. Даже когда польза от аналитического решения очевидна, врач не всегда может иметь достаточно времени для выполнения оценок и расчетов, необходимых для принятия решения у постели больного. Тем не менее значение аналитического подхода к принятию решения заключается в том, что он объединяет доступную информацию, принуждает к строгому мышлению и обнаруживает наши сомнения и недостаток, знаний.
Аналитический подход к принятию решения условно состоит из двух основных положений процесса принятия решения. первое, решения (или варианты), доступные врачу, и второе, возможные ситуации, к которым может привести каждое решение. Для того чтобы проиллюстрировать этот процесс в действии, можно рассмотреть принятие решения о том, следует ли выполнять биопсию мозга, проводить лечение или наблюдать при подозрении на наличие герпетического энцефалита (гл. 136). На рис. 23 изображена схема решения этой проблемы. Квадрат, обозначенный буквой А. является тем решением, которое врач должен принять. Круги, обозначенные буквами от Б до И. указывают возможные исходы, каждый из которых имеет свою определенную вероятность. В этом анализе первичными вариантами являются: проводить лечение видарабнном (Vidarabin), относительно токсичным препаратом, не проводить лечение видарабином или выполнить биопсию мозга, с тем чтобы использовать ее результаты для принятия решения о лечении. И назначение видарабина и биопсия могут привести к развитию осложнений.
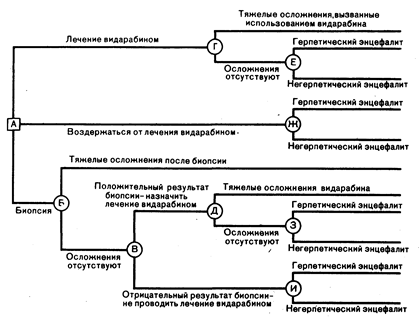
Рис. 2.3. Схема принятия решения для проведения обследования и лечения при подозрении на энцефалит, вызванный вирусом простого герпеса.
Квадрат обозначает решение, круги — его последствия. Детали см. в тексте (с разрешения М. Barza, S. G. Paiiker. The decision to biopsy, treat, or wait in suspected herpes encephalitis. --Ann. Intern. Med., 1980, 92, 644).
Каждый из исходов для пациента обычно имеет определенную «пользу». т. е. относительное предпочтение того или иного исхода, где 1,0 означает идеальный исход, а 0 — наихудший из всех возможных исходов. Каждая конечная ветвь схемы принятия решения имеет определенную пользу, соответствующую данному исходу, и «ожидаемое значение» каждой конечной ветви рассчитывается путем умножения вероятности на пользу. Для того чтобы рассчитать «ожидаемое значение» каждого из трех возможных вариантов действия (см. рис. 2.3, А), следует сложить ожидаемые значения каждой из конечных ветвей, которые исходят из этого пункта. Наиболее предпочтителен тот вариант действия, при котором, при учете всех возможных исходов, получается максимальное ожидаемое значение, которое является суммой произведения вероятности, умноженной на пользу при каждом возможном исходе.
Осуществляя любой аналитический подход, следует знать или определить относительные вероятности, что часто требует предположений. Далее, польза
Дата добавления: 2015-03-17; просмотров: 1061;
