УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКОВЫХ МОЛЕКУЛ
Первичная структура — это конфигурация полипептидной цепи, которая формируется в результате образования пептидной связи между остатками АК.
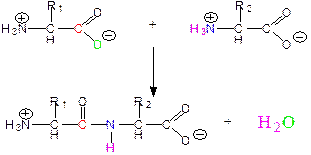
Постулаты (принципы формирования пептидной связи), сформулированные Л. Поллингом и Р. Кори:
1) атомы, образующие пептидную связь, копланарны (расположены в одной плоскости); вращение атомов или групп атомов вокруг пептидной связи невозможно;
2) принцип эквивалентности вклада АК-остатков в образование пептидной связи и, тем самым, в образование полипептидной цепи (исключение пролин);
3) принцип максимума водородных связей.
Первичную структуру белка стабилизируют (поддерживают):
- пептидные связи (между АК-остатками);
- дисульфидные связи (между свободными –SH-группами цистеина).
Первичная структура белка несет информацию о его пространственной структуре.
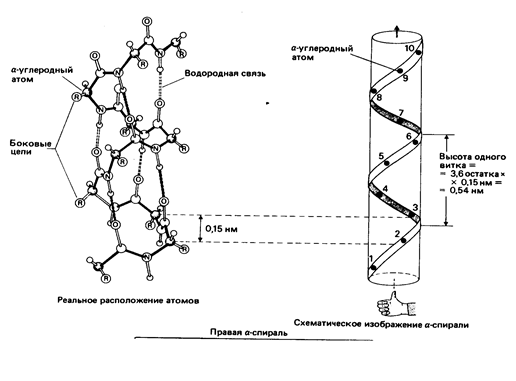
Вторичная структура белка —локальная конформация, обусловленная вращением отдельных участков полипептидной цепи вокруг одинарных ковалентных связей.
Основные связи, которые стабилизируют вторичную структуру, — водородные.
Виды вторичной структуры:
· α-спираль (правозакрученная)
· β-структура • β-слой
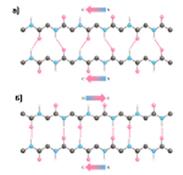
| Параллельная Антипараллельная | 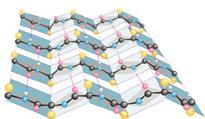
|
· β-поворот
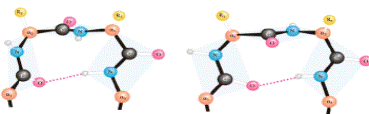
Несколько участков полипептидной цепи, организованных в пространстве в форме a-спирали или b-структуры, могут объединяться, формируя надвторичную структуру. В результате в молекуле белка образуются домены (функциональные или структурные).
Третичная структура белка —это расположение в пространстве всей полипептидной цепи, отдельные участки которой имеют собственную локальную конформацию.
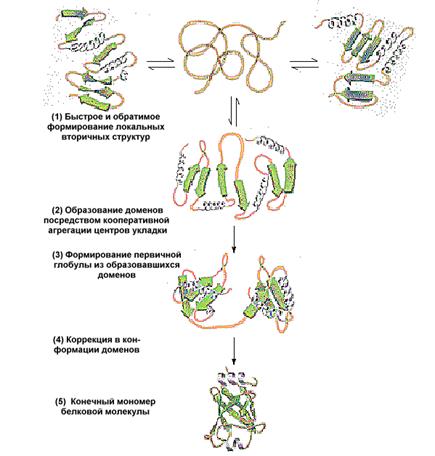
Этапы формирования третичной структуры (см. рис.):
Поддержанию третичной структуры белка способствуют гидрофобные связи, которые образуются внутри молекулы. В образовании этих связей принимают участие неполярные радикалы аминокислот. Могут также образовываться другие нековалентные связи.
У белка, имеющего третичную структуру, на поверхности молекулы формируется участок, который может присоединять к себе другие молекулы, называемые лигандами. Этот участок называется активный центр и формируется из радикалов аминокислот, которые сближаются друг с другом при формировании третичной структуры. Высокая специфичность взаимодействия белка с лигандом обеспечивается комплементарностью структуры активного центра структуре лиганда.
Четвертичная структураформируется при объединении нескольких полипептидных цепей, имеющих третичную структуру. Образованный таким образом белок обладает новой функцией.


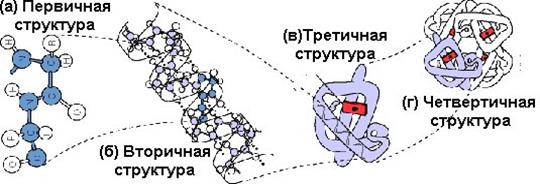
Белки с четвертичной структурой называются олигомерными, а составляющие их индивидуальные полипептидные цепи — протомерами или мономерами. Такие соединения стабилизируются водородными связями и электростатическими взаимодействиями между АК-остатками, расположенными на поверхности протомеров.
Преимущества белков с четвертичной структурой:
1) экономия генетического материала;
2) уменьшение числа ошибок при синтезе белка;
3) качественное разнообразие белков — появление у белков новых функций.
Дата добавления: 2015-03-11; просмотров: 984;
