Ионный состав воды
Сущность ионного обмена заключается в способности специальных материалов (ионитов) изменять в желаемом направлении ионный состав обрабатываемой воды. Иониты представляют собой нерастворимые высокомолекулярные вещества, которые благодаря наличию в них специальных функциональных групп способны к реакциям ионного обмена, т.е. они способны поглощать из раствора положительные или отрицательные ионы в обмен на эквивалентные количества других ионов, содержащихся в ионите, имеющих заряд того же знака. По знаку заряда обменивающихся ионов иониты разделяются на катиониты и аниониты. Способность ионитов к обмену ионами с раствором определяется их строением. Иониты состоят из нерастворимой твердой основы (матрицы), которая при помещении ее в воду способна увеличивать свой объем в 1,1—2,0 раза за счет взаимодействия с полярными молекулами Н2О, что дает возможность взаимной диффузии обменивающихся ионов после завершения синтеза и превращения матрицы в ионит.
Полученную матрицу обрабатывают химическими реагентами, прививая к ней специальные функциональные группы, замещающие в бензольных кольцах ионы водорода и способные к диссоциации в растворах. Фиксированный на матрице ион (часть функциональной группы) определяет возникновение заряда и носит название потенциалообразующего. Заряд каркаса компенсируется зарядом ионов противоположного знака, называемых противоионами (рис. 4.1). Противоионы образуют диффузный слой, они подвижны вокруг матрицы и могут быть заменены другими ионами с зарядом того же знака. Появление потенциалообразующих ионов и противо-ионов может происходить не только за счет диссоциации функциональных групп, но и за счет адсорбции функциональными группами из раствора ионов с каким-либо знаком заряда. Обычно матрицу с фиксированными ионами обозначают символом R, а противоион — химическим символом, например, RNa — катионит с обменным ионом (противоионом) натрия, a ROH — анионит с обменной гидроксильной группой.

Рисунок 4.1 – Структуры элементов объема ионитов:
а – катионит; б – анионит; 1 – матрица; 2 – потенциалообразующие фиксированные ионы; 3 – ионы диффузионного слоя.
Вода всегда электрически нейтральна, поэтому сумма концентраций содержащихся ней катионов равна сумме концентраций анионов при условии, что они выражены в мгэкв/л:
∑СК = ∑СА
Это уравнение называется уравнением электронейтральности раствора, которым пользуются при проверке правильности анализа воды.
Таблица 4.1 – Ионный состав воды
| Катионы | Анионы |
| Водород H+ | Гидроксильный OH- |
| Натрий Na+ | Бикарбонатный HCO3- |
| Калий K+ | Карбонатный CO32- |
| Аммоний NH4+ | Нитритный NO2- |
| Кальций Ca2+ | Нитратный NO3- |
| Магний Mg2+ | Хлоридный Cl- |
| Медь Cu2+ | Фторидный F- |
| Железо Fe2+ | Сульфатный SO42- |
| Железо Fe3+ | Силикатный SiO32- |
| Алюминий Al3+ | Ортофосфатный PO43- |
| Гидросульфидный HS- |
Двухвалентное железо встречается в подземных водах чаще всего в виде бикарбонатов Fe(HCO3)2. Соединения 3-хвалентного железа встречаются в поверхностных водах, и находится в коллоидном состоянии Fe(OH3). Если в природных водах содержаться соединения азота, а именно ионы аммония NH4+, нитрат и нитрит ионы NO3- ,NO2- это свидетельствует о том, что источник водоснабжения загрязнен хозяйственно бытовыми стоками. Химически чистая вода является очень слабым электролитом. Примерно 1 из 10 млн. молекул диссоциирует на ионы:
H2O↔H+ + OH-
Отрицательный логарифм концентрации ионов водорода называется водородным показателем:
pH = -lg[H+]
Для химически чистой воды pH = 7. В зависимости от значения pH водного раствора оценивается реакция среды. При 1 ≤ pH < 3 – реакция среды кислая; 4 < pH < 6 – слабо кислая; pH = 7– нейтральная; 8 < pH < 10 – слабощелочная; 11 < pH ≤ 14 – щелочная.
Вода для питьевых целей по ГОСТ 2874-82 имеет pH =6,5…9,0.
4.2 Обработка воды методом ионного обмена
Обработка воды методом ионного обмена основана на пропуске исходной или частично обработанной воды через слой ионно-обменного материала практически нерастворимого в воде, но способного взаимодействовать с содержащимися в воде ионами. Обрабатываемая вода пропускается через фильтры, загруженные ионитами. Просачиваясь между зернами ионита, обрабатываемая вода обменивает часть ионов растворенных в ней электролитов на эквивалентное количество ионов ионита, в результате чего изменяется ионный состав, как фильтруемой воды, так и самого ионита. Материалы, обладающие свойствами обмена катионами называются катионитами, а анионами – анионитами. Для получения нужной формы ионита проводится регенерация. Катиониты при регенерации их растворами NaCl, H2SO4, NH4Cl образуют соответственно натриевую, водородную или аммонийную форму, которая условно обозначается NaR, H2R, NH4R. При пропуске воды содержащей катионы Са2+ и Mg2+ через отрегенерированный катионит протекает реакция обмена ионов кальция Са2+, Mg2+ на ионы Na+, H+ или NH4+, содержащиеся в катионите. Этот процесс называется катионированием. Аниониты, отреагировавшие с щелочами (чаще всего NaOH) образуют гидроксидную форму, условно обозначаемую ROH, если через регенерирующий анионит пропускать раствор кислоты, например HCl произойдет реакция обмена анионов – анионирование и осуществится взаимная нейтрализация ионов Н+ и гидроксидионов ОН-, вытесненных анионами из анионита.
По своей химической природе все катиониты являются кислотами, а все аниониты – основаниями. В зависимости от состава функционально-активных групп типы ионитов различаются по кислотности и основности. Катиониты разделяют на сильно, средне и слабо кислотные и соответственно аниониты на средне, сильно и слабо основные.
Как катионирование, так и анионирование получили широкое применение на ТЭС для умягчения, обессоливания и обескремнивания добавочной питательной воды парогенераторов, загрязненных конденсатов и подпиточной воды тепловых сетей.
Обработка воды методом ионного обмена принципиально отличается от обработки воды методом осаждения тем, что удаляемые из нее примеси не образуют осадка, и тем, что такая обработка не требует непрерывного дозирования реагентов. В связи с этим эксплуатация водоподготовительных установок, работающих по методу ионного обмена, значительно проще, габариты аппаратов меньше, а эффект обработки выше, чем установок работающих по методу осаждения.
В качестве ионитов в РФ используются сульфоуголь и синтетические смолы, относящиеся к разряду пластических масс.
Протекая через ионит, первоначально насыщенный ионами А (рис. 4.2), обрабатываемый раствор, содержащий ионы В, будет постоянно контактировать с новыми слоями свежего (неиспользованного) ионита. Со временем верхние слои ионита отдадут все ионы А и потеряют свою ионообменную способность, они как бы истощатся (зона а). Вследствие этого переходная зона, в которой происходит ионный обмен (зона b), будет все дальше и дальше перемещаться вниз по слою. При определенных условиях эта зона достигает стационарной ширины. Распределение концентраций обменивающихся ионов в этой зоне носит название фронта фильтрования. В нижних слоях (зона с) ионит еще полностью насыщен ионами А. Когда нижняя граница переходной зоны достигнет конца  слоя ионита, наступит проскок иона В в фильтрат, что служит обычно сигналом для отключения фильтра на регенерацию.
слоя ионита, наступит проскок иона В в фильтрат, что служит обычно сигналом для отключения фильтра на регенерацию.
Рисунок 4.2 – Схема ионообменного процесса в ионитном фильтре:
· - ионит, насыщенный ионами А;
o - ионит, насыщенный ионами В.
 В зависимости от коэффициента селективности обменивающихся ионов может сформироваться острый фронт фильтрования, который переносится параллельно, или размытый (диффузный), расширяющийся при движении по высоте слоя ионита. Кривая, показывающая зависимость концентрации примесей в фильтрате от времени работы фильтра (или объема пропущенного через фильтр раствора), носит название выходной кривой. Примеры выходных кривых при остром и диффузном фронтах фильтрования приведены на рис. 4.3.
В зависимости от коэффициента селективности обменивающихся ионов может сформироваться острый фронт фильтрования, который переносится параллельно, или размытый (диффузный), расширяющийся при движении по высоте слоя ионита. Кривая, показывающая зависимость концентрации примесей в фильтрате от времени работы фильтра (или объема пропущенного через фильтр раствора), носит название выходной кривой. Примеры выходных кривых при остром и диффузном фронтах фильтрования приведены на рис. 4.3.
Рисунок 4.3 – Фронты фильтрования и выходные кривые в ионитных фильтрах:
1 – диффузионный фронт фильтрования; 2 – выходная кривая при диффузионном слое; 3 – острый фронт фильтрования; 4 – выходная кривая при остром фронте; х – высота слоя ионита; t - время работы фильтра.
От вида кривой фронта фильтрования зависит степень использования обменной емкости при работе фильтра, поэтому при обосновании ионообменной технологии иониты подбирают так, чтобы сорбция наиболее важных ионов в водоподготовке происходила при остром фронте фильтрования.
На формирование фронта фильтрования влияют также гидродинамические процессы, определяемые скоростью фильтрования, структурой зернистого слоя, конструкцией дренажных устройств и рядом других факторов.
4.3 Na – катионирование
Этот процесс применяют для умягчения воды путем фильтрования ее через слой катионита в натриевой форме (содержащего в качестве обменных ионов катионы натрия Na), для чего предварительно катионит регенерируется NaCl.
При Na – катионировании протекают реакции:
NаR + Ca(HCO3)2 → CaR2 + 2NаНCO3
2NaR + Mg(HCO3)2 → MgR2 + 2NaHCO3
2NaR + CaCl2 → CaR2 + 2NaCl
2NaR + CaSO4 → CaR2 + Na2SO4
Как видно из приведенных реакций из обрабатываемой воды удаляются катионы Са2+ и Mg2+, а в обрабатываемую воду поступают катионы Nа2+, анионный состав воды и ее щелочность при этом не изменяется, а солесодержание ее несколько возрастает.
Одноступенчатым Na–катионированием можно получить воду с остаточной жидкостью до 0,1 мгэкв/л. Однако для более глубокого умягчения воды достаточной жесткости 0,01 – 0,02 мгэкв/л требуется существенно увеличивать удельный расход соли на регенерацию фильтра, причем необходим тщательный контроль за ''проскоком'' жесткости.
Процесс умягчения при Na-катионировании заканчивается при наступлении ''проскока'' жесткости (рис. 4.4), после чего истощенный катионит в фильтре надо регенерировать, т.е. восстанавливать его способность к обмену ионами. Регенерацию истощенного катионита проводят пропуском через него 6—10 %-ного раствора NaCl. Вследствие относительно большой концентрации ионов Na в регенерационном растворе происходит замена ими поглощенных ранее катионов Са2+ и Mg2+ по реакциям:
R2Ca + nNa+ ↔ 2RNa + Ca2+ + (n-2)Na+;
R2Mg + nNa+ ↔ 2RNa + Mg2+ + (n-2)Na+,
 где п — избыток NaCl против его стехиометрического количества.
где п — избыток NaCl против его стехиометрического количества.
Рисунок 4.4 – Выходная кривая Nа-катионитного фильтра
Несмотря на то, что процесс обмена ионов, в том числе и при регенерации ионита, характеризуется эквивалентностью, для качественной регенерации ионитов расход реагента выбирается с определенным избытком п. При подаче раствора соли в фильтр лучше будет отрегенерирован лобовой катионит, контактирующий со свежим раствором. По мере прохождения раствора в глубинные части катионита условия регенерации будут ухудшаться вследствие повышенияконцентрации в регенерационном растворе ионов Са2+ и Mg2+, вытесненных из верхних слоев катионита при обеднении регенерата ионами Na+. Аналогичное действие проявляется за счет загрязнения раствора технической соли NaCl ионами Са2+ и Mg2+.

Рисунок 4.5 – Влияние расхода соли на эффект регенерации катионита
Эффект повышения обменной емкости с увеличением расхода соли при регенерации показан на рис. 4.5, из которого следует, что эффект прироста обменной емкости с увеличением расхода более 300 г/г-экв заметно снижается.
В схеме двухступенчатого Na – катионирования недостатки одноступенчатого катионирования устраняются, и обеспечивается надежно остаточная жесткость фильтра менее 0,01 мгэкв/л. Число ступеней катионирования определяется требованиями к питательной воде. Так для паровых экранированных котлов, где требуется глубокое умягчение воды целесообразно применение схемы двухступенчатого Na – катионирования. Для горячего водоснабжения, если требуется частичное умягчение достаточно одной ступени катионирования.
Основным недостатком Na – катионирования является превращение карбонатной жесткости воды в бикарбонат натрия, обусловливающий высокую натриевую щелочность котловой воды, так как в парогенераторе бикарбонат натрия превращается в карбонат и гидроксид натрия.
Ca(HCO3)2 + 2Na+R- → Ca2+R2- + 2NаНCO3
2NaHCO3 → Na2CO3 + H2O + CO2↑
H2O + Na2CO3 →(t) 2NaOH + CO2
Умягчение путем Na – катионирования применимо для воды с относительно малой карбонатной жесткостью, превращение которой в бикарбонат натрия не вызывает чрезмерного увеличения продувки парогенераторов, а также не создает опасной для парогенераторов повышенной относительной щелочности котловой воды.
4.4 Н – катионирование
Обработка воды методом Н-катионирования предназначается для удаления всех катионов из воды с заменой их на ионы водорода. Вода за Н-катионитными фильтрами содержит избыток ионов водорода и вследствие этого имеет кислую реакцию, поэтому эта технология применяется совместно с другими процессами ионирования — Na-катионированием или анионированием.
Метод Н – катионирования основан на пропуске обрабатываемой воды через катионит отрегенерированной кислоты. В процессе фильтрования катионы, содержащиеся в обрабатываемой воде, обмениваются на ионы водорода, содержащиеся в катионите, при этом протекают следующие реакции:
2HR + Ca(HCO3) → CaR2 + 2CO2 + 2H2O
2HR + Mg(HCO3) → MgR2 + 2CO2 + 2H2O
2HR + CaCl2 → CaR2 + 2HCl
2HR + CaSO4 → CaR2 + H2SO4
HR + NaCl → NaR + HCl
2HR + Na2SO4 → 2NaR + H2SO4
Наряду с вышеприведенными реакциями протекает процесс вытеснения из катионита ранее поглощенных ионов Na+ ионами Ca2+ и Mg2+, вследствие чего катионит по ионам натрия истощается быстрее, чем по ионам Ca2+ и Mg2+, которые, являясь двухвалентными, сорбируются катионитом лучше. Из-за неодинаковой сорбируемости ионов различной природы их ''проскок'' в фильтрах происходит неодновременно. При Н – катионировании природных вод до момента проскока Na в Н – катионированной воде содержаться только кислоты, при этом кислотность фильтра получается равной суммарной концентрации хлоридов и сульфатов в обрабатываемой воде. При работе Н – катионитового фильтра от момента ''проскока'' Na до момента проскока жесткости в фильтрате происходит нарастание концентрации Na и соответственно снижается кислотность воды.
В зависимости от требования к качеству обработанной воды технология воды Н – катионирования видоизменяется, Н – катионирование с удалением из воды Na осуществляется в системах частичного или полного химического обессоливания воды. Для снижения щелочности обрабатываемой воды возможно осуществление схемы параллельного Н-Na катионирования. Однако благодаря ряду преимуществ более широкое применение нашла схема Н – катионирования с ''голодной'' регенерацией фильтров и последующим Na – катионированием. Все технологические схемы Н-Na катионирования воды преследуют цель умягчения воды и одновременного снижения ее щелочности и солесодержания, а также удаления углекислоты.
4.5 Схема Н-катионирования с ''голодной'' регенерацией
При обычном Н – катионировании регенерация проводится с удельным расходом кислоты в 2-2,5 раза больше теоретически необходимого, который отвечает процессу эквивалентного обмена катионов между раствором и катионитом. Избыток кислоты, не участвующей в реакциях обмена ионов, сбрасывается из фильтров вместе с продуктами регенерации. При голодной регенерации Н-катионитового фильтра удельный расход кислоты равен его теоретическому расходу (удельному), т. е. 1 гэкв = 1 гэкв. Все ионы водорода регенерационного раствора при этом полностью задерживаются катионитом, вследствие чего сбрасываемый регенерационный раствор и отмывочные воды не содержат кислоты.
В отличие от обычных Н-катионитовых фильтров, в которых весь слой катионита при регенерации переводится в Н-форму при голодном режиме в Н-форму переводятся только верхние слои, а нижние слои катионита остаются в солевых формах и содержат катионы Ca2+, Mg2+, и Na+. В верхних слоях катионита отрегенерированного голодной нормой кислоты при работе фильтра имеют место все реакции ионного обмена приведенные выше для Н – катионирования.
В ниже лежащих неотрегенерированных слоях катионитные ионы водорода образовавшихся минеральных кислот обмениваются на ионы Ca2+, Mg2+, и Na+ по уравнениям:
CaR2 + 2HCl → 2HR + CaCl2
NaR + HCl → HR + NaCl
MgR2 + H2SO4 → 2HR + MgSO4
Происходит нейтрализация кислотности воды и при этом восстанавливается ее некарбонатная жесткость (постоянная жесткость), а зона слоя, содержащего ионы водорода смещается постепенно к низу.
Так как содержащаяся в воде угольная кислота является слабой, в реакциях ионного обмена она может участвовать только после удаления сильных кислот. В самых нижних слоях фильтра этот процесс завершится до полного восстановления карбонатной жесткости не успевает, поэтому фильтрат имеет малую карбонатную жесткость численно равную щелочности и содержит много углекислоты. К моменту окончания рабочего цикла фильтра ионы водорода, введенные в катионит при регенерации, полностью удаляются из катионита в виде H2CO3, который находится в равновесии с Д- гидратированной формой СО2:
H2CO3 ↔ H2O + CO2
Технология Н – катионирования с «голодной» регенерацией обеспечивает получение фильтрата с минимальной щелочностью (исключение сброса кислых стоков при регенерации и кислого фильтрата в рабочем цикле). Данная технология рекомендована для обработки природных вод определенного состава и при использовании катионита средне или слабокислотного типа при условии правильного осуществления режима регенерации. При непостоянстве качества исходной воды, неточном соблюдении рекомендаций по применению рассматриваемой технологи Н – катионирования во избежание колебаний щелочности и «проскоков» кислого фильтрата после Н-катионитных фильтров с голодной регенерацией в схеме водоподготовительной установки (ВПУ) устанавливаются буферные – нерегенерируемые фильтры с высотой слоя катионита 2 м и скоростью фильтрования до 40 м/ч. К буферным фильтрам не допускается подвод регенерационного раствора кислоты, взрыхляющая промывка осуществляется осветленной водой.

Рисунок 4.5 - Схема противоточного ионитового фильтра типа ФИПр:
1 – подвод исходной воды; 2 – отвод обработанной воды; 3 – 5 – подвод промывочной воды соответственно общий, в нижнее распределительное устройство (РУ) и блокирующее РУ; 6 – отвод промывочной воды; 7 – 9 – подводы регенерационного раствора соответственно общий, в нижнее РУ и в блокирующее РУ; 10, 11 – дренажи; 12 – гидрозагрузка; 13 – гидровыгрузка; 14, 15 – подвод воды для взрыхления в среднее и нижнее РУ.
Расход реагента существенно снижается, а качество фильтрата повышается при применении противоточной регенерации ионитного фильтра, схема которого приведена на рис. 4.5.
 Конструкция фильтра, изготавливаемого на ТКЗ, предусматривает, кроме верхнего и нижнего распределительных устройств, также среднее и блокирующее РУ, расположенные соответственно на глубине 0,3 м и у входной поверхности слоя ионита. Среднее распределительное устройство предназначено для равномерного сбора отработанного регенерационного раствора и отмывочной воды, подаваемых через нижнее (80 %) и блокирующее (20 %) РУ. Блокирующее РУ служит для подвода раствора реагента или отмывочной воды, используемых для регенерации и зажатия блокирующего слоя ионита. Взрыхлению подвергается только блокирующий слой ионита, а через 10—20 фильтроциклов взрыхляется весь слой.
Конструкция фильтра, изготавливаемого на ТКЗ, предусматривает, кроме верхнего и нижнего распределительных устройств, также среднее и блокирующее РУ, расположенные соответственно на глубине 0,3 м и у входной поверхности слоя ионита. Среднее распределительное устройство предназначено для равномерного сбора отработанного регенерационного раствора и отмывочной воды, подаваемых через нижнее (80 %) и блокирующее (20 %) РУ. Блокирующее РУ служит для подвода раствора реагента или отмывочной воды, используемых для регенерации и зажатия блокирующего слоя ионита. Взрыхлению подвергается только блокирующий слой ионита, а через 10—20 фильтроциклов взрыхляется весь слой.
Рисунок 4.6 - Схема двухпоточного-противоточного ионитового фильтра типа ФИПр-2П: 1 – подвод исходной воды; 2 – отвод обработанной воды или отработанного регенерационного раствора и отмывочной воды; 3 – подвод исходной воды или отвод отработанной воды; 4 – подвод регенерационного раствора; 5 – подвод воды для взрыхления; 6 – подвод регенерационного раствора и отмывочной воды; 7 – подвод отмывочной воды; 8 – отвод отработанного регенерационного раствора и отмывочной воды; 9 – дренаж; 10 – подвод взрыхляющей воды, дренаж.
Промежуточным вариантом между противоточной и прямоточной регенерациями является двухпоточно-противоточная регенерация, осуществляемая в фильтре, представленном на рис. 4.6. Среднее РУ фильтров, загруженных анионитом или катионитом, заглублено в них на 0,6 и 1,0 м соответственно. Конструкция двухпоточно-противоточного фильтра позволяет использовать его как в режиме однопоточного фильтрования и двухпоточной регенерации, так и в режиме двухпоточного фильтрования и однопоточной регенерации. При любом режиме работы в выходном слое ионита осуществляется принцип противоточного ионирования, при котором обрабатываемая вода перед выходом из фильтра соприкасается с хорошо отрегенерированными слоями ионита, благодаря чему обеспечивается высокое качество фильтрата при сокращенных расходах реагентов на регенерацию ионита. При работе фильтра в режиме двухпоточного фильтрования взрыхлению подвергается весь слой ионита, при однопоточном фильтровании — только верхний слой, а взрыхление всего слоя производится через 10—20 фильтроциклов. При режиме однопоточного фильтрования и двухпоточной регенерации 40 % раствора реагента пропускается через верхний слой ионита, 60 % — через нижний. При режиме двухпоточного фильтрования и однопоточной регенерации весь регенерационный раствор проходит через оба слоя ионита сверху вниз.
4.6 NH4 – катионирование
При NH4 – катионировании обрабатываемая вода фильтруется через слой катионита, отрегенерированного солями аммония (NH4Cl или (NH4)2SO4). Содержащийся в катионите ион аммония обменивается на катионы Са, Mg, и Na, присутствующие в природной воде, при этом протекают реакции:
2NH4R + Ca(HCO3)2 → CaR2 + 2NH4HCO3
2NH4R + Mg(HCO3)2 → MgR2 + 2NH4HCO3 (гидрокарбонат аммония)
2NH4R + CaCl2 → CaR2 + 2NH4Cl
2NH4R + MgSO4 → MgR2 + (NH4)2SO4
NH4R + NaCl → NaR + NH4
Как видно из реакций обмена в фильтрате образуются соли аммония, соответствующие имеющимся в воде анионам. NH4 – катионированная вода умягчается, а ее щелочность такая же как у исходной воды. При нагревании воды в котле соли аммония разлагаются:
NH4HCO3 →(t) NH3 + H2O + CO2
NH4Cl →(t) NH3 + HCl
(NH4)2SO4→(t) 2NH3 + H2SO4
Образующийся при разложении аммиак и углекислотная кислота уносятся паром, а в котловой воде остаются соляная и серная кислоты. Во избежание коррозии металла труб под действием кислот применение NH4 – катионирования в энергетической практике всегда сочетается с Na – катионированием. В процессе Na – катионирования идет превращение гидрокарбоната Na в бикарбонат, который в котле разлагается с образованием соды и едкого натрия:
2NaHCO3 → Na2CO3 + H2O + CO2
H2O + Na2CO3 →(t) 2NaOH + CO2
Углекислота уносится паром, а Na2CO3 и NaOH нейтрализуют кислотность воды, появляющуюся при термическом разложении солей аммония. Чтобы предотвратить чрезмерное снижение щелочности котловой воды в сочетании NH4 – катионирования с Na – катионированием осуществляют с расчетом получить в умягченной воде концентрацию ионов HCO3- на 0,3 – 0,7 мгэкв/л больше концентрации ионов аммония. Пар котлов питающихся NH4, Na – катионированной водой всегда содержит большое количество аммиака. Учитывая это обстоятельство NH4 – катионированной воды не следует применять, когда в тепловой схеме котельной установки имеются аппараты и детали из латуни или медных сплавов или когда пар используется для систем горячего водоснабжения или открытых систем теплоснабжения. На всех предприятиях, где в паре не должен содержаться аммиак от NH4 – катионирования отказываются.
4.7 Схема Na-Cl – катионирования
Этот метод основан на применении катионита в Na – форме и анионита в Cl – форме. Регенерация обоих ионов проводится раствором поваренной соли.
Cl – катионирование осуществляется после предварительного Na – катионирования. Обрабатываемая вода умягчается, в ней остаются только соли Na (NaНСО3, NaCl, Na2SO4, NaNO3 и т.д.). Затем при пропуске Na – катионированной воды через сильноосновный анионит в Cl – форме протекают реакции обмена анионов, содержащихся в Na – катионированной воде, на ионы Cl, находящихся в анионите:
RCl+NaHCO3 → RHCO3+NaCl
RCl+NaNO3 → RNO3+NaCl
2RCl+Na2SO4 → R2SO4+2NaCl
В результате сорбции иона HCO3- снижается щелочность обрабатываемой воды, она минимальна в начале рабочего цикла, а затем постоянно увеличивается. Конец рабочего цикла Cl – анионитового фильтра устанавливают по возрастанию щелочности фильтрата до заданной величины.
Практика показала, что применение слабоосновных анионитов в описанной технологии оказалось невозможным, так как после 2–3х регенераций раствором поваренной соли аниониты этого типа не восстанавливают обменоемкости. Применение сильноосновных анионитов сопряжено с необходимостью использования таких методов предварительной очистки, чтобы обрабатываемая вода не содержала железо и органических веществ.
В подземных водах часто содержится 2-х валентное железо и поэтому вода должна предварительно обезжелезиваться.
Поверхностные воды, для которых обязательна коагуляция, обычно, при необходимости снижения щелочности обрабатываются известью, после чего они не нуждаются в Na–Cl - катионировании.
Для регенерации анионита требуется поваренная соль высокого качества с минимальным содержанием примесей.
Условия применения данной технологии:
1. 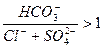
2. 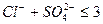 мгэкв/л
мгэкв/л
В котельных агрегатах требуется глубоко умягченная вода, для чего применяется 2х-ступенчатое Na – катионирование. В случае Na-Cl – катионирования после Na – катионитных фильтров 1-й ступени, ставятся фильтры 2-й ступени, где Na – катионирование совмещается с Cl – катионированием. При этом вниз фильтра загружается катионит, а сверху помещается анионит. В процессе регенерации фильтра второй ступени раствором поваренной соли ионы Nа+ регенерируют катионит, а ионы Cl- анионит.
Расход поваренной соли - 100÷120 мг/м3 аниона. Регенерационный раствор готовиться на умягченной воде. Расход воды на отмывку фильтров – 3÷4 м3/м3. Скорость фильтрования – 15÷20 м/ч. Количество фильтров - 2÷3.
Na-Cl – катионитный фильтр рассчитывается как Na – катионитный первой ступени, а необходимый объем анионита определяется по иону HCO3- 280÷300 гэкв/м3.
Слой анионита в фильтре минимально необходимый, число регенераций не более 2 раз в сутки. Слой катионита определяется как разность общей высоты слоя загрузки за вычетом высоты слоя анионита, но не менее 500 мм.
Дата добавления: 2014-12-13; просмотров: 3494;
