заочников и выполнения контрольных заданий по курсу
«Общая химическая технология»
Нижнекамск
| Составитель: | ст. преп. Н.И. Мифтахова |
Методические указания для самостоятельной работы заочников и выполнения контрольных заданий по курсу «Общая химическая технология» / Нижнекамский химико-технологический институт: Сост.: Н.И. Мифтахова. - Нижнекамск.- 2014.- 27с.
Методические рекомендации предназначены для студентов специальностей 240401 «Химическая технология органических веществ» и направления бакалавриата 240100 «Химическая технология» по профилям «Химическая технология органических веществ» и «Химическая технология природных энергоносителей и углеродных материалов».
Подготовлены на кафедре химической технологии органических веществ Нижнекамского химико-технологического института.
 |
СОДЕРЖАНИЕ
| Введение…………………………………………………………....... | |
| Требования к выполнению и оформлению контрольных заданий. | |
| Стехиометрия химических превращений…………………………. | |
| Смещение химического равновесия……………………………….. | |
| Реакторы идеального вытеснения………………………………….. | |
| Реакторы идеального полного смешения………………………….. | |
| Варианты контрольных заданий………………………………........ | |
| Вариант 1…………………………………………………………... | |
| Вариант 2…………………………………………………………... | |
| Вариант 3…………………………………………………………... | |
| Вариант 4…………………………………………………………... | |
| Вариант 5…………………………………………………………... | |
| Вариант 6…………………………………………………………... | |
| Вариант 7…………………………………………………………... | |
| Вариант 8…………………………………………………………... | |
| Вариант 9…………………………………………………………... | |
| Вариант 10…………………………………………………………. | |
| Вариант 11…………………………………………………………. | |
| Вариант 12…………………………………………………………. | |
| Вариант 13…………………………………………………………. | |
| Вариант 14…………………………………………………………. | |
| Вариант 15…………………………………………………………. | |
| Вариант 16…………………………………………………………. | |
| Вариант 17…………………………………………………………. | |
| Вариант 18…………………………………………………………. | |
| Вариант 19…………………………………………………………. | |
| Вариант 20…………………………………………………………. | |
| Вариант 21…………………………………………………………. | |
| Список рекомендуемой литературы……………………………….. |
Введение
Курс «Общая химическая технология» рассматривает основные закономерности химических процессов, совокупность физических и химических явлений, из которых они складываются, и основные пути их реализации.
Овладение курсом позволит обеспечить в производственных условиях оптимальные технологические режимы, повышающие производительность труда, улучшить качество продукции, применять при проектировании рациональные типы оборудования, правильно оценивать результаты лабораторных исследований и быстро реализовывать их в производственных условиях.
Требования к выполнению и оформлению
контрольных заданий
Контрольная работа оформляется в тетради. Контрольная работа состоит из пяти заданий. Первое, четвертое и пятое задания являются практическими и отвечают следующим темам: «Равновесие химических реакций», «Стехиометрия химических превращений» и «Химические реакторы». Второе и третье задания требуют ответа на теоретические вопросы, в которых необходимо дать полный, развернутый ответ на поставленный вопрос. В конце работы необходимо указать список использованной литературы.
Вариант контрольной работы выбирается студентами по последним цифрам номера зачетной книжки с 1 по 21 вариант. Если последние цифры номера зачетной книжки больше 21, то вариант выбирается по сумме двух последних цифр. Например, последние цифры номера зачетной книжки 23, это соответствует 5 варианту контрольного задания.
Стехиометрия химических превращений.
Стехиометрические уравнения показывают, в каких соотношениях вещества вступают в химическое взаимодействие.
Общий вид стехиометрического уравнения:
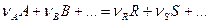
Уравнение устанавливает соотношение между количеством превратившихся веществ:
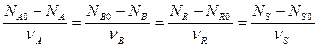
Степень превращения вещества – отношение количества превращенного вещества к его первоначальному количеству (1):
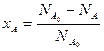
Степень превращения может быть определена для любого исходного реагента, например, 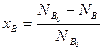
Из соотношения (1) и определений ХА и ХВ, получим связь между степенями превращения двух исходных веществ:
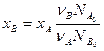
Можно определить количество любого вещества Ni в реагирующей смеси:
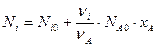
Если реакция протекает без изменения объема реакционной смеси или не происходит изменения общего количества реагирующих веществ, то степень превращения можно выразить через концентрации:
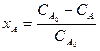
Для сложной реакции кроме степени превращения вводят дополнительные характеристики процесса: селективность процесса и выход продукта.
Селективность – это отношение количества исходного реагента, расходуемого на целевую реакцию, к общему количеству исходного реагента, пошедшего на все реакции.
Для двух параллельных реакций:
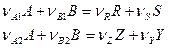
селективность по продукту R
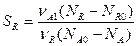
Для двух последовательных реакций:
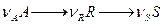
селективность по продукту R
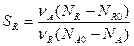
Выход продукта для продукта R
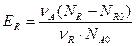
Уравнение, связывающее степень превращения исходного вещества, выход продукта и его интегральную селективность, имеет вид
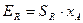
Смещение химического равновесия.
Сместить химическое равновесие – это значит изменением внешних условий добиться преимущественного протекания прямой или обратной реакций. Общие закономерности этого явления были сформулированы Ле-Шателье в 1887 г.:
Если на систему, находящуюся в равновесии, оказывается воздействие извне, то равновесие смещается в сторону той реакции, протекание которой максимально ослабляет внешнее воздействие.
Чаще всего приходится сталкиваться со смещением равновесия в результате следующих изменений условий:
1)температура
Изменение температуры, в отличие от других внешних воздействий, влияет на значение константы равновесия. Повышение температуры вызывает ускорение той реакции, протекание которой сопровождается поглощением тепла (эндотермическая реакция). Напротив, понижение температуры благоприятствует протеканию экзотермической реакции – реакции, сопровождающейся выделением тепла.
2)давление
Повышение давления ускоряет ту реакцию, в которой происходит уменьшение количеств газообразных веществ, а понижение давления – реакцию, сопровождающуюся увеличением количеств газообразных веществ. Если количество газов в ходе реакции не изменяется, то изменение давления не оказывает влияния на положение химического равновесия.
3)концентрации
Добавление в реакционную систему какого-либо компонента смещает равновесие в сторону той реакции, где тот компонент расходуется. Отвод какого-либо вещества из реакционной системы, напротив, ускоряет реакцию, в которой это вещество образуется.
Реакторы идеального вытеснения.
РИВ-н – реакторы непрерывного действия, в которых осуществляется ламинарный гидродинамический режим.
В РИВ температура по длине реактора изменяется, что соответственно ведет к изменению константы скорости реакции. При расчете РИВ температуру, константу скорости считают постоянными.
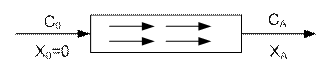
Внешний поток реагентов движется в одном заданном направлении, не перемешиваясь и вытесняя подобно поршню находящийся впереди частицы потока.
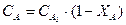
Время пребывания всех частиц в таком реакторе постоянно.
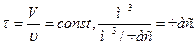
Все характеристики (концентрация, температура, степень превращения) изменяются плавно по объему реактора. Параметры процесса непостоянны во времени и по высоте трубы.
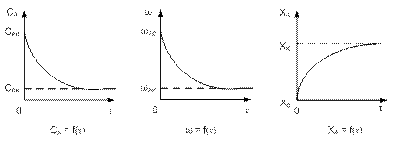
1)изменение концентрации реагентов;
2)изменение скорости реакции;
3)изменение степени превращения.
Данные уравнения позволяют определить время пребывания реагента для достижения заданной степени превращения, а затем и размеров реактора.
Для реакции нулевого порядка:
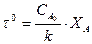
Для реакции первого порядка:
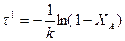
Для реакции второго порядка:
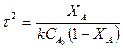
Реакторы идеального полного смешения (РИС-н).
РИС – реактор непрерывного действия, в котором осуществляется режим гидродинамического действия. В нем потоки реагентов смешиваются друг с другом и с продуктами химического превращения.
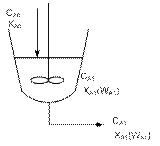
Во время его работы соблюдается стационарный режим, т.е. постоянство характеристик во времени. Нестационарный режим наблюдается во время пуска и остановки. В РИС-н перемешивающие устройства работают так интенсивно, что попадающие в реактор потоки реагента равномерно и мгновенно перемешиваются по объему всего реактора. В результате чего выравниваются параметры, которые характеризуют процесс.
Характеристические графики РИС-н во времени и объеме реактора.

СА0, СА – начальная и конечная концентрации реагентов в реакторе.
WA0, WA – начальная и конечная скорости процесса в реакторе.
Если известна кинетика процесса, то возможно рассчитать время, которое необходимо для достижения требуемой степени превращения.
Для необратимой реакции нулевого порядка 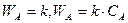
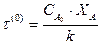
Для реакции первого порядка:

Зависит только от степени превращения и не зависит от концентрации СА0.
Для реакции второго порядка:
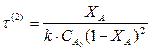
Варианты контрольных заданий
Вариант 1
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2СО(г) + О2(г) ↔ 2СO2(г)
С6Н6(г) ↔ С6Н12(г) + Н2(г)
2. Описать общую технологическую структуру химического производства, качественные и количественные критерии оценки эффективности химического производства.
3. Перечислить и сравнить способы получения термической фосфорной кислоты. Изобразить технологическую схему производства термической фосфорной кислоты двухступенчатым методом.
4. Протекают параллельные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=5 кмоль, NR=15 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 20%; 2) 95%. CA0=2,5 кмоль/м3, к=1,2.
Вариант 2
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
CuS(т) + O2(г) ↔ Cu(т) + SO2(г)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Описать общую технологическую схему химического производства, общие функции, основные технологические компоненты химического производства.
3. Описать свойства диоксида и триоксида серы, серной кислоты и олеума. Сорта серной кислоты, ее хранение и перевозка. Охарактеризовать виды серосодержащего сырья для производства серной кислоты.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=12 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 90%. CA0=3 кмоль/м3, к=1,8.
Вариант 3
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С4Н8(г) + Н2О(ж) ↔ (СН3)3СНО(ж)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Охарактеризовать сырьевые источники химического производства. Привести примеры использования отходов производства как источников вторичных материальных ресурсов. Перспективные и альтернативные источники сырь.
3. Описать химическую и структурную схемы производства серной кислоты контактным способом из колчедана.
4. Протекают параллельные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=7 кмоль, NS=1 кмоль.
5. 5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 80%. CA0=5 кмоль/м3, к=1.
Вариант 4
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С6Н6(г) + С2Н4(г) ↔ С6Н5С2Н5(ж)
С2Н4(г) ↔ С2Н2(г) + Н2(г)
2. Охарактеризовать сырьевые источники химического производства. Описать методы подготовки сырья в химико-технологическом процессе. Метод флотации.
3. Описать физико-химические основы обжига флотационного колчедана. Хранение и подготовка колчедана к обжигу. Описать устройство печей для обжига колчедана.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=9 кмоль, NS=1 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 23%; 2) 90%. CA0=6 кмоль/м3, к=2.
Вариант 5
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
СН2О(г) + Н2(г) ↔ СН3ОН(г)
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2. Описать классификацию химико-технологических процессов по условиям работы, по типу реакций, по состоянию реагирующих веществ.
3. Охарактеризовать печи для обжига колчедана, устройства для подачи колчедана в печи и удаление огарка. Использование огарка.
4. Протекают параллельные реакции:
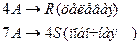
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=12 кмоль, NS=1 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 40%; 2) 95%. CA0=1,2 кмоль/м3, к=1,4.
Вариант 6
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
N2(г) + 3H2(г) ↔ 2NН3(г)
С6Н5–СН3(ж) + Н2(г) ↔ С6Н6(г) + СН4(г)
2. Описать технологическую схему промышленной водоподготовки. Вода как сырье и вспомогательный компонент производства. Источники воды.
3. Описать основы механической и электрической очистки обжигового газа в производстве серной кислоты от пыли, брызг и тумана.
4. Протекают последовательные реакции:
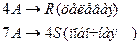
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=6 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 90%. CA0=4 кмоль/м3, к=1,6.
Вариант 7
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
4С2Н4(г) ↔ С5Н10(г) + С3Н6 (г)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Привести общую характеристику и классификацию энергетических ресурсов. Описать способы энерготехнологического комбинирования и использования энергетического потенциала сырья и тепла экзотермических реакций. Вторичные энергоресурсы.
3. Описать физико-химические основы каталитического окисления SO2 до SO3. Катализаторы процесса. Контактные аппараты.
4. Протекают параллельные реакции:
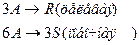
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=5 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 30%; 2) 75%. CA0=5 кмоль/м3, к=1,5.
Вариант 8
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С4Н10(г) ↔ С4Н6(г) + 2Н2(г)
С6Н6(г) ↔ С6Н12(г) + Н2(г)
2. Описать химическое производство как химико-технологическую систему, виды технологических связей элементов ХТС, их назначение и характеристика.
3. Описать физико-химические основы абсорбции серного ангидрида из газовой смеси в производстве серной кислоты. Аппаратурное оформление процесса.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=10 кмоль, NS=3 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 65%. CA0=4,5 кмоль/м3, к=2.
Вариант 9
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2С4Н8(г) ↔ С8Н16(ж)
С2Н4(г) ↔ С2Н2(г) + Н2(г)
2. Привести классификацию химико-технологических процессов, основные показатели ХТП, их взаимосвязь. Способы повышения эффективности ХТП.
3. Описать химическую и структурную схемы производства серной кислоты нитрозным способом.
4. Протекают параллельные реакции:
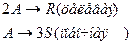
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=5 кмоль, NR=10 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 20%; 2) 90%. CA0=3,5 кмоль/м3, к=1.
Вариант 10
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
СН2О(г) + Н2(г) ↔ СН3ОН(г)
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2. Описать гомогенные химические процессы, влияние условий проведения и химических признаков на скорость превращения и дифференциальную селективность. Пути и способы интенсификации гомогенных процессов.
3. Описать современное состояние и перспективы развития азотной промышленности. Сырье для азотной промышленности. Методы фиксации азота.
4. Протекают последовательные реакции:
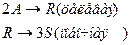
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=7 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 25%; 2) 85%. CA0=4 кмоль/м3, к=2,2.
Вариант 11
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2СО(г) + О2(г) ↔ 2СO2(г)
С2Н4(г) ↔ С2Н2(г) + Н2(г)
2. Представить и описать технологическую схему совмещенной каталитической конверсии метана и оксида углерода под атмосферным давлением.
3. Описать методы очистки технологических газов от СО2.
4. Протекают параллельные реакции:
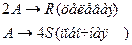
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=7 кмоль, NS=1 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 35%; 2) 75%. CA0=2,5 кмоль/м3, к=1,3.
Вариант 12
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
CuS(т) + O2(г) ↔ Cu(т) + SO2(г)
С2Н6(г) ↔ С2Н4(г) + Н2(г)
2. Изложить теоретические основы синтеза аммиака, обосновать оптимальные условия процесса и необходимость проведения синтеза аммиака по циклической схеме.
3. Описать методы очистки технологических газов от сернистых соединений.
4. Протекают последовательные реакции:
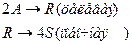
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=7 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 65%. CA0=1,5 кмоль/м3, к=1,4.
Вариант 13
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
N2(г) + 3H2(г) ↔ 2NН3(г)
С6Н6(г) ↔ С6Н12(г) + Н2(г)
2. Описать физико-химические основы и аппаратурное оформление процесса очистки обжигового газа от контактных ядов.
3. Представить и описать технологическую схему синтеза аммиака при среднем давлении.
4. Протекают параллельные реакции:
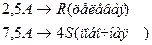
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=6 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 70%. CA0=1,6 кмоль/м3, к=1,8.
Вариант 14
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
4С2Н4(г) ↔ С5Н10(г) + С3Н6 (г)
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2. Описать технологическую схему и оборудование очистного отделения современного производства контактной серной кислоты из колчедана.
3. Изложить влияние различных факторов на процесс окисления аммиака в производстве азотной кислоты.
4. Протекают последовательные реакции:
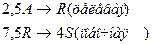
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=7 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 40%; 2) 95%. CA0=2,4 кмоль/м3, к=2.
Вариант 15
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2СО(г) + О2(г) ↔ 2СO2(г)
С6Н5–СН3(ж) + Н2(г) ↔ С6Н6(г) + СН4(г)
2. Охарактеризовать катализаторы, применяемые в производстве серной кислоты контактным методом.
3. Изложить физико-химические основы процесса абсорбции диоксида азота водой в производстве разбавленной азотной кислоты.
4. Протекают параллельные реакции:
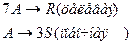
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=2 кмоль, NR=6 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 30%; 2) 75%. CA0=2,5 кмоль/м3, к=2,2.
Вариант 16
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С6Н6(г) ↔ С6Н12(г) + Н2(г)
4С2Н4(г) ↔ С5Н10(г) + С3Н6 (г)
2. Описать физико-химические основы нитрозного процесса получения серной кислоты.
3. Изложить теоретические основы разделения жидкого воздуха на азот и кислород методом ректификации.
4. Протекают последовательные реакции:
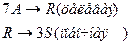
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=8 кмоль, NS=5 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 90%. CA0=3 кмоль/м3, к=1,8.
Вариант 17
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С2Н6(г) ↔ С2Н4(г) + Н2(г)
N2(г) + 3H2(г) ↔ 2NН3(г)
2. Описать оборудование башенных систем производства серной кислоты нитрозным методом.
3. Провести характеристику сырья для азотной промышленности.
4. Протекают параллельные реакции:
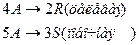
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=9 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 10%; 2) 65%. CA0=1,6 кмоль/м3, к=1,6.
Вариант 18
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С2Н6(г) ↔ С2Н4(г) + Н2(г)
CuS(т) + O2(г) ↔ Cu(т) + SO2(г)
2. Описать значение и область применения промышленного катализа. Сущность и виды катализа.
3. Описать технологию получения азотоводородной смеси методом паровоздушной конверсии метана.
4. Протекают последовательные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=1 кмоль, NR=5 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 20%; 2) 90%. CA0=1,2 кмоль/м3, к=1,2.
Вариант 19
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С2Н4(г) ↔ С2Н2(г) + Н2(г)
СН2О(г) + Н2(г) ↔ СН3ОН(г)
2. Описать методы производства водорода конверсией углеводородных газов. Привести сравнительный анализ этих методов.
3. Описать методы очистки азотоводородной смеси от диоксида углерода и сероводорода.
4. Протекают параллельные реакции:
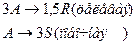
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=5 кмоль, NR=12 кмоль, NS=3 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 35%; 2) 75%. CA0=2 кмоль/м3, к=1,4.
Вариант 20
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
С6Н14(г) ↔ С6Н6 (г) + 4Н2(г)
2СО(г) + О2(г) ↔ 2СO2(г)
2. Описать производство водорода (азотоводородной смеси) разделением коксового газа.
3. Описать процесс переработки нитрозных газов в разбавленную азотную кислоту.
4. Протекают последовательные реакции:
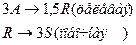
Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=12 кмоль, NS=4 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 15%; 2) 65%. CA0=4,5 кмоль/м3, к=1,5.
Вариант 21
1. Используя принцип Ле-Шателье, проанализируйте все возможные способы смещения равновесия реакции вправо для получения максимального количества целевого продукта (ΔН реакции рассчитывается по табличным данным):
2С4Н8(г) ↔ С8Н16(ж)
2СО(г) + О2(г) ↔ 2СO2(г)
2. Изложить особенности сернокислотного разложения фосфоритов Каратау. Изобразить технологическую схему производства из них экстракционной фосфорной кислоты.
3. Охарактеризовать виды серосодержащего сырья для производства серной кислоты. Получение серы из руд, очистка серы. Привести схему установки для комплексной переработки серных руд.
4. Протекают параллельные реакции:

Определить: степень превращения XA, селективность SR, выход продукта ER, если на выходе из реактора NA=3 кмоль, NR=7 кмоль, NS=2 кмоль.
5. Рассчитать время пребывания реагентов в реакторе для достижения заданной степени превращения:
а) РИС-Н; б) РИВ-Н, если протекает реакция:
1) нулевого порядка; 2) первого порядка; 3) второго порядка
и степень превращения достигла: 1) 25%; 2) 85%. CA0=3 кмоль/м3, к=2,2.
Список рекомендуемой литературы.
1.Бесков В.С., Сафронов В.С. Общая химическая технология и основы промышленной экологии: Учебник для вузов. – М.:Химия, 1999. 472 с.: ил.
2.Общая химическая технология: Учебник для химико-техн. вузов/Под ред. И.П. Мухленова. – 4-е изд., перераб. и доп. – М: Высш. шк., 1984. – 256 с.: ил.
3.Краткий справочник физико-химических величин. Издание девятое/Под ред. А.А. Равделя и А.М.Пономаревой. – СПб.:Специальная Литература, 1998. – 232 с.: ил.
Дата добавления: 2014-12-08; просмотров: 1318;
