Заражение через пищеварительный тракт
Заразить животное через рот можно двумя способами. Материал, предназначенный для заражения, примешивают к корму или питью животного. Такой способ является наиболее простым и естественным, однако, в лабораторной практике применение его ограничено, поскольку количество материала, попадающее в организм заражаемого животного, не подлежит точному учету. Поэтому значительно чаще материал, предназначенный для заражения, вводят животному шприцем, игла которого имеет незначительный изгиб и утолщение на конце в виде оливы. Наличие изгиба допускает введение иглы в пищевод животного. Диаметр иглы для мышей должен быть не более 1 мм, для крыс—1,5 мм, длина, соответственно, 35-45 и 70-75 мм.
Крыс и мышей фиксируют перед заражением в вертикальном положении: одной рукой помощник держит животное за складку кожи на затылке, около ушей, другой—за корень хвоста. Животным открывают рот браншами пинцета, вставляя их между нижней и верхней челюстями. Иглу, введенную в рот, продвигают по задней стенке глотки на глубину 1 см у мышей и 2—2,5 см у крыс. На указанной глубине игле придают вертикальное положение. Процесс введения иглы, как правило, затруднений не представляет, конец ее проникает непосредственно в желудок или нижний отдел пищевода. Количество материала, вводимого за один раз в желудок мышей, должно быть не более 1 мл, взрослым крысам — не более 3,5 мл (рис. 12).
При пероральном введении жидкостей мелким лабораторным удобнее пользоваться полихлорвиниловой трубкой, представляющей собой наружную оболочку одного провода многожильного телефонного кабеля, из которого удален проводник. Длина трубки 15—17 см, наружный диаметр 1—1,5 мм, такой эластический зонд при незначительном усилии легко проникает из полости рта в пищевод и желудок животного, не требуя строгого ограничения глубины введения, так как даже при излишне глубоком введении стенки желудка не повреждаются.
Вводимая жидкость дозируется с помощью шприца, на сосок которого надевают эластический зонд, внутренний просвет которого 0,5—0,7 мм.
Морских свинок и кроликов перед заражением per os фиксируют в нормальном для животного положении. Удобнее всего завернуть их в полотенце и посадить к помощнику на колени.
Заразный материал вводят через эластический зонд. Для этой цели обычно выбирают катетер из наиболее мягкой и эластичной резины длиной 7,5—8 см и толщиной не более 0,3—0,5 см.
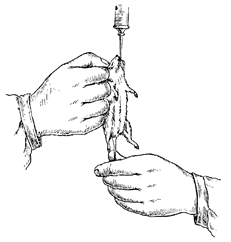
Рис. 12. Заражение через пищеварительный тракт
Перед введением зонда в рот животному вставляют роторасширитель или, как его называют, «зевник», который представляет собой дощечку с круглым отверстием в середине. Ширина дощечки для кролика равна 2 см, для морской свинки —1 см. Через отверстие вставленного в рот «зевника» осторожно вводят в пищевод зонд, смазанный вазелином или глицерином. Для того чтобы облегчить введение зонда, животному вливают пипеткой в рот несколько капель воды, вызывая глотательные движения, во время которых зонд легко, без внешнего воздействия продвигается в глубь пищевода. Наружный конец введенного зонда присоединяют к шприцу, наполненному материалом, который вводят в желудок медленно в количестве 2,5—3,5 мл морским свинкам и 3,5—5 мл кроликам.
Заражение через дыхательные пути (интраназальное заражение)
Животному, фиксированному на доске, прикладывают к носу кусочек ваты, смоченной эфиром или хлороформом. К заражению приступают после того, как у животного появится состояние легкого наркоза. Зараженный материал с помощью шприца вводят в нос небольшими каплями на глубину 1—1,5 мм мышам, 2—3 мм крысам, 4 мм кроликам и морским свинкам. Чтобы не поранить слизистые оболочки, для введения материала берут абсолютно тупую иглу.
Заражение в переднюю камеру глаза (интраокулярный метод)
Производится обычно у кроликов под местной анестезией глаза. Затем фиксируют глазное яблоко путем захватывания складки конъюнктивы (кнаружи от верхнего края роговицы) глазным пинцетом. После этого тонкой иглой, смоченной исследуемым материалом, протыкают роговицу у лимба в очень косом направлении и проникают в переднюю камеру глаза на глубину не менее 1 мм. Иглу тотчас же вынимают, а ранка закрывается сама по себе. При правильном введении иглы вытекания влаги из передней камеры быть не должно. Можно также после прокола роговицы продвинуть иглу в центральном направлении до тех пор, пока из просвета иглы не покажется жидкость. Выпустив несколько капель влаги передней камеры глаза, иглу соединяют со шприцем и вводят исследуемый материал (не более 0,05 мл).
Внутримозговой метод (интрацеребральный)
Применяется чаще у кроликов, крыс и мышей. Техника введения материала кроликам та же, что и при тральном методе, только инъекция производится прямой иглой через твердую мозговую оболочку непосредственно в толщу мозгового вещества.
Доза вводимого материала—0,2-0,3 мл. При отсутствии инструментов для трепанации можно произвести заражение в мозг путем прокола черепа через кожу, иглой шприца, несколько сбоку от средней линии в области затылочного бугра. Применяют также после разреза кожи прокол черепа острой канцелярской кнопкой с последующим введением в отверстие иглы шприца.
Кроликов можно также заражать в мозг через sulcus supraorbitalis (без трепанации).
Техника следующая: оператор пригибает к столу левой рукой голову фиксированного помощником животного, а правой производит укол короткой (4—5 мл длины) иглой в заранее прощупанную борозду. Направление при проколе должно быть несколько наклонное к средней линии, а невертикальное (опасность попадания в глазницу). Место укола предварительно выстригают и обрабатывают йодной настойкой. При проколе кожа смещается от середины к sulcus supraorbitalis; после прокола черепное отверстие закрывают кожей. Способ очень удобный и быстрый, животные переносят операцию без наркоза.
У белых мышей и крыс техника внутримозгового введения следующие: животное фиксируют в левой руке, кожу головы оттягивают большим и указательным пальцами к затылку, а мизинцем и безымянным удерживают хвост. Прокол производят через кожу в область темени, латеральне средней линии; место укола предварительно обрабатывают настойкой йода. Материал вводят медленно, во избежание резкого повышения внутричерепного давления.
Дата добавления: 2014-12-06; просмотров: 1646;
