Элементы статистической физики
104. На какой высоте h давление воздуха составляет 80% давления на уровне моря? Температуру считать постоянной по высоте и равной t=7о С.
105. Давление воздуха у поверхности Земли р=100 кПа. Считая температуру воздуха постоянной и равной Т=270 К. Определить концентрацию молекул n воздуха: а) у поверхности Земли; б) на высоте h=8 км.
106. На какой высоте h концентрация молекул водорода составляет 50% концентрации на уровне моря? Температуру считать постояннной и равной 273 К. Ускорение свободного падения постоянно и равно 9,8 м/с2.
107. В кабине вертолета барометр показывает давление р1=86 кПа. На какой высоте h летит вертолет, если у поверхности Земли давление равно р2=0,10 МПа. Считать, что температура воздуха постоянна и равна 280 К.
108. На какой высоте h содержание водорода в воздухе по сравнению с содержанием углекислого газа увеличится вдвое? Среднюю по высоте температуру воздуха считать Т=300 К.
109. Определить число молекул в единице объема n воздуха на высоте h=2 км над уровнем моря. Температуру считать постоянной и равной 10о С. Давление на уровне моря ро=101 кПа.
110. Для вычисления числа Авогадро NА Перрен определял с помощью микроскопа распределние по высоте шарообразных частиц в слоях, отстоящих друг от друга на расстояние l=38 мкм, равно a=2,08. Плотность гуммигута r=1,2×103 кг/м3, радиусы его частиц R=0,212 мкм. Температура воды t=18о С. Используя эти данные найти число Авогадро.
111. Найти, на какой высоте hc находится центр тяжести вертикального цилиндрического столба воздуха. Температуру Т, молярную массу М и ускорение свободного падения g считать известными и не зависящими от h.
112. Пользуясь распределением Максвелла и понятием относительной скорости u как отношения скорости молекул v к наивероятнейшей скорости vв, получить то же распределение в приведенном виде:
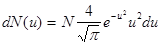 .
.
113. Какая часть молекул азота при температуре 7о С обладает скоростями в интервале от 500 до 510 м/с?
114. Какая часть молекул кислрода обладает скоростями, отличающимися от наивероятнейшей не больше чем на 10 м/с, при температурах 0 и 300о С?
115. Определить отношение числа молекул водорода, обладающих скоростями в интервале от 2,0 до 2,01 км/с, к числу молекул, обладающихскоростями от 1,0 до 1,01 км/с, если температура водорода 0о С.
116. Определить высоту горы, если давление на ее вершине равно половине давления на уровне моря. Температуру считать всюду одинаковой и равной 0о С.
117. На поверхности Земли барометр показывает 101 кПа. Каково будет показание барометра при подъеме его на Останкинскую телевизионную башню, высота которой 540 м? Температуру считать одинаковой и равной 7о С.
118.Подъеме вертолета на некоторую высоту барометр, находящийся в его кабине, изменил свое показание на 11 кПа. На какой высоте летит вертолет, если на взлетной площадке барометр показывал 0,1 МПа? Температуру воздуха считать всюду одинаковой и равной 17о С.
119. Каковы давление и число молекул в единице объема воздуха на высоте 2,0 км над уровнем моря? Давление на уровне моря 101 кПа, а температура 10о С. Изменением температуры с высотой пренебречь.
120. Пылинки массой 1 аГ взвешены в воздухе. Определить толщину слоя воздуха, в пределах которого концентрация пылинок различается не более чем на 1,0%. Температуру воздуха во всем объеме считать одинаковой и равной 27о С.
121. У поврехности Земли молекул водорода почти в 1,0×106 раз меньше, чем молекул азота. На какой высоте число молекул водорода будет равно числу молекул азота? Среднюю температуру водорода принять равной 0о С.
122. Написать выражение для среднего числа dN молекул газа, кинетические энергии которых заключены между e и e+de.
123. Найти наивероятнейшее значение кинетической энергии e поступательного движения молекул газа, т.е. такое значение em, при котором в фиксированный интервал энергии de в газе находится максимальное число молекул.
124. При каком значении температуры число молекул находящихся в пространстве скоростей в фиксированном интервале (v, v+dv), максимально?
125. Найти отношение числа молекул водорода n1 скорости которых лежат в пределах от 3000 до 3010 м/с, к числу молекул n2, имеющих скорости в пределах от 1500 до 1510 м/с, если температура водорода 300о С.
126. Исходя из распределения Максвелла, найти средний квадрат х-компоненты скорости молекул газа. Найти отсюда среднюю кинетическую энергию, приходящуюся на одну степень свободы поступательного движения молекулы газа.
127. Вычислить скорость v1/2 теплового движения молекулы газа, определяемую условием, что половина молекул движется со скоростью, меньшей, чем v1/2, а другая половина - со скоростью, большей, чем v1/2.
128. Считая атмосферу изотермической, а ускорение свободного падения не зависящим от высоты, вычислить давление а) на высоте 5 км, б) на высоте 10 км, в) в шахте на глубине 2 км. Расчет произвести для Т=293 К. Давление на уровне моря принять равным ро.
129. Вблизи поверхности Земли отношение объемных концентраций кислорода (О2) и азота (N2) в воздухе hо=20,95/78,08=0,268. Полагая температуру атмосферы не зависящей от высоты и равной 00С, определить это отношение h на высоте h=10 м.
131. Закрытая с одного конца труба длины l=1,00 м вращается вокруг перпендикулярной к ней вертикальной оси, проходящей через открытый конец трубы, с угловой скоростью w=62,8 рад/с. Давление окружающего воздуха rо=1,00×105 Па, температура t=20о С. Найти давление воздуха в трубе вблизи закрытого конца.
132. Имеется N частиц, энергия которых может принимать лишь два значения Е1 и Е2. Частицы находятся в равновесном состоянии при температуре Т. Чему равна суммарная энергия Е всех частиц в этом состоянии?
133. При какой температуре Т воздуха средние скорости молекул азота (N2) и кислорода (О2) отличаются на 300 м/с?
134. Преобразовать функцию распрпделения Максвелла, перейдя от переменной v к переменной u=v/vвер, где vвер - наиболее вероятная скорость молекул.
135. В запаянном стеклянном баллоне заключен моль одноатомного идеального газа при температуре Т=293 К. Какое количество теплоты Q нужно сообщить газу, чтобы средняя скорость его молекул увеличилась на 1%?
136. Вычислить наиболее вероятную, среднюю и среднеквадратичную скорости молекул кислорода (О2) при 20о С.
137. Моль азота (N2) находится в равновесном состоянии при Т=300 К. Чему равна а) сумма х-вых компонент скоростей всех молекул S, б) сумма скоростей всех молекул S v, в) сумма квадратов скоростей всех молекул S v2, г) сумма модулей скоростей всех молекул S v?
138. Найти среднее значение модуля х-вой компоненты скорости молекул газа, находящегося в равновесном состоянии при температуре Т. Масса молекулы равны.
139.Найти сумму модулей импульсов молекул, держащихся в моле азота (N2), при температуре 200 К.
140. Определить, исходя из классических представлений, среднеквадратичную угловую скорость 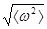 вращения молекул азота (N2) при Т=300 К. Расстояние между ядрами молекулы l=3,7×10-10 м.
вращения молекул азота (N2) при Т=300 К. Расстояние между ядрами молекулы l=3,7×10-10 м.
141. Некоторый газ находится в равновесном состоянии. Какой процент молекул газа обладает скоростями отличными от наиболее вероятной не более чем на 1%.
142. Написать выражение, определяющее относительную долю h молекул газа, обладающих скоростями превышающими наиболее вероятную скорость.
143.Средняя энергия молекул гелия (Не)
e=3,92×10-21Дж. Определить среднюю скорость молекул гелия при тех же условиях.
144. Азот (N2) находится в равновесном состоянии при Т=421 К.
1. Найти наиболее вероятную скорость молекулы.
2. Определить относительное число DN/N молекул скорости которых заключены в пределах: а) от 499,9 до
145. Вычислить среднюю квадратичную скорость теплового движения молекул 1) водорода, 2) азота, 3) кислорода при 0о С.
146. Масса крупной молекулы органического вещества m=-10-18 г. Найти полную среднюю кинетическую энергию движения такой молекулы, взвешенной в воздухе при температуре 27о С. Найти также среднюю квадратичную скорость молекулы при этой температуре.
147. Найти средний квадратичный импульс молекулы Н2 при температуре 27о С.
148. Найти зависимость между средней квадратичной скоростью теплового движения молекулы газа 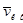 и скоростью звука в нем сзв.
и скоростью звука в нем сзв.
149. Найти наиболее вероятную vm, среднюю v и среднюю квадратичную 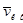 cкорости молекул хлора при температуре 227о С.
cкорости молекул хлора при температуре 227о С.
150. При какой температуре средняя квадратичная скорость молекул кислорода равна таковой же скорости молекул азота при температуре 100о С?
151. Показать, что если за единицу скорости молекул газа принять наиболее вероятную скорость, то число молекул, абсолютные значения скоростей которых лежат между v и v+dv, не будет зависеть от температуры газа.
152. Как зависит от давления средняя скорость молекул идеального одноатомного газа при адиабатическом сжатии или расширении?
153. Плотность некоторого угла r=3×10-2 кг/м3. Найти давление r газа, которое он оказывает на стенки сосуда, если средняя квадратичная скорость молекул газа равна 500 м/с.
154. Вычислить среднюю квадратичную энергию поступательного движения <W>пост и полную среднюю кинетическую энергию <W> молекулы азота при температуре Т=300 К. Молекулу азота считать жесткой.
155. Вычислить среднюю энергию поступательного <W>пост , вращательного <Wвр> и колебательного <Wкол> движений двухатомной молекулы газа при температуре Т=3×103 К.
156. Определить отношение h средней квадратичной скорости молекулы газа к скорости распространения звука в нем при одной и той же температуре. Газ взять двухатомный, молекулы газа считать жесткими.
157. Найти относительное число молекул Dn/n, скорости которых отличаются от наиболее вероятной не более чем на 10 м/с, при температурах газа: а) Т1=300 К, б) Т2=600 К.
158. Найти относительное число молекул Dn/n гелия, скорости которых лежат в интервале от v1=990 м/с до v2=1010 м/с при температурах: а) Т1=300 К, б) Т2=600 К.
160. Найти отношение h числа гелия, движущихся со скоростями в интервале от v1=2000 м/с до v2=2010 м/с, к числу молекул, скорости которых лежат в интервале от v3=1000 м/с до v4=1010 м/с. Температура гелия Т=600 К.
161. Какая часть Dn/n молекул азота при температуре t=230о C обладает скоростями в интервале от v1=290 м/с до v2=310 м/с, б) от v3=690 м/с до v4=710 м/с.
162. При какой температуре Т наиболее вероятная скорость молекул азота меньше средней квадратичной скорости на 50 м/с?
163. Найти относительное число молекул Dn/n газа, скорости которых отличаются не более чем на одну сотую наиболее вероятной скорости, б) средней арифметической скорости, в) средней квадратичной скорости.
164. Найти среднюю длину свободного пробега lср молекул воздуха при температуре Т =300 К и давлении р=0,15 МПа. Эффективный диаметр молекул воздуха dэф=0,30 нм.
165. Найти среднюю продолжительность t свободного пробега молекул кислорода при температуре Т=300 К и давлении р= 150 МПа. Эффективный диаметр молекулы кислорода dэф=0,27 нм.
166. Определить концентрацию n молекул водорода, при которой среднее расстояние между молекулами в сто раз меньше длины свободного пробега молекул. Эффективный диаметр молекулы водорода dэф=0,23 нм.
167. Средняя длина свободного пробега электрона в газе приблизительно в 5,7 раз больше, чем средняя длина свободного пробега молекул газа. Найти среднюю длину пробега <lэл> электронов в разрядной трубке, содержащей водород при температуре t=1270С и давлении р=1,2 Па. Эффективный диаметр молекулы водорода dэф=0,23 нм.
168. Расстояние между стенками дьюароновского сосуда l=10мм. Оценить, при каком давлении р теплопроводность воздуха, находящегося между стенками сосуда, начнет уменьшаться при его откачке? Температура воздуха t=200С. Эффективный диаметр молекулы воздуха dэф=0,30 нм.
169. Динамическая вязкость аргона при нормальных условиях h=22 мкПа×с. Вычислить длину свободного пробега l молекулы аргона и коэффициент диффузии D аргона при нормальных условиях.
170. Между двумя пластинами, расположенными на расстоянии l=2 мм друг отдруга, находится воздух при нормальных условиях. Между пластинами поддерживается разность температур DТ=20 К. Площадь каждой пластины S=150 см2. Найти количество теплоты Q, передаваемое от одной пластины к другой за t=0,5 ч. Эффективный диаметр молекулы воздуха d=0,30 нм.
171. Кислород и углекислый газ находятся при одинаковых температуре и давлении. Эффективные диаметры молекул этих газов соответственно равны 0,35 нм и 0,40 нм. Найти для этих газов отношения: а) коэффициентов диффузии D1/D2; б) коэффициентов внутреннего трения h1/h2.
172. Коэффицент диффузии кислорода при 00С равен 0,19 см2/с. Определить длину свободного пробега молекул кислорода.
173. Коэффициент теплопроодности кислорода при 1000С равен 3,25×10-2 Вт/м×К. Вычислить коэффициент вязкости кислорода при этой температуре.
174. Сколько молекул содержится в 1 см3 водорода, находящегося при давлении 1,013×105 Па и температуре 270С? Чему равна средняя арифметическая скорость этих молекул? Сколько соударений в секунду испытывает молекула, если ее эффективный диаметр равен 2,3×10-8 см?
175. За сколько времени 720 мг углекислого газа продиффундирует из чернозема в атмосферу через 1 м2 его поверхности при среднем градиенте плотности азота в направлении, перпендикулярном площади, равном 0,5×10-6 г/см4? Коэффициент диффузии принять равным 0,04 см2/с.
176. Найти количество азота, прошедшего вследствие диффузии через площадку 10 см2 за время 5 с, если градиент плотности азота в направлении, перпендикулярном площади, равен 1,26×10-3 г/см4. Коэффициент диффузии 1,42 см2/с.
177. Вычислить среднюю длину свободногопробега молекул хлора (Cl2) при температуре 00С и давлении 1,013×105 Па. Эффективный диаметр молекулы принять равным 3,5×10-10 м.
178. За сутки через 1 м2 поверхности дерева из подзолистой почвы продиффундировало 145 г углекислого газа. Определить коэффициент диффузии углекислого газа, если градиент плотности равен 1,4×10-5 г/см4.
179. Коэффициент диффузии водорода при нормальных условиях равен 0,91 см2/с. Определить коэффициент теплопроводности водорода при этих условиях.
180 Какова плотность разреженного водорода, если средняя длина свободного пробега его молекул равна 0,1 м. Эффективный диаметр молекулы водорода принять равным 2,3×10-8 см.
181. Какое количество теплоты теряется ежечасно через двойную парниковую раму за счет теплопроводности воздуха, заключенного между его полиамидными пленками? Площадь каждой пленки 4 м2, расстояние между ними 30 см, температура в парнике 50С, а наружный воздух имеет температуру -100С. Температуру воздуха между пленками считать равной средней арифметической этих температур. Радиус молекулы воздуха 1,5×10-10 м, масса моля воздуха 0,029 кг/моль.
182. Эффективный диаметр молекулы аргона 2,7×10-8 см. Определить коэффициент внутреннего трения для аргона при 500С.
183. При каком давлении средняя длина свободного пробега молекул водорода 2,5 см? Температура водорода 680С, а эффективный диаметр молекулы 2,3×10-10 м.
184. Найти среднее число столкновений в секунду молекулы углекислого газа при 1000С, если средняя длина свободного пробега молекул 8,7×10-2 см.
185. При нормальных условиях коэффицент внутренннего трения азота равен 1,7×10-5 Па×с. Найти среднюю длину свободного пробега молекул азота.
186. Сколько молекул содержится в 1 см3 кислорода, находящегося при давлении 1,013×105 Па и температуре 270С? Чему равна средняя арифметическая скорость этих молекул? Сколько соударений в секунду испытывает молекула, если ее эффективный диаметр 2,9×10-10 м?
187. Определить среднюю длину свободного пробега молекул кислорода при нормальных условиях. Эффективный диаметр молекулы кислорода принять равным 2,9×10-10 м.
188. Найти среднюю длину свободного пробега молекул углекислого газа, если его плотность равна 1,7 кг/м3, а эффективный диаметр молекул равен 3,5×10-10 м.
189. Найти коэффициент внутреннего трения гелия при нормальных условиях, если при этом средняя длина свободного пробега его молекул равна 0,184 мкм.
190. Найти коэффициент внутреннего трения водорода при нормальных условиях, если коэффициент диффузии для него при этих условиях равен 0,91×10-4 м2/с.
191. Коэффициент внутреннего трения и коэффициент диффузии азота соответственно равны
1,78×10-5 Па×с и 1,42×10-5 м2/с. Найти при этих условиях плотность азота, среднюю длину свободного пробега и среднюю арифметическую скорость его молекул.
192. Найти коэффициент теплопроводности кислорода, если известно, что коэффициент внутреннего трения для него при этих условиях равен 1,88×10-5 Па×с.
193. Какова плотность разряженного водорода, если средняя длина свободного пробега его молекул 1 см, а эффективный диаметр молекулы 2,3×10-10 м?
Дата добавления: 2014-12-04; просмотров: 7901;
