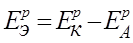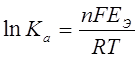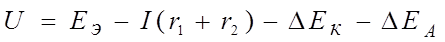Поляризация приводит к бесполезной трате электрохимической энергии, т.к. снижает полезное напряжение химического источника тока
1. Власова В.М.Основы предпринимательской деятельности.–М:Финансы и статистика, 1994.
2. Гребнев Л.С. Макроэкономика. – М.: Госуниверситет. Высшая школа экономики, 2000.
3. Грязнова А.Г. Микроэкономика. Теория и российская практика. – М.: Кнорус, 2007.
4. Елецов Р.Г. Макроэкономика. – М.: ДЛС, 1997.
5. Елецов Р.Г. Микроэкономика. – М.: ДЛС, 1997.
6. Козырев В.М. Основы современной экономики. – М.: Финансы и кредит, 2000.
7. Михайлушкин А.И., Шимко П.Д. Начала экономики. М.: Высшая школа, 2005.
8. Михайлушкин А.И., Шимко П.Д. Основы экономика. Санкт-Петербург, 2007.
9. Михайлушкин А.И Экономика. Практикум. М., Высшая школа, 2006.
10. Нуреев Р.М. Курс макроэкономики. М.: Норма, 2004.
11. Нуреев Р.М. Курс микроэкономики. М.: Норма, 2004.
12. Станковская И.К. Экономическая теория. Полный курс МВА. – М.: Эксмо, 2007.
ЛЕКЦИЯ
Г А Л Ь В А Н И Ч Е С К И Й Э Л Е М Е Н Т
 |
|
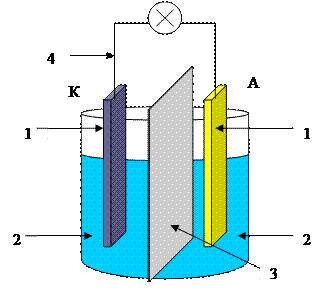
Схема гальванической цепи
или гальванического элемента
В отсутствии тока (при разомкнутой цепи) на обоих электродах устанавливается равновесие на межфазной границе:
А: Mе1(р-р)n+ + n 
 Mе1(к), ЕрА
Mе1(к), ЕрА
К: Mе2(р-р)n+ + n 
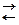 Mе2(к), Ерк
Mе2(к), Ерк
|
|
При замыкании цепи равновесие нарушается: во внешней цепи возникает самопроизвольное направленное движение электронов от А к К
 А: Mе1(к) ® Mе1(р-р)n+ + n
А: Mе1(к) ® Mе1(р-р)n+ + n  , ЕiА
, ЕiА
К: Mе2(р-р)n+ + n  ® Mе2(к), Еiк
® Mе2(к), Еiк


 Mе1(к) + Mе2(р-р)n+ + n
Mе1(к) + Mе2(р-р)n+ + n  ® Mе1(р-р)n+ + n
® Mе1(р-р)n+ + n  + Mе2(к)
+ Mе2(к)
уравнение токообразующей реакции (ТОР):
Mе1(к) + Mе2(р-р)n+ ® Mе1(р-р)n+ + Mе2(к)
|
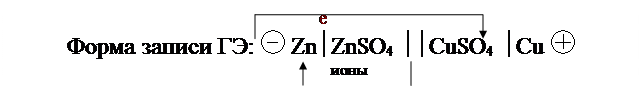
Г Э Д А Н И Э Л Я - Я К О Б И
 | |||
| |||
Сu
|
|
Zn2+/Zn –
Цепь замкнута:
А: Zn → Zn2+ + 2e -окисление
К: Cu2+ + 2e → Cu -восстановление
ТОР: Zn + Сu2+ → Zn2+ + Cu
 |

ЕЭ = Е0 Cu2+/Cu – Е0 Zn2+/Zn = 0,337 – (-0,763) = 1,1 B
ТЕРМОДИНАМИКА ЭЛЕКТРОТЕХНИЧЕСКИХ СИСТЕМ
|
|
nF - кол-во электричества, прошедшее через цепь; ЕЭ– ЭДС;
n- число моль электронов.
 |
Т.к. Аmax э = Аmax р.Þ при обратимом процессе (р,Т = cоnst):
|
| ||||
 | |||||
Пример: пусть ТОР ГЭ 2А + В Û 3D + K
 | ||
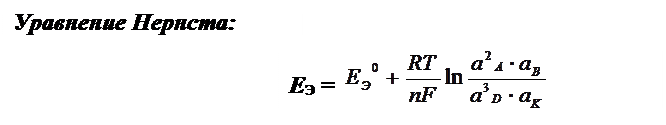 |
Зная DGТОР, EЭ можно рассчитать константу равновесия
 |
DGТОР = -nFEЭ ЕЭ = -DGТОР / nF
| |||||
| |||||
 | |||||
Задача. Рассмотрите работу серебряного-цинкового ГЭ.
Напишите анодные и катодные процессы, рассчитайте
стандартную ЭДС элемента при 298 К двумя способами.
Решение: из таблицы: 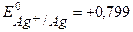 В,
В,  В.
В.
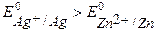 Þ Ag – катод, Zn – анод.
Þ Ag – катод, Zn – анод.

 А: Zn ® Zn+2 + 2e 1
А: Zn ® Zn+2 + 2e 1
K: Ag+ + e ® Ag 2 2
 |
ТОР: Zn + 2Ag+ ® Zn+2 + 2Ag
1-й способ:
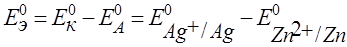 = 0,799 – (– 0,763) = 1,562 В
= 0,799 – (– 0,763) = 1,562 В
2-й способ:
Е0Э = -DG0ТОР / nF
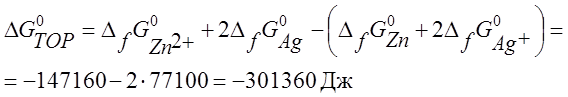
 Е0Э = - (-301360 / 2•96500) = 1,561 В
Е0Э = - (-301360 / 2•96500) = 1,561 В
Задача. Напишите катодные и анодные процессы цинк-
серебрянного ГЭ, рассчитайте Е0Э при Т = 298 К
и ЕЭ при aктивностях ионов Zn2+ и Ag+ равных по
0,01 моль/л.
Решение: из таблицы: 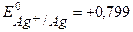 В,
В,  В.
В.
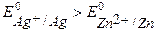 Þ Ag – катод, Zn – анод.
Þ Ag – катод, Zn – анод.

 А: Zn ® Zn+2 + 2e 1
А: Zn ® Zn+2 + 2e 1
K: Ag+ + e ® Ag 2 2
 |
ТОР: Zn + 2Ag+ ® Zn+2 + 2Ag
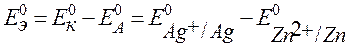 = 0,799 – (– 0,763) = 1,562 В
= 0,799 – (– 0,763) = 1,562 В
используем уравнение Нернста для металлических электродов:
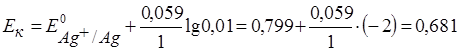 B.
B.
 B.
B.
 В.
В.
 |
Задача. Рассчитайте количество электричества, прошедшего через
электродную поверхность цинк – серебряного ГЭ, если в
результате электрохимической реакции при 298 К масса
анода уменьшилась на 1 г.
Решение: Анодом в данном ГЭ является цинковый электрод.
Количество электричества, прошедшего через поверхность рассчитывается из объединенного закона Фарадея:
|
КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
 | |||
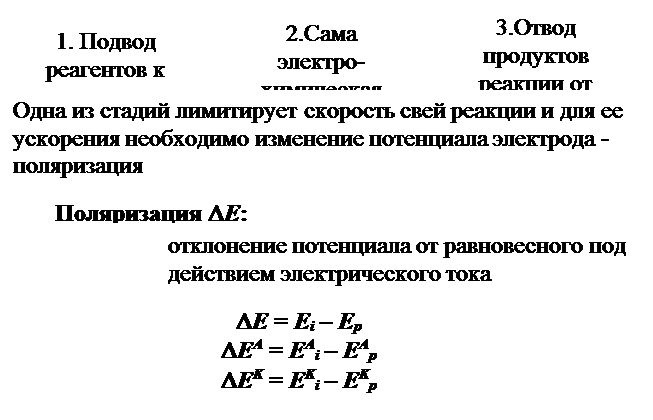 |
Согласно закону Фарадея, ток (I) пропорционален количеству вещества, прореагировавшему на электродах в единицу времени, т.е. скорости электрохимической реакции:
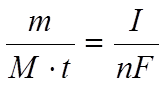 Þ значение I для оценки скорости
Þ значение I для оценки скорости
При одном и том же потенциале в зависимости от площади электрода могут быть разные токи:
i = I/S -плотность тока
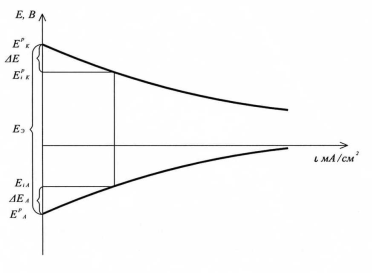
Строят график зависимости Е =f(i) – поляризационные кривые.
 |
В гальваническом элементе при прохождении электрического тока
Е анодастановится более положительным
Е катода – более отрицательным
U - уменьшается
|
U – напряжение ГЭ;
I(r1 + r2) - омическое падение напряжения;
r1-сопротивлениев проводниках с электронной
проводимостью (проводники 1-го рода);
r2 -сопротивление в электролит (проводник 2-го рода);

 |  | ||
| |||
| |||
По уравнению Нернста Е пропорционален логарифму активности (концентрации) ионов Þ
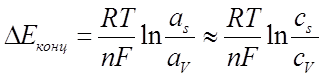
аs,v – активности ионов в приэлектродном слое(S)
или в объеме раствора(V)
С увеличением i возрастает концентрационная поляризация
|
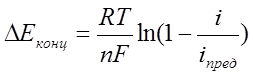
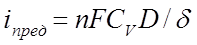
i пред – предельная плотность тока
D – коэффициент диффузии
реагента
d - толщина диффузного слоя
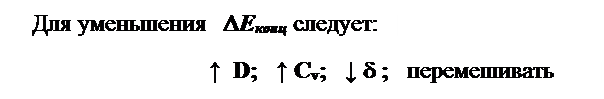 |
Зависимость между перенапряжением и плотностью тока:

Коэффициенты а, в – зависят от природы реакции,
температуры, рН,Sэлектродов
и определяются из графиков
зависимости DЕэл/х = f(lgi)
 |
Поляризация приводит к бесполезной трате электрохимической энергии, т.к. снижает полезное напряжение химического источника тока
С целью увеличения напряжения необходимо:
1) 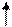 ЭДС ГЭ;
ЭДС ГЭ;
2) 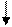 поляризацию;
поляризацию;
3)  омические потери, для чего:
омические потери, для чего:
- уменьшить ток,
- уменьшить r1 и r2
(за счет расстояния между электродами, использовать добавки увеличивающие электропроводность электролита)
| <== предыдущая лекция | | | следующая лекция ==> |
| Схема 16 | | | Вопрос 2. Предмет экономической теории: потребности, блага и ресурсы |
Дата добавления: 2014-12-03; просмотров: 957;