Омская государственная медицинская академия
Комплексные соединения диссоциируют в растворах как сильные электролиты на внешнюю и внутреннюю сферы (комплексы): [Сu(NН3)4]SО4 ® [Сu(NН3)4]2+ + SО42-
Комплексы (комплексные ионы) диссоциируют как слабые электролиты.
Диссоциация - многоступенчатая:
[Cu(NH3)4]2+ Û [Cu(NH3)3]2+ + NH3 К1
[Cu(NH3)3]2+ Û [Cu(NH3)2]2++ NH3 К2
[Cu(NH3)2]2+ Û [Cu(NH3)]2+ + NH3 К3
[Cu(NH3)]2+ Û Cu2+ + NH3 К4
_________________________________________
[Cu(NH3)4]2+ Û Cu2+ + 4 NH3 КН
Константа суммарной реакции КН - константа нестойкости равна произведению констант диссоциации по отдельным ступеням КН = К1К2К3К4.
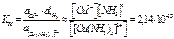 (при 298К)
(при 298К)
В растворах прочных комплексов концентрация ионов комплексообразователя мала.
В общем виде для диссоциации комплекса [МХn]z Û Мn+ + yXm
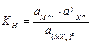 табличная величина
табличная величина
где z - заряд комплекса;
n+ - заряд комплексообразователя;
m - заряд лиганда,
y – координационное число
Константа обратного процесса, т. е. процесса образования комплекса, называетсяконстантой устойчивости КУ = 1/КН.
Чем ниже константа нестойкости комплекса и чем выше константа устойчивости, тем прочнее комплекс.
Константы нестойкости КН и устойчивости КУ зависят от природы лигандов и комплексообразователя, а также от значения координационного числа.
Основные учебники и учебные пособия
1. Н.В.Коровин. Общая химия
2. Н.В.Коровин и др. Лабораторные работы по химии
3. Задачи и упражнения по общей химии. Под ред. Н.В.Коровина
4. Общая химия. Теория и расчеты. Под ред. Н.В. Коровина
Омская государственная медицинская академия
Дата добавления: 2014-12-03; просмотров: 962;
