Каталитические методы очистки газов

 Суть каталитических процессов газоочистки заключается в реализации химических взаимодействий, приводящих к конверсии подлежащих обезвреживанию примесей в другие продукты в присутствии специальных катализаторов. Последние не вызывают изменения энергетического уровня молекул взаимодействующих веществ и смещения равновесия простых реакций. Их роль сводится к увеличению скорости химических взаимодействий. Каталитические взаимодействия в гетерогенном катализе происходят на границе раздела фаз конвертируемой газовой смеси и катализатора. Последний обеспечивает взаимодействие на его поверхности конвертируемых веществ с образованием активированных комплексов в виде промежуточных поверхностных соединений катализатора и реагирующих веществ, формирующих затем продукты катализа, освобождающие (восстанавливающие) поверхность катализатора. Схема этого явления для газовой реакции А + В~*→С в присутствии катализатора К может быть представлена следующим образом:
Суть каталитических процессов газоочистки заключается в реализации химических взаимодействий, приводящих к конверсии подлежащих обезвреживанию примесей в другие продукты в присутствии специальных катализаторов. Последние не вызывают изменения энергетического уровня молекул взаимодействующих веществ и смещения равновесия простых реакций. Их роль сводится к увеличению скорости химических взаимодействий. Каталитические взаимодействия в гетерогенном катализе происходят на границе раздела фаз конвертируемой газовой смеси и катализатора. Последний обеспечивает взаимодействие на его поверхности конвертируемых веществ с образованием активированных комплексов в виде промежуточных поверхностных соединений катализатора и реагирующих веществ, формирующих затем продукты катализа, освобождающие (восстанавливающие) поверхность катализатора. Схема этого явления для газовой реакции А + В~*→С в присутствии катализатора К может быть представлена следующим образом:
А + В + К→ К[АВ], К[АВ] → С + К,
где К[АВ] – активированное промежуточное соединение на поверхности катализатора.
В ряде случаев функции поверхности катализатора заключаются в зарождении реакционных цепей, развивающихся затем в объеме конвертируемой газовой фазы, где осуществляется дальнейшая конверсия целевого компонента по гетерогенно-гомогенному механизму.
Изменение реакционного пути химического взаимодействия в присутствии катализатора в соответствии с указанными механизмами приводит к понижению его энергии активации, что и выражается в ускоряющем действии катализатора, как это следует из уравнения Аррениуса:
 , (112)
, (112)
где k – константа скорости реакции; k0 – предэкспоненциальный множитель; E – энергия активации; R – газовая постоянная; Т – абсолютная температура.
В некоторых типах каталитических взаимодействий с понижением энергии активации уменьшается предэкспоненциальный множитель в уравнении Аррениуса. Поэтому рассчитанное на основании снижения значения Е увеличение константы скорости k несколько превышает действительную скорость каталитического взаимодействия. В случае каталитических взаимодействий, при которых не происходит изменения k0по сравнению с некатализируемымн реакциями, ускоряющее действие катализатора выражают его активностью А, характеризующейся отношением констант скоростей реакций, происходящих с участием катализатора kk и без него k:
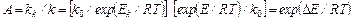 , (113)
, (113)
где ΔE = E – Ek; Ek – энергия активации реакции в присутствии катализатора.
Активность катализатора обычно определяется совокупностью физико-химических свойств как самого катализатора, так и конвертируемого газового потока. В наибольшей степени она зависит от температуры каталитического превращения, структуры катализатора, содержания в нем промоторов, давления, объемного расхода, концентрации и молекулярных масс исходных реагентов и продуктов конверсии в газовой смеси.
Активность различных катализаторов при заданных условиях конвертирования определенной газовой смеси наиболее просто можно сопоставить по степени превращения исходных реагентов. Оценка активности одного катализатора в различных условиях проведения определенного каталитического превращения может быть выражена, например, отношением количества образующихся в единицу времени продуктов Gn к объему V, массе Gк, работающей S или удельной Sуд поверхности катализатора:
A = Gn/V; A = Gn/ Gк ; A = Gn/S; Aуд.= GnISyдV. (114)
Масса и свойства катализатора теоретически не должны претерпевать изменений в процессе его работы. На практике, однако, в процессе эксплуатации катализаторов они в той или 






 иной степени подвергаются постепенной дезактивации или деструкции. Факторы, обусловливающие изменения активности катализаторов, могут быть как химическими, так и физическими.
иной степени подвергаются постепенной дезактивации или деструкции. Факторы, обусловливающие изменения активности катализаторов, могут быть как химическими, так и физическими.
К факторам химической природы относятся – отравление каталитическими ядами, присутствующими в конвертируемых газах, недостаточная селективность катализатора, возможность образования нелетучих продуктов и т.п.
К физическим факторам можно отнести механическое истирание, спекание, агрегатирование под действием избыточной свободной энергии поверхности и т. п. Снижение активности катализатора приводит к необходимости периодической регенерации (активации) или замены катализаторов.
В этой связи к промышленным катализаторам предъявляют требования в отношении высокой активности и теплопроводности, а также стойкости к механическим и термическим нагрузкам. Наряду с этим они должны быть дешевыми и, обладая необходимыми структурными параметрами, иметь возможно более низкие температуры зажигания и геометрию частиц, обеспечивающую низкое гидравлическое сопротивление слоя. Необходимые для эффективного осуществления соответствующих процессов газоочистки катализаторы обычно подбирают экспериментальным путем.
В процессах санитарной каталитической очистки отходящих газов промышленности высокой активностью характеризуются контактные массы на основе благородных металлов (платина, палладий, серебро и др.), оксидов марганца, меди, кобальта, а также оксидные контакты, активированные благородными металлами (1,0–1,5%).
Типы катализаторов. Присутствующие в отходящих технологических газах и вентиляционных выбросах большого числа производств токсичные пары органических веществ в большинстве случаев подвергают деструктивной каталитической очистке. Катализаторы для таких процессов приготовляют на основе меди, хрома, кобальта, марганца, никеля, платины, палладия и других металлов. В отдельных случаях используют некоторые природные материалы (бокситы, цеолиты).
Среди катализаторов условно различают:
1) цельнометаллические, представляющие собой металлы платиновой группы или неблагородные металлы, нанесенные на ленты, сетки, спирали или листы из нержавеющей стали;
2) смешанные, включающие металлы платиновой группы и оксиды неблагородных металлов, нанесенные на оксид алюминия, нержавеющую сталь или другие металлы;
3) керамические, состоящие из металлов платиновой группы или оксидов неблагородных металлов, нанесенных на керамическую основу в виде сот или решеток;
4) насыпные, приготовляемые в виде гранул или таблеток различной формы.
Гетерогенное каталитическое превращение является сложным многоступенчатым процессом. Основными его стадиями являются:
1) диффузия исходных реагентов из ядра газового потока к поверхности гранул (зерен) катализатора (внешняя диффузия);
2) проникание этих веществ в порах катализатора к активным центрам его внутренней поверхности (внутренняя диффузия);
3) активированная адсорбция продиффундировавших реагентов поверхностью катализатора с образованием поверхностных химических соединений;
4) химическое взаимодействие адсорбированных веществ с образованием продуктов реакций;
5) десорбция продуктов и их перенос к наружной поверхности гранул катализатора (внутренняя диффузия) и затем от этой поверхности в ядро газового потока (внешняя диффузия).
Наблюдаемая скорость такого комплексного процесса определяется скоростью наиболее медленной, лимитирующей стадии при условии практически мгновенного достижения равновесия в других стадиях. В случае примерного равенства скоростей каждой стадии процесса говорят о протекании каталитического превращения в смешанной области.
Скорость каталитической реакции W, как и любой химической реакции в газовой фазе, определяется парциальными давлениями исходных веществ и продуктов реакции и меняется с изменением температуры:
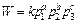 , (115)
, (115)
гдер1, р2 , p3 – парциальные давления реактантов; а, b, с – порядки реакции по соответствующим компонентам реакционной смеси; k –константа скорости реакции, меняющаяся с температурой в соответствии с уравнением (111).
Если в очищаемых потоках присутствуют примеси, в процессах каталитической газоочистки могут идти параллельные их превращения. При повышенном содержании примесей может происходить их конкурентная адсорбция на активных центрах поверхности катализатора, приводящая к тормозящему влиянию более активного компонента на каталитическое превращение менее реакционноспособной примеси. При малых концентрациях обезвреживаемых примесей такие эффекты обычно отсутствуют, что позволяет наряду с реализацией очистки газов от нескольких загрязнителей одновременно обеспечить ее интенсификацию, вводя в обрабатываемый поток газообразные вещества, способствующие снижению температуры начала взаимодействия и его протеканию с выделением большего количества тепла. Большая экзотермичность таких взаимодействий может значительно увеличивать температуру в зоне катализа, обеспечивая улучшение степени обезвреживания примесей даже при невысоких температурах направляемых на каталитическую очистку газовых потоков. Роль дополнительно вводимых газовых компонентов не ограничивается увеличением температуры каталитического взаимодействия. В ряде случаев они могут активировать поверхность катализатора.
В технологии очистки газов используется как каталитическое восстановление, так и каталитическое окисление.
Для обезвреживания отходящих газов от оксидов азота применяют высокотемпературное каталитическое восстановление, селективное каталитическое восстановление и разложение гетерогенными восстановителями.
Высокотемпературное каталитическое восстановление оксидов азота происходит при контактировании нитрозных газов с газами-восстановителями на поверхности катализаторов.
В качестве катализаторов используют металлы платиновой группы (палладий, рутений, платина, родий) или более дешевые, но менее эффективные и стабильные в эксплуатации составы, включающие никель, хром, медь, цинк, ванадий, церий и другие элементы. С целью увеличения поверхности контакта их наносят на пористые или непористые материалы (керамика, оксид алюминия, силикагель, металлические ленты и т.п.) различной формы. Восстановителями являются метан, природный, коксовый или нефтяной газ, оксид углерода, водород или азото-водородная смесь [16].
Эффективность обезвреживания NOx зависит прежде всего от активности используемого катализатора. В частности, катализаторы на основе платиновых металлов при объемных скоростях газа (2–12)∙104 ч–1 позволяют достигать остаточных концентраций NOx 5∙10–4–5∙10–2 об.%.
Одним из современных и перспективных методов обезвреживания вредных органических примесей и оксида углерода в газовых выбросах сложного состава является глубокое каталитическое окисление. Этот метод обеспечивает достаточно высокую степень очистки при расходе топлива, в несколько раз меньшем, по сравнению с расходом при термическом методе.
Каталитическое окисление или каталитическое сжигание применяют, когда содержание горючих органических продуктов, находящихся в отходящих газах, мало и для их обезвреживания невыгодно использовать метод прямого сжигания. В этом случае процесс протекает при
200…300°С вместо 950…1100°С при прямом сжигании.
В качестве катализаторов используются металлы группы платины и ряд других соединений. Установлено, например, что щелочные металлы и их соединения, нанесенные на различные носители (например, оксиды металлов), часто оказываются более эффективными, надежными и дешевыми, чем катализаторы из благородных металлов. На таких катализаторах реакция окисления начинается при невысоких температурах (около 200°С), что значительно повышает возможность их использования для каталитического сжигания промышленных газообразных отходов.
Катализаторы чувствительны к составу обезвреживаемых газов. Некоторые элементы (фосфор, кремний, свинец, железо, ванадий, мышьяк) даже в очень малых количествах могут отравлять катализатор. Ухудшают работу катализаторов и сокращают сроки их службы галогены и сера как в элементной форме, так и в соединениях. Например, недопустима концентрация хлорорганических и сернистых соединений порядка 1000–5000 мг/м3 из-за отравляющего действия соляной кислоты и триоксида серы. Наконец, каталитическое окисление неприменимо для газов, содержащих высококипящие или высокомолекулярные соединения, вследствие неполного сгорания и забивания поверхности катализатора.
Условия проведения реакции глубокого окисления: температура процесса, аэродинамическая обстановка, структура и геометрические характеристики используемого катализатора – определяют конструкцию аппаратов для проведения каталитического обезвреживания примесей промышленных газообразных выбросов.
Многочисленные промышленные процессы газоочистки, основанные на каталитических реакциях окисления, имеют различные варианты технического осуществления (рис.75).
Схему простого каталитического дожигания (рис. 75, а) применяют при очистке небольшого объема отходящих газов и в отсутствие потребителя горячего теплоносителя. Очищаемый газ, если его температура ниже необходимой для процесса дожигания, нагревают до требуемой температуры и направляют на катализатор.
После прохождения через слой катализатора газ выбрасывается в атмосферу, а полученное им тепло остается неиспользованным.
Схему с частичной рециркуляцией газов (рис 75, б) используют для достижения некоторой экономии топлива. При этом способе появляется возможность регулирования концентрации компонентов в газе, поступающем в контактное устройство. Кроме того, в результате разбавления предотвращается возможность возникновения в лобовых слоях катализатора температурных пиков и его разрушения.
 «Мазутную» схему (рис. 75, в) применяют тогда, когда в дымовых газах после сжигания топлива содержатся соединения, являющиеся ядом для катализатора. В этом случае подогрев очищаемых газов до температуры, необходимой для начала реакции глубокого окисления примесей на катализаторе, осуществляется в теплообменном устройстве.
«Мазутную» схему (рис. 75, в) применяют тогда, когда в дымовых газах после сжигания топлива содержатся соединения, являющиеся ядом для катализатора. В этом случае подогрев очищаемых газов до температуры, необходимой для начала реакции глубокого окисления примесей на катализаторе, осуществляется в теплообменном устройстве.
Схема установки каталитического дожигания с утилизацией тепла (рис. 75, г), кроме подогревателя и контактного устройства, оснащена утилизатором тепла. В зависимости от температуры очищенных газов тепло может быть использовано для получения горячей воды, технического пара.
Различные схемы каталитического обезвреживания обусловливают многообразие их аппаратурного оформления в зависимости от типа катализатора и расположения (горизонтальное или корзиночное) топок, рекуператоров и т. п. Два типа топок каталитического обезвреживания, объединенных в одном корпусе (с рекуперацией тепла и без нее), занимающих минимальные производственные площади показаны на рис. 76.
Выбор и оценка различных катализаторов должны проводиться с учетом состава, количества образующихся газов, технологии производства, концентраций и особенностей сгорающих веществ и примесей. Считают, что катализаторы на металлическом носителе обладают рядом преимуществ по сравнению с другими: большой срок службы катализатора (до 10 лет), возможность регенерации, высокая механическая прочность, устойчивость к истиранию, небольшая масса, большая поверхность соприкосновения с обрабатываемым газом. Высокая механическая прочность, термостабильность и незначительное гидравлическое сопротивление делают металлические катализаторы пригодными для очистки больших объемов газовых выбросов.
 Достоинствами каталитических методов очистки газа являются простота и универсальность. Один и тот же катализатор можно использовать для работы на различных видах выбросов, изменив расход топлива и соответственно температуру в реакционной зоне. Однако этот метод имеет и существенные недостатки: сложность аппаратурного оформления и сравнительно высокие капитальные и эксплуатационные затраты.
Достоинствами каталитических методов очистки газа являются простота и универсальность. Один и тот же катализатор можно использовать для работы на различных видах выбросов, изменив расход топлива и соответственно температуру в реакционной зоне. Однако этот метод имеет и существенные недостатки: сложность аппаратурного оформления и сравнительно высокие капитальные и эксплуатационные затраты.
Устранение неприятных запахов.Многие вещества, поступающие в атмосферный воздух, обладают неприятными запахами и могут вызвать ощущение тошноты, головные боли, чувство подавленности и т. п. Присутствие этих веществ в воздухе даже в самом незначительном количестве создает неприятные ощущения. Вещества – носители неприятных запахов могут находиться в воздухе в жидком, твердом и газообразном состояниях.
Человек ощущает запах, если концентрация данного вещества превышает пороговую. Пороговая концентрация вещества – это такая концентрация, при которой челове, находившийся в среде, не содержащей такого вещества, начинает ощущать его запах. Значения пороговых концентраций некоторых газов: аммиак – 0,00053; акролеин – 0,00018; сероводород – 0,000018. При одновременном присутствии в воздухе нескольких газов, вызывающих неприятные ощущения; обоняние воспринимает присутствие лишь одного газа, обладающего самым сильным запахом, остальные газы он маскирует [22].
В некоторых населенных пунктах, расположенных вблизи предприятий, основным негативным фактором качества воздуха является наличие неприятных запахов. Люди, длительное время находящиеся вблизи источника запаха, обычно менее чувствительны к запаховым раздражителям по сравнению с лицами, не находящимися там продолжительное время. Привыкание является нежелательным явлением, поскольку у человека нарушается сигнальная реакция на раздражитель. Привыкание не следует воспринимать как показатель отсутствия вредного действия запаха. Речь идет лишь о процессе торможения в корковой части обонятельного анализатора.
Многие неприятно пахнущие вещества имеют органическое происхождение. В пищевой промышленности есть источники неприятных запахов – на мясоперерабатывающих, рыбных, масложировых и других производствах.
Для борьбы с неприятными запахами на предприятиях применяется ряд методов. Выбор их определяется видом неприятно пахнущего вещества, его концентрацией в воздухе, физико-механическими свойствами и другими параметрами. В ряде случаев эффект дает озонирование. При распаде озона О3 образуется атомарный кислород О, который очень активно вступает в реакцию с носителем запаха. В результате неприятный запах устраняется.
Но более распространенные методы устранения неприятных запахов – это термическое и каталитическое сжигание. Каталитический метод состоит в окислении неприятно пахнущего вещества (НПВ) при высокой температуре в присутствиикатализатора. Как указывалось ранее метод высокотемпературного окисления можно использовать для устранения неприятных запахов только в том случае, если окисление полное и продукты реакции запахом не обладают.
Для улавливания НПВ можно также использовать метод адсорбции. Десорбция в этом случае заключается в промывке адсорбента, содержащего НПВ жидкими растворителями.
Дата добавления: 2014-12-30; просмотров: 2113;
