А) Диссоциация в водном растворе
O O
R-C  R-C + H+
R-C + H+
O-H O-
По степени диссоциации – это слабые кислоты. Наиболее сильная – муравьиная кислота. У других кислот углеводородный радикал, обладающий электродонорными свойствами, отталкивает электроны к водороду (положительный индукционный эффект), и кислотность снижается.
HCOOH Кд=2,14.10-4
CH3  C
C  O
O  H Кд=1,75.10-5
H Кд=1,75.10-5
О
Степень диссоциации увеличивается при введении в радикал электроноакцепторных групп, например, групп С=О, ОН, Cl. Чем ближе эти группы расположены к СООН, тем сильнее кислота. Например, у хлоруксусной кислоты
Cl  CH2
CH2  C
C  OH Кд=1,5.10-3
OH Кд=1,5.10-3
О
у трихлоруксусной
Cl
Cl  C
C 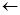 C-O-H Кд=2,1.10-1
C-O-H Кд=2,1.10-1
Cl
т.е. трихлоруксусная кислота аналогична сильным минеральным кислотам.
2) Образование солей происходит при взаимодействии с металлами, окисями, гидроокисями металлов, с некоторыми другими солями и аммиаком
а) 2HCOOH + Mg  H2 + (HCOO)2Mg
H2 + (HCOO)2Mg
формиат магния
б) 2СH3COOH + CaO  (CH3COO)2Ca + H2O
(CH3COO)2Ca + H2O
ацетат кальция
в) С2H5COOH + NaOH  H2O + C2H5COONa
H2O + C2H5COONa
пропионат натрия
г) CH3COOH + NaHCO3  CH3COONa + CO2 + H2O
CH3COONa + CO2 + H2O
д) CH3COONa + AgNO3  CH3COOAg + NaNO3
CH3COOAg + NaNO3
е) CH3COOH + NH3  [CH3COO-]N+H4
[CH3COO-]N+H4
3) Образование производных карбоновых кислот путем замещения гидроксила (реакции ацилирования)
Дата добавления: 2014-12-24; просмотров: 1630;
