Характеристики адсорбентов
Адсорбенты пористые твердые вещества с сильно развитой поверхностью пор. Удельная поверхность пор может составлять от 200 до 1000 м2 / г, а средний радиус пор от 0,2 до 10 нм. Адсорбенты применяют в виде таблеток или шариков размером от 2 до 6 мм, а также порошков размером от 20 до 500 мкм. В качестве адсорбентов используют активированный уголь, алюмосиликаты, цеолиты и др. Цеолиты (молекулярные сита) - синтетические адсорбенты с регулируемым размером пор, представляющий собой алюмосиликаты натрия и калия. Синтетические адсорбенты активнее, но значительно дороже природных. В качестве адсорбентов используются активированный уголь, силикагель, алюмосиликаты, цеолиты и др.
Цеолиты или молекулярные сита — синтетические или природные адсорбенты с регулярной структурой пор, представляющие собой алюмосиликаты натрия, калия или других элементов. Название произошло от сочетания двух греческих слов «цео» и «лит», т.е. «кипящие камни». Это объясняется тем, что заполняющая поры цеолитов вода при нагревании выделяется, т. е. цеолиты как бы «кипят».
Общая химическая формула Ме2/пО А1203 xSi02 уН20, где Me — катион щелочного металла; п — его валентность. В качестве катионов в состав природных цеолитов обычно входят натрий, калий, кальций, реже магний, барий, стронций. Кристаллическая структура цеолитов образована тетраэдрами Si04 и А104. В качестве природных цеолитов используют различные минералы: содалит, шабазит, морденит, фожазит и др.
Синтетические цеолиты имеют строение и геометрическую структуру, аналогичные природным цеолитам. Аналогами фожазита являются синтетические цеолиты типа X и Y.
Различают синтетические цеолиты типов А, X и Y.
Цеолиты типа А относятся к низкокремнистым формам: в них отношение Si02:Al203 не превышает 2.
Цеолиты типа X имеют мольное отношение Si02:Al203, которое может изменяться от 2,2 до 3,3.
Цеолиты типа Y характеризуются вышеупомянутым соотношением в пределах от 3,1 до 6. При увеличении этого показателя повышается кислотостойкость цеолитов. Размеры входных окон, определяющих избирательность цеолитов, изменяются от 3 до 9 А.
Важной характеристикой адсорбентов является их активность, под которой понимают массу адсорбированного вещества на единицу массы адсорбента в условиях равновесия:
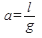 ( 96)
( 96)
где l масса поглощенных компонентов,
g масса адсорбента.
По отношению к разным компонентам смеси активность адсорбента различна. Так, парафиновые и нафтеновые углеводороды поглощаются в меньшей степени, чем ароматические, непредельные и гетероатомные углеводороды (содержащие атомы S, N, O). С увеличением размера молекул (молекулярной массы) сорбируемость молекул обычно возрастает.
Адсорбенты характеризуются также временем защитного действия, под которым понимают промежуток времени, в течение которого концентрация поглощаемых компонентов на выходе из слоя адсорбента не изменяется. При большем времени работы адсорбента происходит проскок поглощаемых компонентов, связанный с исчерпанием активности адсорбента. В этом случае необходима регенерация адсорбента.
В адсорберах периодического действия также имеет место износ адсорбента в результате давления вышележащего слоя адсорбента и условий десорбции. Из этих соображений высоту насыпного слоя в периодических адсорберах принимают обычно не более 3 м.
Изотерма адсорбции
Равновесие при адсорбции характеризуется определенной зависимостью между активностью адсорбента и парциальным давлением или концентрацией вещества в смеси. Состояние равновесия описывается уравнением Лэнгмюра:
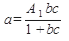 ( 97)
( 97)
и Фрейндлиха:
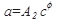 ( 98)
( 98)
где с- концентрация или парциальное давление адсорбируемого вещества;
а- активность (емкость) адсорбента,
А1, А2, b, d коэффициенты и показатель степени, зависящие от природы адсорбента, адсорбируемого вещества и температуры.
Приведенные уравнения называются уравнениями изотермы адсорбции (рисунок 20.1) .

С
Рис. 5.1 Общий вид изотермы адсорбции при разных температурах
Процесс адсорбции состоит из двух стадий: поглощения вещества поверхностью адсорбента и диффузии вещества в порах адсорбента. При адсорбции сначала поглощаются все компоненты смеси, однако после достижения состояния насыщения будет происходить обратный процесс- вытеснение молекул с меньшей степенью активности. Поэтому в слое адсорбента компоненты располагаются послойно по мере уменьшения активности. При десорбции компоненты выходят в обратном порядке. Это используется в препаративной и аналитической хроматографии.
Процессу адсорбции способствуют более низкие температуры, адсорбент для газов - повышенное давление. При удалении адсорбированных компонентов из адсорбента (при десорбции), наоборот, следует повышать температуру и понижать давление для газовых смесей.
В общем случае твердые частицы адсорбента имеют поры различного размера и формы, поэтому перенос вещества внутри гранул адсорбента может осуществляться одновременно различными способами.
Во многих случаях изменение активности адсорбента во времени удовлетворительно описывается следующим уравнением:
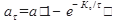
где аτ ,а — активность адсорбента в момент времени τ и при равновесии (τ →∞); Ка — константа скорости адсорбции.
Константа скорости адсорбции Ка зависит от температуры и концентрации адсорбируемого компонента.
С увеличением температуры скорость достижения равновесного состояния возрастает, при этом величина активности в условиях равновесия будет меньше, чем при более низкой температуре. Типичные кинетические кривые адсорбции приведены на рис. 5.2.
 аτ
аτ
0 τ
Рис. 5.2 Кинетические кривые адсорбции при разных температурах
ДЕСОРБЦИЯ
Для выделения поглощенных при адсорбции компонентов с целью направления их на дальнейшую переработку применяется процесс десорбции. В тех случаях, когда в газовом потоке или в растворе, проходящем через слой адсорбента, концентрации (парциальные давления) адсорбируемых компонентов ниже равновесных, данные компоненты будут покидать поверхность адсорбента и переходить в газовый (жидкостный) поток, т. е. десорбироваться. Это будет происходить до тех пор, пока не установится новое состояние равновесия.
На промышленных адсорбционных установках необходимо производить регенерацию адсорбента с целью восстановления его адсорбционной способности. Поэтому после окончания стадии адсорбции осуществляется стадия десорбции поглощенных компонентов из адсорбента.
Десорбция облегчается с повышением температуры и увеличением расхода десорбирующего агента. Десорбция газообразных и легколетучих компонентов облегчается при понижении давления в системе.
В результате десорбции адсорбционная способность адсорбента может восстанавливаться полностью или частично в зависимости от адсорбционной способности десорбируемых компонентов, выбранного метода десорбции, рабочих параметров процесса. В ряде случаев оправдано неполное восстановление активности адсорбента, так как при этом сокращаются эксплуатационные затраты.
Зависимость активности адсорбента а (по отношению к первоначальной его активности а0) от числа регенераций N представлена на рис.5.3. Приведенная кривая показывает, что наибольшее снижение активности адсорбента наблюдается после первой регенерации. В дальнейшем активность снижается постепенно и в меньшей степени. Такой характер восстановления активности адсорбента объясняется тем, что при регенерации часть его активной поверхности остается занятой адсорбированными компонентами и в дальнейшем исключается из участия в процессе адсорбции.
При использовании в качестве десорбирующих агентов полярных растворителей активность адсорбента восстанавливается наиболее полно. При окислительной регенерации активность адсорбента восстанавливается практически полностью. Температурный режим окислительной регенерации для силикагелей обычно 300 + 350 оС, для алюмосиликатов 600 + 650 оС. Недопустим перегрев адсорбента, так как это вследствие спекания пор адсорбента приводит к снижению или полной потере его активности

а/а0 N
Рис. 5.3 Характер восстановления активности адсорбента при регенерациях
Дата добавления: 2019-10-16; просмотров: 1934;
