ИЗОТЕРМА ВАНТ — ГОФФА, ВЫВОД И АНАЛИЗ
Константа равновесия определяют условия равновесия, когда концентрация (парциальные давления) является равновесными. В каком направлении пойдёт химическая реакция, если парциальное давление исходных веществ и продуктов реакции отличаются от равновесных? Ответить на этот вопрос поможет уравнение изотермы химической реакции.
Рассмотрим уравнение реакции: aA + bB ↔ cC + dD
Для изобарно-изотермического процесса изменение Гиббса равно:
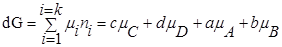
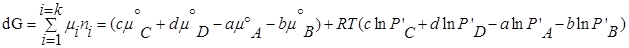 P’- неравновесное, парциальное давление компонентов.
P’- неравновесное, парциальное давление компонентов.
где 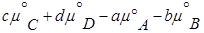 =
= 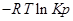
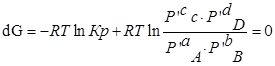
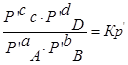
 - по форме записи напоминает константу равновесия, но отличается тем, что вместо равновесных давлений в него входят величины давления в данный момент времени.
- по форме записи напоминает константу равновесия, но отличается тем, что вместо равновесных давлений в него входят величины давления в данный момент времени.
Изотерма Вант-Гоффа:
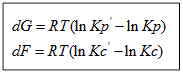
( 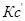 ) — это выражение, куда входят величины концентраций в данный момент времени.
) — это выражение, куда входят величины концентраций в данный момент времени.
Пример. 3H2(г)+N2(г)=2NH3(г); Kp=1,23*102
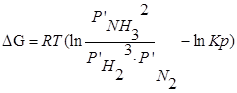
АНАЛИЗ ИЗОТЕРМЫ ВАНТ-ГОФФА
1. Главное значение изотермы реакции состоит в том, что она позволяет рассчитать ∆Gили ∆Fобратимый реакции для заданного состава реакционной смеси и определить, в каком направлении, и до какого предела протекает реакция при известных условиях.
aA + bB ↔ cC + dD
а) Если Кр˃Кр’, то lnКр˃lnКр’; ∆G˂0- реакция идет самопроизвольно в прямом направлении.
б) Если Кр˂Кр’, то lnКр˂lnКр’; ∆G˃0- реакция протекает самопроизвольно в обратном направлении, в сторону образования продуктов.
в) Если Кр=Кр’, то lnКр=lnКр’; ∆G=0- равновесие.
Если парциальное давление всех участников реакции в данный момент времени равны атмосферному давлению
Пусть PA’=PB’=PC’=PD’=1( 1,013*105Па), тоKp’=1; Тогда логарифм этого выражения будет равен нулю (lnKp’=0), а уравнение изотермы Вант – Гоффа примет вид:
∆G⁰=RT(lnKp’- lnKp)
∆G⁰=RTlnKp-стандартная энергия Гиббса
Выразм константу равновесия из последнего уравнения и получим:
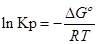

 Пример решения задачи:
Пример решения задачи:
В объеме 10л, взяли: 320(г) О2 , 10(г) Н2 и 180(г) паров воды . Определите, в какую направлении пойдёт химическая реакция: 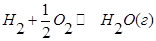 , если при температуре Т
, если при температуре Т
(Кс=10). Процесс изохорный.
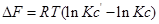
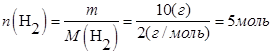 ;
;
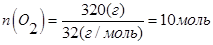 ;
;
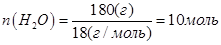 ;
;
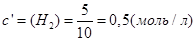 ;
;
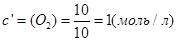 ;
;
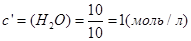 ;
;
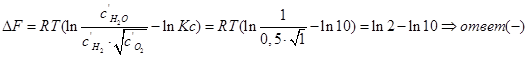
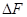 ˂0 - реакция идет в прямом направлении.
˂0 - реакция идет в прямом направлении.
ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА КОНСТАНТУ
РАВНОВЕСИЯ. УРАВНЕНИЕ ИЗОБАРЫ И ИЗОХОРЫ ВАНТ-ГОФФА (В-Г)
Константы равновесия — это величины постоянные при данной температуре. При изменении температуры константа равновесия изменяется, и довольно существенно.
Изменение константы равновесия и направления химической реакции в зависимости от температуры количественно характеризует уравнение изобары изохоры химической реакции.
ВЫВОД УРАВНЕНИЯ ИЗОБАРЫ И ИЗОХОРЫ
Разделим уравнение изотермы Вант- Гоффа на температуру:

Продифференцируем его по Т и перепишем:
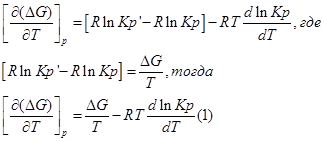
Представим уравнение Гиббса – Гельмгольца в виде:

Из уравнения (1) вычтем уравнение (2):
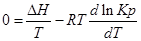
Окончательно имеем:
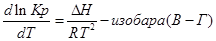
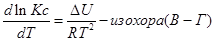
Эти уравнения показывают влияния температуры на константу равновесия, где определяющим фактором является тепловой эффект химической реакции.
АНАЛИЗ УРАВНЕНИЯ
Влияние температуры на константу равновесия определяется типом реакци.
1. Если тепловой эффект реакци ∆H(∆U)˃0(эндотермическая, поглощение), то 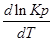 ˃0, тогда при увеличении температуры (Т↑) константа равновесия Кр увеличивается.
˃0, тогда при увеличении температуры (Т↑) константа равновесия Кр увеличивается.
В прямом - Т↑,Кр↑;
В обратном - Т↓,Кр↓.
2. Если ∆H(∆U)˂0 (экзотермическая, выделение), то 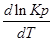 ˂0, тогда при повышении температуры константа равновесия Кр уменьшается или Кр увеличивается при понижении температуры.
˂0, тогда при повышении температуры константа равновесия Кр уменьшается или Кр увеличивается при понижении температуры.
В прямом - Т↓,Кр↑;
В обратном - Т↑,Кр↓.
3. Если ∆H(∆U)=0 , тов этом случае константа равновесия не зависит от температуры Кp ≠ f(T).
ИНТЕГРИРОВАНИЕ ИЗОБАРЫ В-Г
1. Приближенное интегрирование ∆Н ≠ f(Т),
тогда 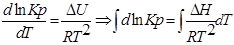 ;
;
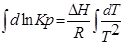 ;
;
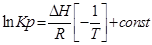 ;
;
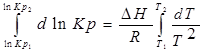 ;
;
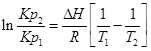 ;
;
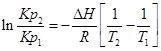 .
.
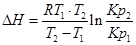
С помощью этого уравнения можно найти:
1. ∆Н (тепловой эффект реакции), если известны равновесия при двух различных температурах (Кр1(Т1) и Кр2(Т2))
2. Кр2(Т2) – константу равновесия при температуре Т2, если известна константа равновесия при другой температуре и тепловой эффект реакции (Кр1(Т1) и ∆Н).
Так как после интегрирования мы получили уравнение прямой, то эта зависимость может быть представлена на графике: lnKp(1) lnKp(2)
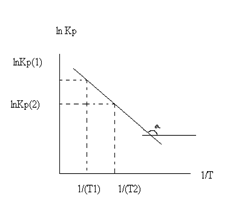
Тангенс угла наклона прямой реакции, исходя из уравнения прямой:
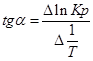 ;.
;.
2. Точное ∆Н = f(Т),
Зависимость теплового эффекта от температуры выражается уравнением:
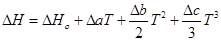
Подставим это уравнение в уравнение изобары Вант- Гоффа:
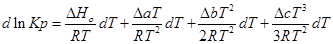 ;
;
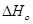 при Т=0(К)
при Т=0(К)
Проинтегрируем это уравнение и получим:
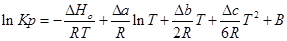 ;
;
где В - постоянная интегрирования, для нахождения необходимо знать значения константы равновесия Кр при любой фиксированной температуре.
Однако проводить расчеты с использованием данного уравнения довольно сложно и используется довольно редко.
Пример. Определим изменение эффекта реакции Fe+H2O+FeO+H2, если для Т1=900К, Кр1=1,452, а для Т2=1025К Кр2=1,285.
Используем уравнение: 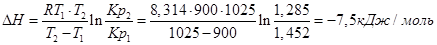
При повышении температуры от 900 до 1025К выделится дополнительно 7,5 кДж/моль теплоты.
| <== предыдущая лекция | | | следующая лекция ==> |
| Коэффициент обратного рассеяния | | | Нагревание поверхности Земли |
Дата добавления: 2017-09-19; просмотров: 4797;
