Напряжение циклов, конформации.
АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ или ЦИКЛОАЛКАНЫ
Определения, классификация.
Определения: Углеводороды, имеющие замкнутую цепь атомов углерода, включающую атомы углерода в состоянии sp3-, sp2- и sp-гибридизации, называются алициклическими углеводородами. Среди них наиболее распространенными являются углеводороды, замкнутая цепь которых построена только из атомов углерода в состоянии sp3-гибридизации. Такие алициклические углеводороды называются циклоалканами.
Циклоалканы имеют общую формулу Сn Н2n.
Циклоалканы классифицируются:
- по числу атомов углерода в цикле;
- по числу циклов в молекуле;
- по способу соединения циклов, если их в молекуле несколько.
По числу атомов в цикле различают малые циклы, включающие три- четыре атома углерода (С3 – С4), обычные – С5 - С7, средние – С8 - С11 и макроциклы (12 и более атомов углерода).
По числу циклов в молекуле различают моноциклические, бициклические и полициклические.
По способу соединения циклов различают спироалканы и мостиковые соединения. В молекуле спироалканов имеется один общий (узловой) атом углерода:

Схема 1. Примеры структурных формул спироалканов.
В молекуле мостиковых соединений два цикла имеются два и более общих атомов углерода:
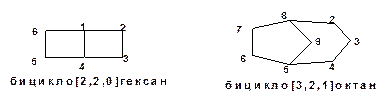
Схема 2. Примеры структурных формул мостиковых соединений.
Номенклатура.
По номенклатуре ИЮПАК названия циклических соединений строятся подобно наименованиям соединений жирного ряда с добавлением приставки «цикло-» при этом часто при изображении циклических структур символы атомов углерода и водорода опускают:
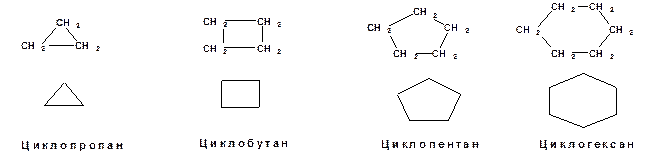
Схема 3. Примеры структурных формул циклических структур.
Если в цикле несколько заместителей, то проводится нумерация атомов углерода в цикле таким образом, чтобы сумма номеров углеродных атомов, где имеются заместители получилась минимальной. Одно- и двухвалентные радикалы, образованные из циклических углеводородов, называются аналогично радикалам ациклических углеводородов:
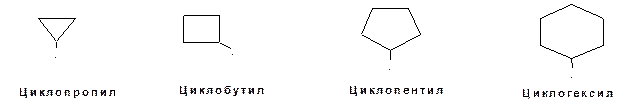
Схема 4. Примеры структурных формул одновалентные циклических радикалов.
Название спироалкана образуют от названия соответствующего алкана; цифрами в квадратных скобках указывают, сколько атомов углерода находится по каждую сторону от узлового атома углерода. Нумерацию атомов в молекуле спироалкана начинают с меньшего цикла от атома, соседнего с узловым.
В названии мостикового соединения в квадратных скобках указывают числа атомов углерода в цепочках, которые связывают узловые атомы. Нумерацию начинают с узлового атома в в сторону другого узлового атома по большей цепочке.
Изомерия.
Структурная изомерия циклоплканов обусловлена размером цикла, а для дизамещенных алканов также расположением заместителей относительно друг друга. Соответственно возможны три вида изомеров:
1. По числу углеродных атомов в кольце:

Схема 5. Примеры изомеров по числу углеродных атомов в кольце.
2. По числу углеродных атомов в заместителях:
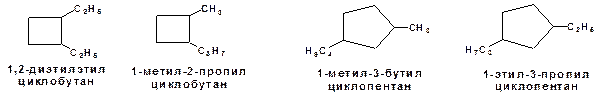
Схема 6. Примеры изомеров по числу углеродных атомов в заместителях.
3. По расположению заместителей в кольце:
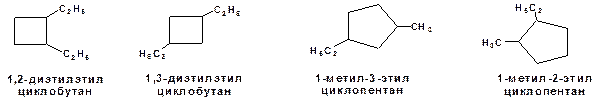
Схема 7. Примеры изомеров по расположению заместителей в кольце.
При наличии двух заместителей возможна геометрическая и оптическая изомерия. Два заместителя по разные стороны плоскости цикла образуют транс-изомер, а два заместителя по одну сторону плоскости цикла образуют цис-изомер:
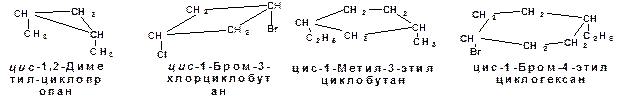
Схема 8. Примерыцис-, транс-изомеров.
Геометрическая (цис-, транс-изомерия) изомерия наблюдается при всех положения заместителей, кроме геминального (заместители у одного углеродного атома). Геометрические изомеры в алициклическом ряду очень устойчивы, поскольку изомеризация одного геометрического изомера в другой требует разрыва цикла и последующего его замыкания или разрыва связи углеродного атома цикла с заместителем и образования новой связи с другой стороны плоскости цикла.
Оптическая изомерия проявляется в том случае, если молекула не имеет плоскости симметрии. В циклогексановом ряду это, например, наблюдается при 1,2- и 1,3-транс-положениях заместителей:

Схема 8. Примеры оптических изомеров.
Напряжение циклов, конформации.
В алициклическом ряду существенное значение имеет поворотная изомерия. При этом устойчивость конформеров алициклических соединений определяется напряжением цикла. Различают четыре вида напряжений, обусловленных особенностью циклического строения молекул:
1. Искажение валентных углов или Байеровское напряжение.
2. Торсионное напряжение, связанное с отклонением от наиболее выгодной заторможенной конформации или Питцеровское напряжение.
3. Трансаннулярное взаимодействие (взаимодействие валентно несвязанных атомов и функциональных групп) или наряжение Прелога.
4. Изменение длин связей.
О напряжении в цикле можно судить по теплоте сгорания циклических соединений. Теплота сгорания, приходящаяся на одну группу СН2, наименьшая для циклогексана. Если напряжение в этом цикле принять за нуль, то, например, в трехчленном цикле оно составит 38.1 кДж на одну группу СН2, а пятичленном – 5.4 кДж . В циклах с числом атомов больше шести энергия напряжения, приходящаяся на одну группу СН2 составлдяет 0 – 6 кДж.
Судя по приведенным данным термохимии напряжение, наиболее ярко выражено для молекулы циклопропана. Циклопропан имеет плоский углеродный скелет (три точки всегда лежат в одной плоскости), поэтому атомы водорода находятся в энергетически невыгодном заслоненном положении:
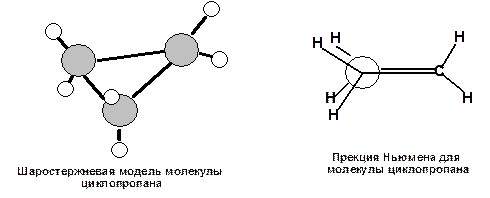
Схема 9. Шаростержневая модель и проекция Ньюмена для молекулы циклопраопана.
В молекуле циклопропана ввалентные углы С-С-С составляют 600, а валентные углы Н-С-Н составляют 1180. Значения валентных углов показывают, что гибридные орбитали атомов углерода не равноценны. Две орбитали, образующие связи С-Н, имеют больший s-характер, чем обычная sp3–орбиталь, а две орбитали, образующие связи С-С, имеют характер больший p-характер. Это делает их похожими на p–орбитали. Если sp3–орбитали в обычных связях С-С перекрываются по прямой, соединяющей ядра атомов, то в циклопропане перекрывание орбиталей происходит с некоторым отклонением от прямой. В результате связи С-С оказываются изогнутыми, их называют «банановыми связями» или τ-связями:
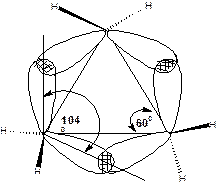
Схема 10. Модель банановых связей в молекуле циклопропана.
Валентный угол между τ-связями около 1040. По своему характеру τ-связи занимают промежуточное положение между σ и π-связями, поэтому в некоторых реакциях циклопропан проявляет свойства ненасыщенного соединения.
Циклобутан также относится к напряженным циклам, хотя угловое напряжение в нем значительно меньше, чем в циклопропане. Четырехчленный цикл устойчивее трехчленного. Торсионное напряжение в циклобутане уменьшается за счет неплоской конформации, в которой молекула представляет собой слегка «согнутый» по диагонали квадрат (угол сгиба составляет около 300). Для монозамещенных циклобутанов возможно существование конформеров, незначительно различающихся по энергии.
В циклопентане, если его представить в виде плоского цикла - валентные углы составили бы 1080, что незначительно отличается от нормального угла 109,50.. Однако, при отсутствии углового напряжения в плоском циклопентане проявляется торсионное напряжение, которое уменьшается при переходе цикла в неплоские конформации. Более устойчивой является твист-конформация (от англ. twist - скрученный), в которой три атома углерода располагаются в плоскости, а два других - над и под плоскостью. Менее устойчива конформация конверта, когда в плоскости лежат четыре атома, а пятый находится над или под плоскостью. Энергетические различия в конформациях циклопентана невелики, поэтому все атомы поочередно выходят из плоскости, в результате чего цикл находится в непрерывном волнообразном движении.
В молекуле циклогексана могут быть сохранены обычные валентные углы при условии его существования в неплоских конформациях «кресла» и «ванны». Конформация «кресла» на 20,9 кДж/моль менее напряжена. Поэтому циклогексан существует преимущественно в виде двух предельных конформеров «кресло». Причем цикл претерпевает непрерывную инверсию с промежуточным возникновением конформации «ванна»:

Схема 11. Конформационные модели молекулы циклогексана.
В конформации «кресло» 12 связей С-Н разделяются на две группы. Шесть связей направлены радиально от цикла к периферии молекулы. Эти связи называются экваториальными и обозначаются символом «е». Остальные шесть связей направлены строго параллельно друг-другу и оси симметрии третьего порядка. Эти связи называются аксиальные и обозначаются символом «а». Три из них направлены в одну сторону от плоскости цикла, а три – в другую, причем имеет место чередование:
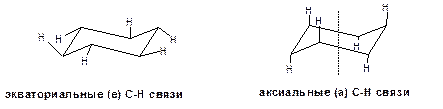
Схема 12. Экваториальные «е» и аксиальные «а» С-Н связи молекулы циклогексана.
Если один из атомов водорода заместить какой-либо группой, например, метильной, то заместитель в циклогексане может занять либо аксиальное, либо экваториальное положение. Исследования физическими методами показали, что если возможен выбор, то заместитель неизменно становится в экваториальное положение:

Схема 13. Экваториальное и аксиальное положения заместителя в молекуле циклогексана.
Это не означает, что с появлением заместителя прекращается инверсия цикла. В случае метилциклогексаена инверсия происходит со скоростью 106 качаний в 1секунду. Но в равновесии преобладает экваториальная форма, так как в этом случае меньше пространственные затруднения.
Способы получения.
Природным источником некоторых циклоалканов является нефть. В Грозненской нефти В.В. Марковников обнаружил циклопентан и циклогексан, а также их гомологи. После чего этим соединениям было дано название нафтены. Однако большинство циклоалканов получают синтетически. Способы получения циклоалканов делятся на: общие и специальные.
Общие
К общим способам относятся:
1. Способы, приводящие к получению цикла с числом углеродных атомов таким же, как в исходном дигалоидалкане. Например, дегалогенирование дигалогенпроизводных с помощью натрия или цинка (металлоорганический синтез):
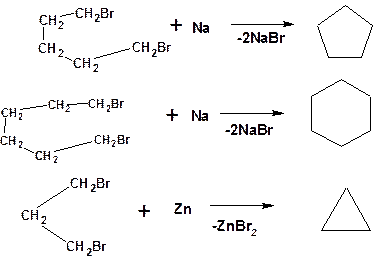
Схема 14. Схемы синтеза с сохранением числа углеродных атомов.
2. Способы, приводящие к получению цикла с числом углеродных атомов большим, чем в исходном дигалоидалкане. Например, взаимодействие дигалогенпроизводных с эфиром малоновой кислоты в присутствии щелочи.
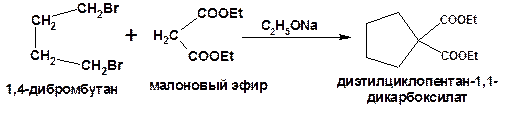
Схема 14. Схема синтеза с увеличением числа углеродных атомов.
Полученный таким образом эфир гидролизуют и декарбоксилируют нагреванием до циклопентанкарбоновой кислоты.
3. Способы, приводящие к получению цикла с числом углеродных атомов меньшим, чем в исходном дигалоалкане. Например, декарбоксилирование солей двухосновных кислот (пиролиз):
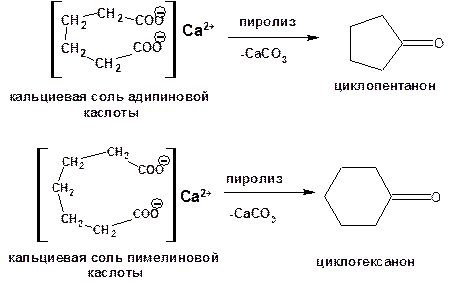
Схема 15. Схема синтеза с уменьшением числа углеродных атомов.
Циклоалканоны легко превращаются в циклоалканы восстановлением карбонильной группы.
Специальные
Специальные способы получения алициклических соединений применимы только для получения соединений с определенной величиной цикла.
1. Соединения с трехчленным циклом получают присоединением карбенов к алкенам по типу [2+1]-циклоприсоединения:

Схема 16. Схема синтеза трехчленных циклов.
2. Соединения с четырехчленным циклом получают несколькими путями с использованием алкенов и диеновых углеводородов:
димеризацией аллена получают диметиленциклобутан:
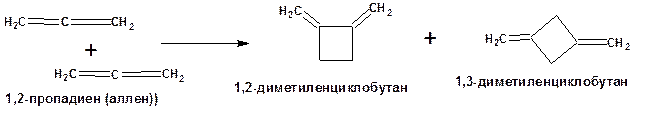
Схема 17. Схема димеризации аллена.
Димеризация этилена под действием УФ-света:
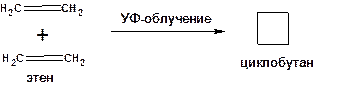
Схема 18. Схема димеризации этилена.
в ходе внутримолекулярных электроциклических реакций, протекающих как при нагревании, так и при фотовозбуждении:
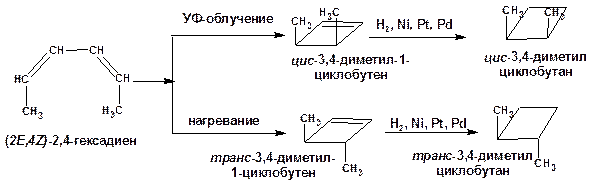
Схема 19. Схема электроциклических реакций.
Образующиеся циклические углеводороды легко переводятся гидрированием в циклоалканы и их производные.
3. Соединения с шестичленным циклом получают гидрированием соответствующих ароматических соединений:
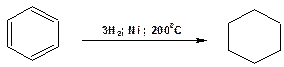
Схема 20. Схема гидрирования бензола.
а также по реакции диенового синтеза.
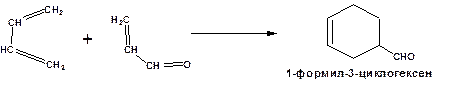
Схема 21. Схема реакции диенового синтеза.
Дата добавления: 2017-08-01; просмотров: 4369;
